¿Qué pretenden realmente las llamadas terapias dirigidas? ¿Y qué progresos se han realizado en este sentido en las distintas neoplasias hemato-oncológicas? En el 21º Simposio Medicina en el Manege del Circo Knie, el Prof. Dr. med. Markus G. Manz, del Hospital Universitario de Zúrich, dio respuesta a las preguntas más candentes.
Según el Dr. Markus G. Manz, de la Clínica de Hematología del Hospital Universitario de Zúrich, los cánceres en el campo de la hemato-oncología representan alrededor del 10% de las neoplasias en Suiza. Se trata principalmente de las llamadas “enfermedades de la vejez”, es decir, afecciones que aparecen con mayor frecuencia a medida que aumenta la edad.
“Incluso si no se parte del escenario demográfico más extremo, sino de uno medio, se producirá una duplicación de la población mayor de 65 años de aquí a 2030. Así, en términos muy simplificados, cabe esperar una duplicación de las neoplasias hemato-oncológicas, lo que hace aún mayor la necesidad de terapias adecuadas”, explicó el Prof. Manz.
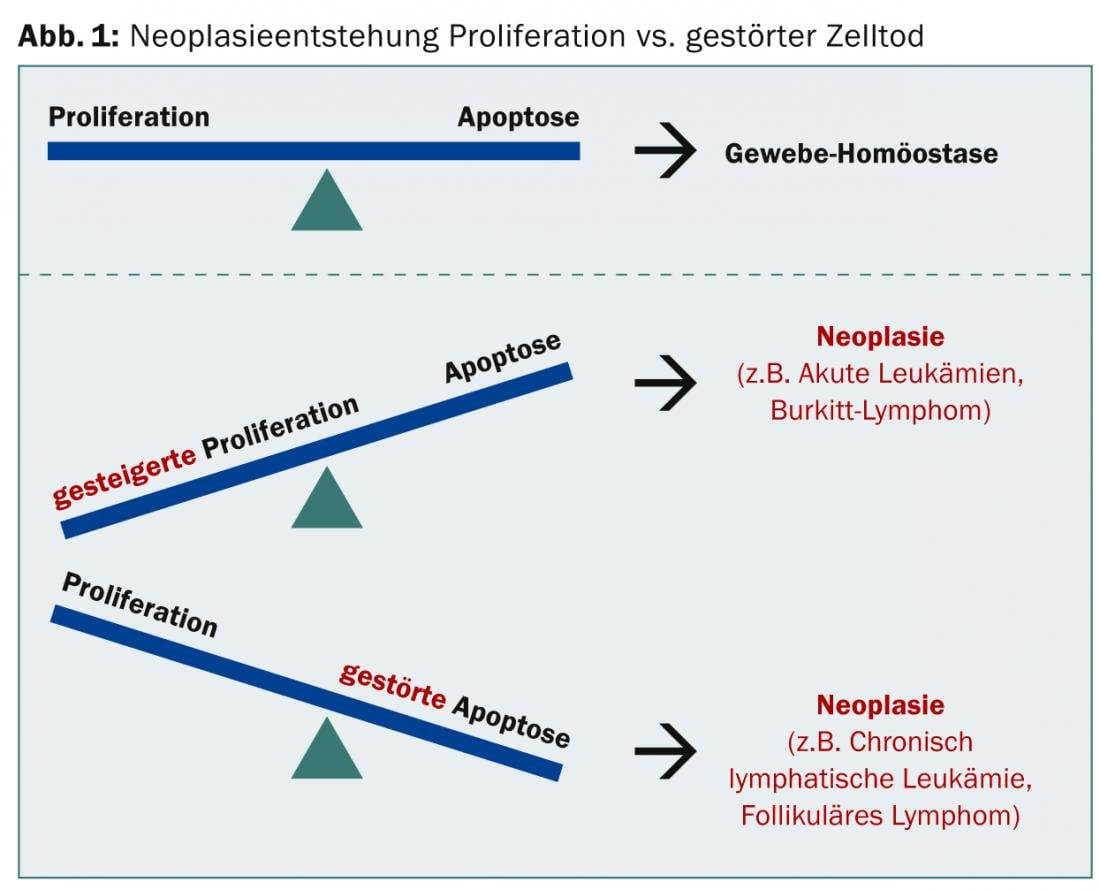
En el caso de una neoplasia, puede predominar el aumento de la proliferación o la alteración de la apoptosis, en ambos casos el equilibrio tisular ya no se da (Fig. 1).
Por otra parte, el ideal de la terapia dirigida es la mayor selectividad tumoral posible; sólo debe atacar al tumor, pero no a todo el paciente ni al tejido sano. “La llamada quimioterapia clásica no dirigida suele depender del ciclo celular, es decir, sigue el principio: mucha división – gran efecto”, afirmó el ponente. La terapia dirigida, en cambio, se dirige a los denominados “impulsores tumorales” que son esenciales para el tumor y, de este modo, destruye el tumor de forma eficaz y, al menos en teoría, con el menor número posible de efectos secundarios.
Las dos dianas más comunes son las enzimas/quinasas (intracelulares) y los antígenos de la superficie celular. Las primeras son inhibidas por las llamadas “pequeñas moléculas”, las segundas son atacadas por anticuerpos con o sin “munición” adherida.
Las quinasas transfieren un residuo de fosfato y, por tanto, pueden activar otras enzimas. Son esenciales para la transducción de señales en la célula. En el tejido tumoral, la quinasa está siempre activa, lo que provoca una división celular masiva. El inhibidor bloquea la quinasa y pone así la división celular en un estado inactivo. “Un ejemplo excelente de inhibidor de la quinasa es el imatinib. El rituximab, por su parte, es el representante más conocido de los anticuerpos monoclonales y supuso una auténtica revolución en todos los linfomas con expresión de CD20, lo que incluye prácticamente todos los linfomas de células B”, afirma el Prof. Manz.
¿Qué mejoras pueden introducirse?
Utilizando la leucemia mieloide crónica (LMC) como ejemplo, el Prof. Manz demostró que desde que se introdujeron por primera vez los inhibidores de la tirosina quinasa, alrededor de 2001, la eficacia del tratamiento ha aumentado considerablemente y la supervivencia a largo plazo ha mejorado notablemente como consecuencia de ello. “Alrededor del 5% de los pacientes con LMC que reciben imatinib son los llamados superrespondedores: aquí, por primera vez, se plantea la cuestión de una posible curación [1,2]”, afirma el Prof. Manz. “La consecuencia del éxito es una mayor expectativa en el campo de la LMC para el futuro próximo: 100% de supervivencia a largo plazo con 0% de reducción de la calidad de vida”.
Como segundo ejemplo, mencionó el desarrollo en el campo de la mielofibrosis primaria (PMF): la denominada mutación JAK-2 (Janus quinasa 2) se produce en aproximadamente el 50% de los casos de PMF. Menos de diez años después del descubrimiento y la identificación de esta mutación, se aprobó entonces el primer inhibidor de JAK. “Los datos muestran bajo ruxolitinib (Jakavi®), en comparación con la mejor terapia disponible, una mejora del control de los síntomas y de la calidad de vida [3], así como una mejor supervivencia global en comparación con el placebo [4]. Pero: los inhibidores JAK-1&2 también son activos en JAK-2 no mutado. Entonces, ¿la diana selectiva en el tumor no es relevante en absoluto?”, se preguntó el Prof. Manz.
El último tema fue la leucemia linfocítica crónica (LLC). En este caso, la adición de un anticuerpo anti-CD20 a la quimioterapia ha demostrado ser más eficaz que la quimioterapia sola. Además, los anticuerpos anti-CD20 optimizados como el GA101 (obinutuzumab) funcionan mejor que los de primera generación [5].
“Actualmente, también hay estudios que investigan la eficacia de la inhibición de la cinasa en la LLC [6]. Una amplia aplicación de este modo de acción en el linfoma B no Hodgkin es muy probable en un futuro próximo”, concluye el Prof. Manz.
Fuente: 21º Simposio Medicina en el Manicomio, 5 de junio de 2014, Zúrich
Literatura:
- Mahon FX, et al: Interrupción del imatinib en pacientes con leucemia mieloide crónica que han mantenido una remisión molecular completa durante al menos 2 años: el ensayo prospectivo y multicéntrico Stop Imatinib (STIM). Lancet Oncol 2010 nov; 11(11): 1029-1035.
- Ross DM, et al: Seguridad y eficacia del cese del imatinib en pacientes con LMC con enfermedad mínima residual estable indetectable: resultados del estudio TWISTER. Sangre 2013 Jul 25; 122(4): 515-522.
- Harrison C, et al: Inhibición JAK con Ruxolitinib frente a la mejor terapia disponible para la mielofibrosis. N Engl J Med 2012; 366: 787-798.
- Verstovsek S, et al: Resultados a largo plazo del tratamiento con ruxolitinib en pacientes con mielofibrosis: Actualización a 3 años de COMFORT-I. Sangre 2013; 122(21): 396.
- Goede V, et al: Obinutuzumab más clorambucil en pacientes con LLC y enfermedades coexistentes. N Engl J Med 2014; 370: 1101-1111.
- Byrd JC, et al: Ibrutinib frente a ofatumumab en la leucemia linfoide crónica tratada previamente. NEJM 31 de mayo de 2014. DOI: 10.1056/NEJMoa1400376.
InFo ONCOLOGÍA Y HEMATOLOGÍA 2014; 2(6): 33-34