La génesis de la poliartritis reumatoide (AR) sigue sin estar muy clara. Sin embargo, con la introducción de los nuevos biológicos -tras décadas de investigación inmunológica- por fin se han desarrollado nuevas y revolucionarias estrategias de tratamiento para esta enfermedad, que hasta ahora sólo podía tratarse de forma incompleta.
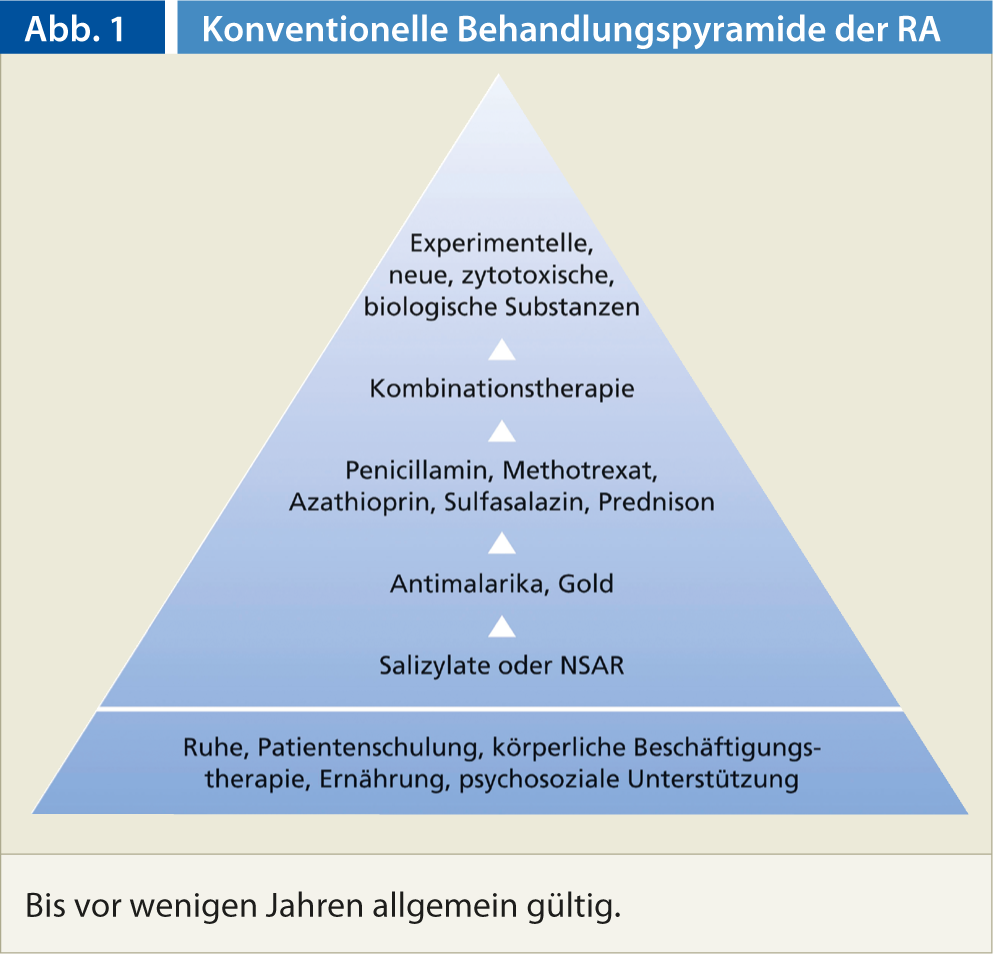
Hasta ahora, el tratamiento farmacológico de la artritis reumatoide se ha basado en la pirámide de tratamiento convencional (Fig. 1). El modelo piramidal se basa, por un lado, en el concepto de riesgo-beneficio y, por otro, en la suposición de que el pronóstico de la AR es generalmente favorable. La anterior pirámide de tratamiento se ha modificado ahora para que la terapia con fármacos antirreumáticos modificadores de la enfermedad (DMARD) y biológicos comience mucho antes.
Las razones son múltiples: para empezar, la artritis reumatoide no es una enfermedad benigna. Además, los antiinflamatorios no esteroideos (AINE) no son inocuos, su toxicidad gastrointestinal y otros efectos secundarios causan una morbilidad y mortalidad considerables. También es importante tener en cuenta que la terapéutica básica no es más tóxica que los AINE en manos expertas. Por último, pero no por ello menos importante, con el uso precoz de biológicos se pueden atajar las formas agresivas de artritis reumatoide en una fase temprana, influir significativamente en la enfermedad y, en algunos casos, incluso ponerla en remisión.
Terapias básicas modificadoras de la enfermedad (DMARD)
Los fármacos antirreumáticos modificadores de la enfermedad (DMARD)(Tabla 1) se utilizan para la poliartritis clínica y humoralmente activa, mucho antes de que se hayan producido cambios biológicos. Esto es especialmente cierto en cuanto se confirma el diagnóstico de artritis reumatoide. En la actualidad, el metotrexato es el agente terapéutico básico de primera elección, que ha sustituido por completo al oro, que solía ser el agente principal. El metotrexato no es más tóxico que los AINE o los corticosteroides en manos expertas. Otra ventaja de este fármaco es su gama de administración (per os, i.v., i.m., s.c., como jeringa precargada para autoinyección).
Biológicos actuales
Puede encontrar una visión general de los biológicos en Tabla 2.
inhibidores del TNF-α (Fig. 2, 3): En 1998, se registró como fármaco un primer antagonista del factor de necrosis tumoral-α (inhibidor del TNF-α). Actualmente, están disponibles los principios activos Etanercept (Enbrel®), Infliximab (Remicade®) así como Adalimumab (Humira®) y, desde 2010, Golimumab (Simponi®) y Certolizumab (Cimzia®). Se diferencian, por un lado, en la duración de la acción y, por otro, en el modo de aplicación (c.s. semanal, c.s. quincenal, c.s. quincenal y de 2 a 3 meses i.v. en infusión).
Los inhibidores del TNF-α reducen tanto la hinchazón como el dolor articular hasta en un >50% y reducen los parámetros inflamatorios. También se cree que estos agentes inhiben, aunque no impiden por completo, la progresión de los cambios radiológicos. Los inhibidores del TNF-α funcionan especialmente bien en combinación con el metotrexato. Se utilizan tras una respuesta insuficiente (3-6 meses) o efectos secundarios del tratamiento con DMARD. La prescripción debe ser aprobada por el responsable médico del seguro de enfermedad.
Las contraindicaciones son las infecciones floridas o latentes (VIH, hepatitis, tuberculosis), así como las neoplasias malignas o el tratamiento reciente de las mismas. Por ello, antes de iniciar una terapia, es importante buscar, o más bien encontrar, el tratamiento adecuado. es necesario excluir las infecciones latentes. El nuevo inhibidor del TNF-α certolizumab (Cimzia®) puede utilizarse incluso durante el embarazo.
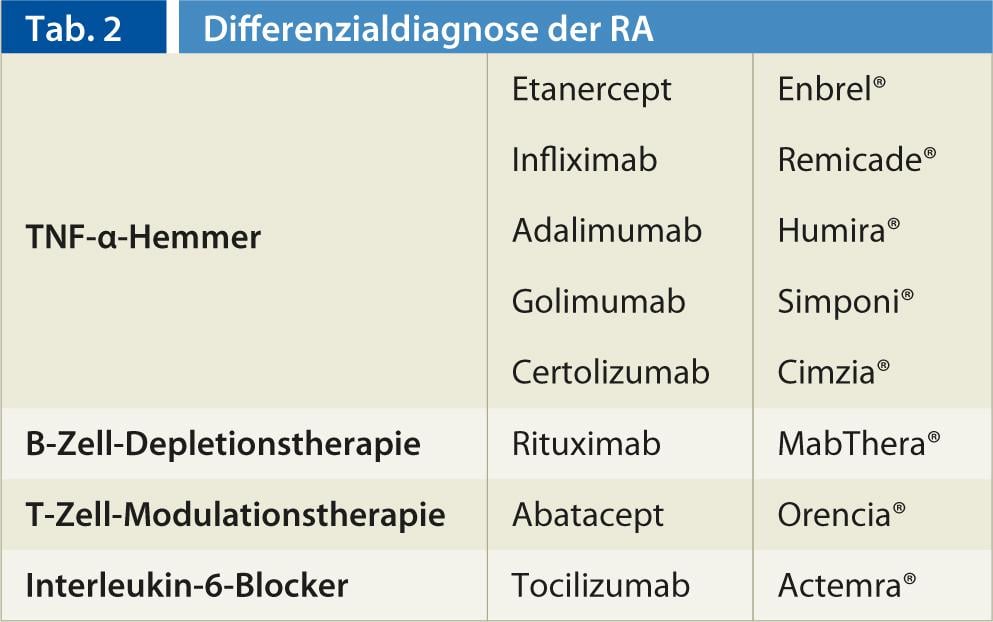
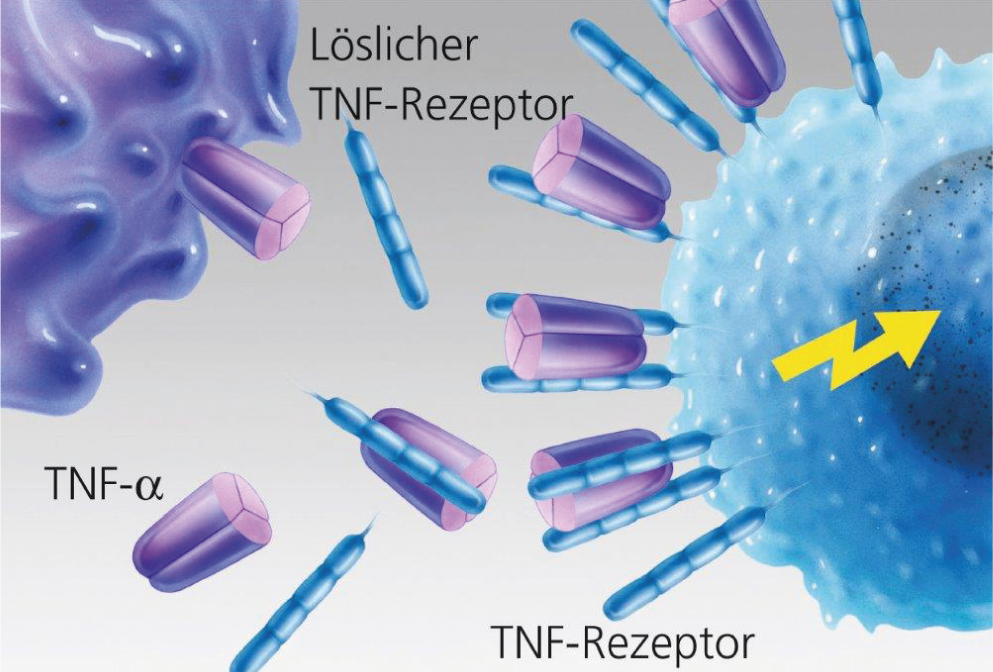
Fig. 2: Unión sin obstáculos del TNF-α a la célula diana.
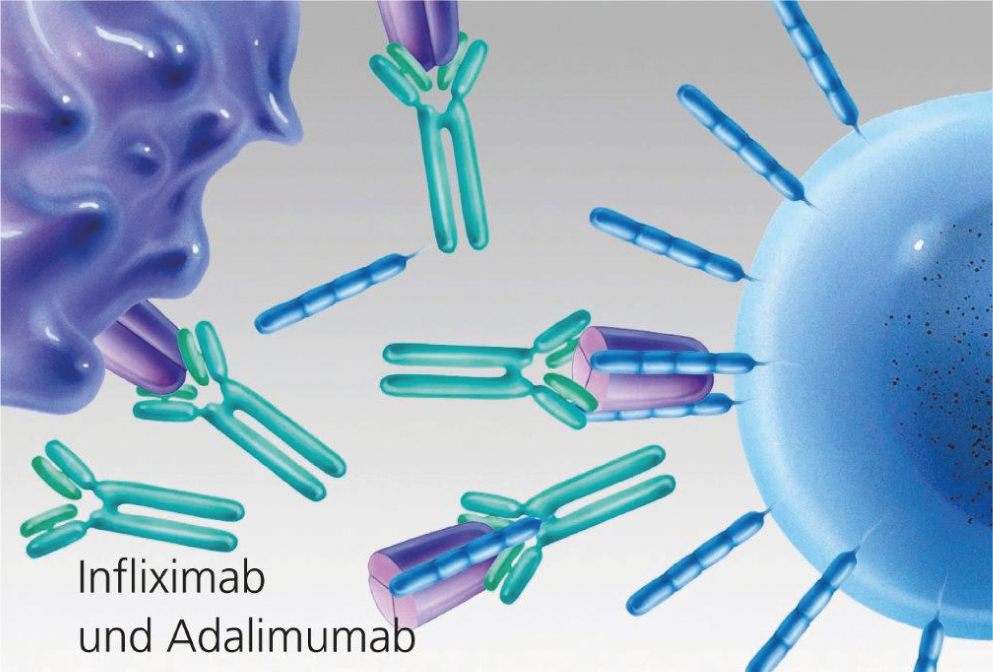
Fig. 3: Bloqueo del TNF mediante anticuerpos monoclonales (infliximab y adalimumab).
Terapia de depleción de células B: La introducción del anticuerpo monoclonal anticélulas B altamente específico rituximab (MabThera®) en la terapia reumatoide en 2006 aportó una nueva perspectiva a la gama Biological. El rituximab es un anticuerpo monoclonal quimérico ratón/humano que se une específicamente al antígeno transmembrana CD20, que se encuentra en gran número en la superficie de los linfocitos B. El rituximab se utiliza para tratar el linfoma no Hodgkin desde 1997. La ventaja del rituximab sobre la terapia con TNF-α es que no se produce un aumento de las infecciones oportunistas o de otro tipo. El rituximab se administra en infusión (2 infusiones a intervalos de 14 días) y el tratamiento puede repetirse a intervalos de seis a doce meses. Sin embargo, el efecto máximo sólo se produce al cabo de unas semanas o meses.
Terapia de modulación celular: Existe otra terapia biológica en forma del modulador de células T Abatacept (Orencia®). Abatacept es una proteína de fusión totalmente humana que une las moléculas comoduladoras CD-80 y CD-86 a las células T para que ya no puedan activarse. Por ello se denomina bloqueante de la coestimulación de las células T. Abatacept está aprobado en Suiza como tratamiento de infusión mensual desde agosto de 2007, y desde abril de 2012 también como forma de administración subcutánea (jeringa precargada semanal). Se sospecha una ralentización de la actividad de la enfermedad, así como una progresión radiológica. En general, el abatacept parece tener un perfil de efectos secundarios favorable, rara vez se producen reacciones a la infusión e infecciones oportunistas, y no se puede hacer ninguna afirmación clara sobre el riesgo de malignidad basándose en los datos disponibles hasta la fecha. Una pequeña desventaja es quizás que el efecto sólo se produce con una cierta latencia (3-6 meses), pero luego dura mucho tiempo y apenas o no disminuye en el curso posterior.
Bloqueantes de la interleucina-6: La interleucina-6 (IL-6) es una citocina clave en el proceso inflamatorio y está presente específicamente en los tejidos de la sinovitis reumatoide de forma paralela a la actividad inflamatoria. El anticuerpo monoclonal tocilizumab (Actemra®) se une a los receptores de IL-6 solubles y expresados en la membrana e inactiva la IL-6 de modo que ya no puede ejercer un efecto proinflamatorio en la célula. El tocilizumab está aprobado en Suiza desde 2009. El tocilizumab se administra en infusiones mensuales. Una gran ventaja es el inicio de acción muy rápido y convincente.
La experiencia con los biológicos hasta ahora
Desde 1998, cada vez más pacientes con artritis en Europa y también en Suiza han sido tratados con los nuevos biológicos, especialmente con los inhibidores del TNF-α, que cada vez se utilizan antes en el tratamiento de la AR. La supervisión de estas terapias por especialistas experimentados es necesaria para reconocer y tratar a tiempo los efectos secundarios. Las infecciones graves incontrolables siguen siendo los efectos secundarios más temidos de este grupo de fármacos. Los efectos secundarios leves incluyen dolor y ardor en el lugar de la inyección, aumento de la sudoración, fluctuaciones de la tensión arterial.
En los últimos años, se ha observado la formación de anticuerpos en casos individuales de terapia con inhibidores del TNF-α , que conducen a una disminución o pérdida de eficacia, por lo que es necesario cambiar a otro biológico. En las terapias de infusión, especialmente con anticuerpos monoclonales, muy raramente pueden producirse reacciones alérgicas más graves hasta la anafilaxia. En la actualidad, estas terapias de infusión se llevan a cabo bajo una estrecha supervisión y por personal debidamente formado. En nuestra propia población de pacientes, ninguna de estas terapias tuvo que interrumpirse debido a efectos secundarios graves.
Outlook
Para todos los biológicos, se necesitan más estudios sobre los efectos secundarios, la eficacia y la tolerabilidad, especialmente para la administración a largo plazo. En vista de la naturaleza heterogénea de las enfermedades reumáticas inflamatorias, en el futuro debería ser posible definir aún mejor qué pacientes se benefician más de qué agente activo; aún no existen directrices reales al respecto. Los preparados existentes se complementan o sustituyen continuamente por nuevas generaciones de anticuerpos monoclonales, y también se sigue trabajando en la simplificación del método de aplicación.
CONCLUSIÓN PARA LA PRÁCTICA
- La inflamación articular es reversible, el daño articular secundario no lo es.
- Cuanto antes se diagnostique la AR y cuanto más eficazmente se trate la enfermedad, mejor será evitar el daño articular permanente y ralentizar y posiblemente prevenir la progresión radiográfica.
- En la terapia actual de la AR, el concepto de tratamiento convencional (pirámide de tratamiento) se adapta a la actividad respectiva de la enfermedad.
- Con los biológicos, ha comenzado una nueva era en el tratamiento de las enfermedades inflamatorias reumáticas. La remisión se ha convertido en un objetivo realista del tratamiento.
Literatura:
- Bartelds GM, et al: Dtsch Med Wochenschrift 2011; 136: 1410.
- Ernst J: Acta Rheumatol 2005; 30: 119-124.
- Forster A: Ars Medici 1/2009.
- Kyburz D: Rheuma Schweiz, número 4, julio de 2011.
- Visser K, et al: Ann Rheum Dis 2010; 69: 1333-1337.
- Grigor C, et al: Lancet 2004; 364: 263-269.
- Goekoop-Ruiterman YP, et al: Ann Intern Med 2007; 146: 406-415.
- Goekoop-Ruiterman YP, et al: Ann Rheum Dis 2007; 6: 1227-1232.
- Quinn MA, et al: Arthritis Rheum 2005; 52: 27-35.
- Smolen JS, et al: Arthritis Rheum 2006; 54: 702-710.