El tratamiento eficaz de la apoplejía se lleva a cabo en centros especializados (unidades de apoplejía y centros de apoplejía) por un equipo experimentado y especializado. El tratamiento estándar en la fase aguda es la trombólisis sistémica y, si se ocluye un vaso proximal, la trombectomía endovascular. El éxito del tratamiento depende en gran medida del tiempo. Por lo tanto, el reconocimiento precoz de los síntomas del ictus y la derivación rápida a un hospital con la experiencia adecuada en el tratamiento agudo son esenciales.
El ictus isquémico se caracteriza por la aparición aguda de un déficit neurológico focal debido a una reducción circunscrita del flujo sanguíneo al cerebro. Con aproximadamente 150 eventos por cada 100.000 habitantes al año, es la tercera causa de muerte en los países industrializados y la causa más común de discapacidad permanente en la edad adulta. Casi la mitad de los supervivientes siguen discapacitados y/o necesitan cuidados. Se ha demostrado que el tratamiento de urgencia de los pacientes con ictus mejora la supervivencia y reduce la discapacidad y la incapacidad.
Fisiopatología: Penumbra/núcleo del infarto
El metabolismo estructural es necesario para mantener la estructura celular. Si no se consigue, se producen daños irreversibles en la célula. Además, se proporciona energía en el metabolismo funcional para la actividad activa de la función neuronal. Si no se alcanza el umbral de isquemia, el metabolismo funcional falla con perturbación de las funciones neuronales eléctricas y síntomas clínicos. La disfunción es principalmente reversible si se restablece rápidamente el flujo sanguíneo normal. Normalmente, la alteración circulatoria es más pronunciada en el centro (núcleo del infarto) que en la zona periférica (penumbra), donde una cantidad residual de sangre fluye a través de colaterales. Con el tiempo, se produce un agrandamiento gradual del núcleo del infarto a expensas de la penumbra. La rapidez de este proceso es muy variable y depende sobre todo de la colateralización.
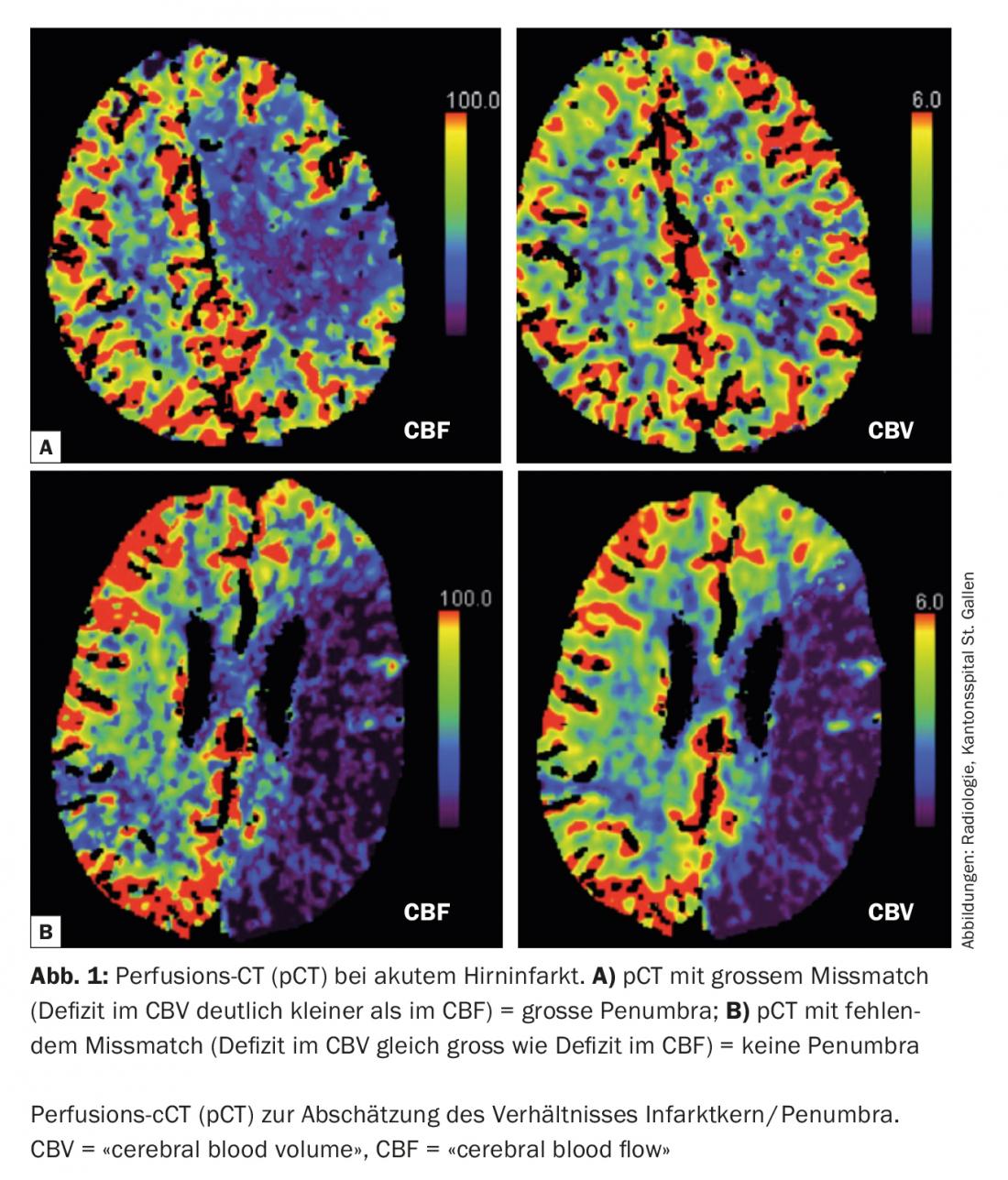
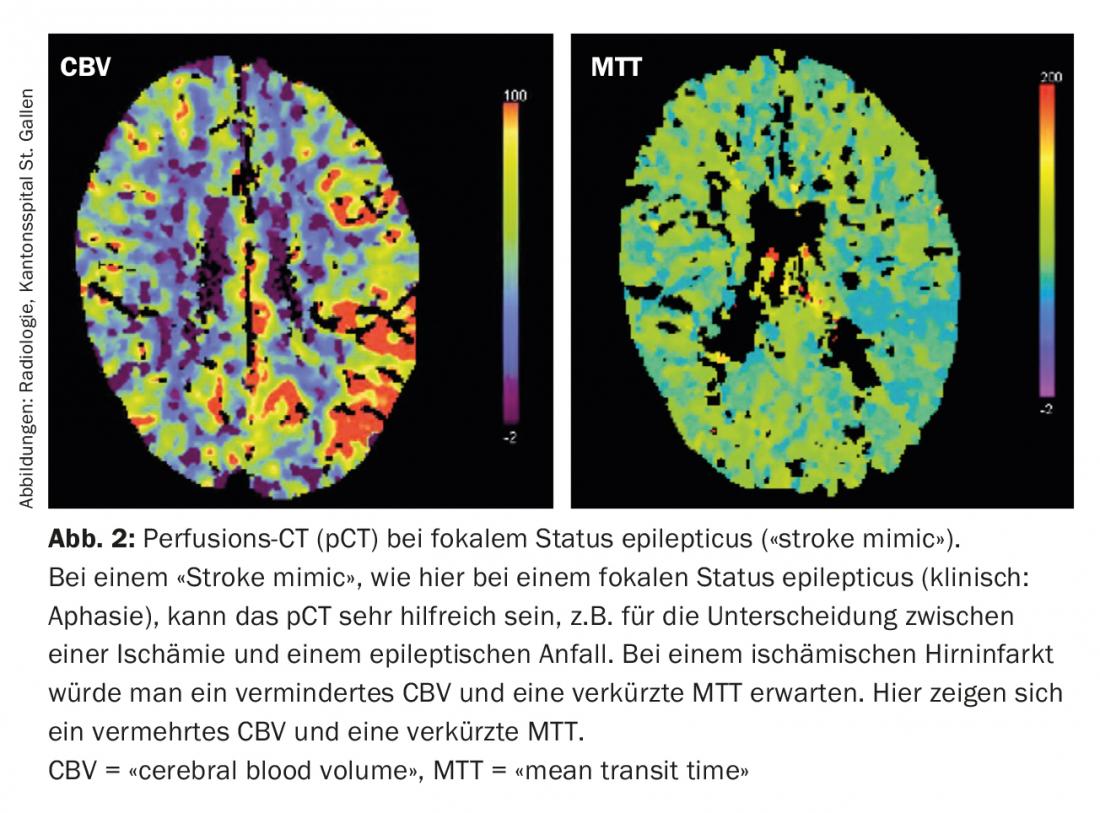
Hoy en día, es posible estimar el tamaño de la penumbra y del núcleo del infarto en la situación aguda mediante imágenes multimodales (TC, RM) (Fig. 1) . Esta información es de relevancia terapéutica especialmente para las decisiones límite. Además, las imágenes multimodales pueden proporcionar información valiosa en la diferenciación de las llamadas “imitaciones de ictus” (enfermedades que simulan la imagen de un ictus isquémico) y evitar así terapias agudas no indicadas (Fig. 2).
Clasificación clínica del ictus isquémico
Los síntomas del infarto cerebral isquémico se dividen clínicamente (Clasificación del Proyecto Comunitario de Oxford sobre el Ictus) en los de la circulación anterior o posterior y en síndromes lacunares. En la circulación anterior, se distingue entre “Síndrome de circulación anterior total” (SCAT, 16%) y “Síndrome de circulación anterior parcial” (SCAP, 32%), en función de la extensión de la zona infartada. El “síndrome de circulación posterior” (POCS, 21%) se distingue de éste. Si existe un hemisíndrome puramente motor, sensorial, sensomotor o atáxico sin signos corticales (afasia, negligencia), se denomina síndrome lacunar (LACS, 31%) [2].
Etiología del infarto
Existen varias clasificaciones etiológicas del ictus isquémico, siendo la clasificación TOAST la más conocida. Divide la carrera en:
- Macroangiopatía: causa aterosclerótica del ictus. Generalmente una >estenosis vascular sintomática del 50% de los vasos que irrigan el cerebro.
- Embolia cardiaca: Evidencia de al menos una fuente cardiaca relevante de embolia (por ejemplo, fibrilación auricular).
- Microangiopatía: Infartos cerebrales localizados subcorticalmente con un diámetro <15 mm.
- Otra etiología: Por ejemplo, disección vascular, trastornos de la coagulación.
- Etiología poco clara: Cuando no se encuentra ninguna causa o se encuentran varias causas concurrentes [3].
Una clasificación más reciente y diferenciada es la clasificación ASCOD, que se propuso en 2009 [4] y se presentó en una versión revisada en 2013 [5]. Registra y pondera todas las posibles causas de un ictus. Se distinguen cinco fenotipos A (“ateromatosis”/macroangiopatía), S (“enfermedad de pequeños vasos”/microangiopatía), C (“cardiaca”/cardiopatía), O (“otra causa”/otra causa) y D (“disección”/disección), cada uno con tres grados de causalidad. Estos son: 1. enfermedad presente y causa potencial, 2. Enfermedad presente, pero causalidad incierta, 3. enfermedad presente, causalidad improbable, 0. enfermedad no presente, 9. aclaraciones insuficientes para hacer una clasificación. Para ello se define una norma mínima de clarificación. Las ventajas sobre la clasificación TOAST son Sin agrupación rígida, sin grupo criptogénico, ponderación diferenciada en tres niveles.
Otro concepto etiológico reciente es el ictus isquémico embólico criptogénico, el ictus embólico de origen indeterminado (ESUS). La definición operativa incluye el diagnóstico por imagen con exclusión de los infartos lacunares. Además, la ecografía, la ATC o la ARM deben utilizarse para excluir estenosis hemodinámicamente relevantes de los vasos que suministran sangre al cerebro en el territorio vascular del infarto actual. La prueba diagnóstica cardiaca mínima para excluir la fibrilación auricular es la monitorización Holter de 24 horas [6]. Dado que es probable que la mayoría de los ictus que cumplen los criterios del ESUS sean de naturaleza embólica y no se han realizado ensayos de prevención secundaria específica para esta entidad, actualmente se están llevando a cabo dos grandes ensayos aleatorios de anticoagulantes orales directos (dabigatrán o rivaroxabán) frente al ácido acetilsalicílico.
Terapia aguda
Fase de prehospitalización: Dado que el éxito del tratamiento agudo de los pacientes con un infarto cerebral isquémico depende en gran medida de la latencia entre la aparición de los síntomas y el inicio del tratamiento (“el tiempo es cerebro”), el reconocimiento rápido de los síntomas del ictus y la respuesta a los mismos pueden tener un impacto significativo en el resultado del tratamiento. Esto se aplica tanto a la población como al personal médico. Los síntomas más comunes del ictus agudo son los síndromes de hemiparesia motora o sensorial repentina, trastornos del habla, defectos del campo visual o imágenes dobles, trastornos de la coordinación y también mareos. (Tab. 1). Si aparecen estos síntomas, hay que avisar lo antes posible al servicio de urgencias (teléfono 144) y organizar el traslado al hospital, preferiblemente a un centro especializado con mandato de tratamiento de agudos dentro de una red de ictus.

Las principales razones de un retraso en la fase prehospitalaria son el desconocimiento de la población y/o la falta de reconocimiento de los síntomas del ictus, así como la canalización insuficiente del transporte al hospital más cercano con posibilidad de tratamiento del ictus agudo. En Suiza, la certificación geográficamente bien distribuida de los actuales 9 centros de ictus y 14 unidades de ictus, con la necesaria formación de redes de ictus, ha conducido a una atención más completa y técnicamente mejor de los pacientes con ictus. Sin embargo, a menudo sigue pasando bastante más de una hora hasta que se puede administrar al paciente con ictus una terapia aguda.
Las medidas inmediatas in situ incluyen: Una elevación de 30° de la parte superior del cuerpo o una posición lateral estable si existe riesgo de aspiración. Un control del pulso y de la tensión arterial, en el que los valores de tensión arterial hipertensiva no deben tratarse mientras no se supere el límite crítico de tensión arterial (sistólica >220 mmHg). Debe procurarse la determinación de la glucemia capilar, mantener despejadas las vías respiratorias y la oxigenación suplementaria (2-4 L de oxígeno por cánula nasal). Además, debe colocarse una vía intravenosa periférica. No se recomienda la administración primaria de aspirina porque en la fase de prehospitalización no es posible distinguir entre los distintos subtipos de ictus, el 80-85% de los cuales es isquémico y el 15-20% se debe a una hemorragia.
Fase de hospitalización: El objetivo principal en el tratamiento del ictus agudo es la revascularización del vaso ocluido. Hoy en día, existen diversas opciones terapéuticas con sólidas pruebas científicas de eficacia disponibles para este fin.
Trombólisis sistémica: Tras el diagnóstico agudo con examen neurológico e imagen craneoencefálica, la trombólisis sistémica con administración intravenosa de activador del plasminógeno recombinante (rt-PA) se realiza en las primeras 4,5 horas tras el inicio de los síntomas después de comprobar la indicación y las contraindicaciones. El efecto terapéutico de la trombólisis sistémica se ha confirmado de forma impresionante en varios ensayos aleatorios y también en un metaanálisis reciente, pero, como ya se ha mencionado, depende en gran medida del tiempo. El “número necesario a tratar” (NNT) para lograr un buen resultado funcional en un paciente más aumenta de 3 en los primeros 90 minutos a 7 entre 0 y 3 horas y a 14 entre 3 y 4,5 horas. Un buen resultado del tratamiento funcional significa que el paciente es capaz de llevar una vida independiente tras el ictus y no depende de la ayuda de otros. El efecto se extiende a todas las categorías de edad y niveles de gravedad [7,8]. Si hay una oclusión de un vaso cerebral mayor, en los últimos años se han establecido procedimientos complementarios de terapia de recanalización endovascular.
Trombectomía: Hasta 2015, no existían pruebas convincentes de la eficacia de este procedimiento. Esto ha cambiado con la publicación de cinco grandes estudios (MR CLEAN, ESCAPE, REVASCAT, SWIFT PRIME y EXTEND IA). En todos los estudios, los pacientes con oclusión proximal de un vaso cerebral anterior recibieron trombectomía endovascular o trombólisis sistémica hasta 12 horas después del inicio de los síntomas. Se excluyó a los pacientes con infartos ya establecidos de gran tamaño, infartos en la zona estromal posterior y discapacidad ya relevante de antemano. El criterio de valoración primario fue el resultado funcional del tratamiento medido con la escala de Rankin modificada (mRS) después de 90 días. Mientras tanto, se han publicado varios metaanálisis de los datos de estos estudios. Según esto, la odds ratio (OR) de un buen resultado funcional del tratamiento (mRS 0-2) es de 2,42 y el NNT es de 5 [9], para una mejora de al menos un punto en la mRS incluso sólo 2,6. Todos los subgrupos de pacientes se benefician [10]. Es importante seleccionar a los pacientes que no sean demasiado complejos con la ayuda de un procedimiento radiológico de imagen seccional que incluya una angiografía. Busque signos tempranos de infarto y proporcione pruebas de la oclusión proximal del vaso. Los llamados stent retrievers son la norma técnica para el tratamiento. La ventana temporal para el tratamiento es generalmente de hasta seis horas después del inicio de los síntomas, en casos individuales incluso más. Una cuestión abierta es si los pacientes sólo deben ser sedados o tratados bajo anestesia general.
Tratamiento en una unidad de ictus: Además de la terapia aguda farmacológica y/o endovascular, numerosos estudios han demostrado también que el tratamiento en una unidad de ictus es superior al de una sala no especializada en muchos aspectos. La mortalidad en el primer año tras el suceso es relativamente menor en un 18-46% (3% absoluto) y la necesidad de cuidados de larga duración en un 25% [11]. Este efecto también es detectable en todos los grupos de pacientes. Un estudio realizado en Suiza pudo demostrar que el tratamiento inicial en una unidad de cuidados intensivos seguido de los cuidados de un equipo de ictus sin una sala definida es claramente inferior al tratamiento en una unidad de ictus claramente definida en términos geográficos y de personal en cuanto al resultado del tratamiento después de tres meses [12]. Esto debería ser incentivo suficiente para ofrecer el concepto en todo el país.
Literatura:
- Poeck y Hacke 2001, 11ª edición, Springer-Verlag Berlin, Heidelberg, Nueva York.
- Bamford J, et al: Clasificación e historia natural de los subtipos clínicamente identificables de infarto cerebral. Lancet 1991; 337: 1521-1526.
- Adams HP, et al: Clasificación del subtipo de ictus isquémico agudo. Definiciones para su uso en un ensayo clínico multicéntrico. TOSTADA. Ensayo de Org 10172 en el tratamiento del ictus agudo. Ictus 1993; 24; 35-41.
- Amarenco P, et al: Un nuevo enfoque para la subtipificación del ictus: la clasificación A-S-C-O (fenotípica) del ictus. Cerebrovasc Dis 2009; 27: 502-508.
- Amarenco P, et al: Fenotipado ASCOD del ictus isquémico (Fenotipado ASCO actualizado). Cerebrovasc Dis 2013; 36: 1-5.
- Diener HC, et al: Ictus isquémico criptogénico: ¿es hora de un cambio de paradigma en el diagnóstico y la terapia? Akt Neurol 2014; 41(01): 35-39.
- Hacke W, et al: Trombolisis con alteplasa entre 3 y 4,5 horas después de un ictus isquémico agudo. N Engl J Med. 2008; 359(13): 1317-29.
- Emberson J, et al: Efecto del retraso del tratamiento, la edad y la gravedad del ictus en los efectos de la trombólisis intravenosa con alteplasa para el ictus isquémico agudo: un metaanálisis de los datos de pacientes individuales de ensayos aleatorizados. Lancet 2014; 384(9958): 1929-35.
- Sardar P, et al: Terapia endovascular para el ictus isquémico agudo: revisión sistemática y metaanálisis de ensayos aleatorizados. Eur Heart J. 2015; 36(35): 2373-80.
- Goyal M, et al: Trombectomía endovascular tras un ictus isquémico de gran vaso: un metaanálisis de los datos de pacientes individuales de cinco ensayos aleatorizados. Lancet. 2016; 387(10029): 1723-31.
- Colaboración de Trialistas de la Unidad de Ictus. Atención hospitalaria organizada (unidad de ictus) para el ictus. Cochrane Database Syst Rev. 2007.
- Cereda C, et al: Los efectos beneficiosos de una unidad de ictus semiintensiva van más allá del monitor. Cerebrovasc Dis 2015; 39: 102-109.
InFo NEUROLOGÍA Y PSIQUIATRÍA 2017; 15(1): 8-11