Con la introducción del inhibidor de la Janus quinasa (JAK) ruxolitinib, la terapia de la mielofibrosis ha cambiado drásticamente en los últimos años. No obstante, es necesario seguir innovando, especialmente en la segunda línea. En la última Reunión Anual de la ASH, celebrada en diciembre de 2020, se presentaron datos prometedores sobre nuevas opciones de tratamiento.
Además del trasplante de células madre, hace tiempo que se carece de herramientas terapéuticas eficaces para la mielofibrosis. Aunque en los últimos años se han dado pasos importantes en la lucha contra la enfermedad gracias al desarrollo de inhibidores de la JAK, aún no se vislumbra una cura. Quizá ahora, mediante el uso de agentes nuevos e innovadores, al menos el control de los síntomas a más largo plazo esté al alcance de la mano.
Estado de la técnica
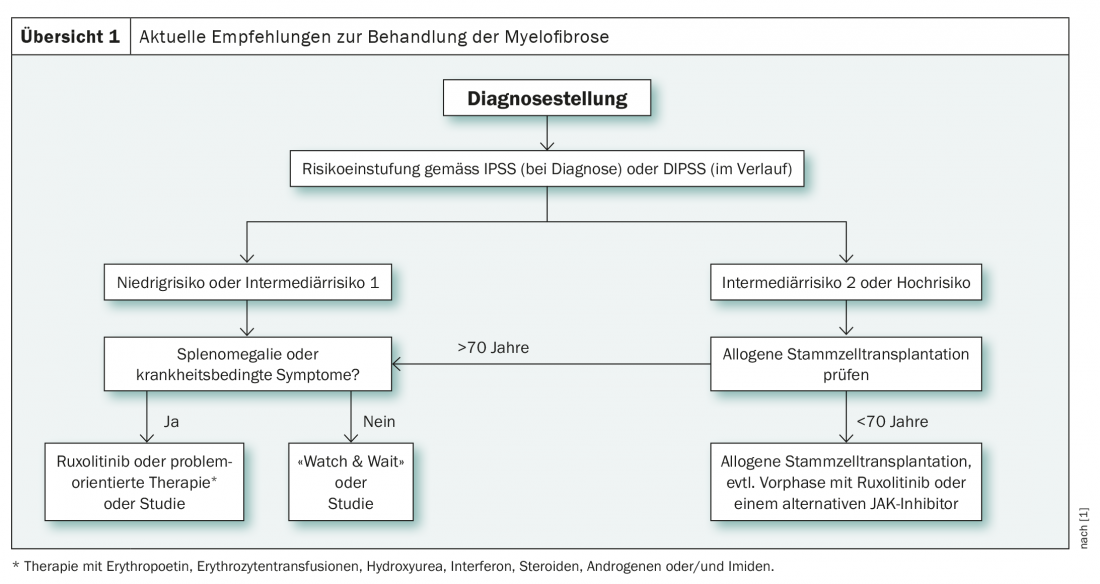
El factor decisivo para la elección de la terapia en la mielofibrosis diagnosticada es la estratificación del riesgo, que se realiza en el momento del diagnóstico según el IPSS(Sistema Internacional de Puntuación Pronóstica ) y en el curso posterior mediante el DIPPS (Sistema Internacional Dinámico de Puntuación Pronóstica ) en cuatro grupos (riesgo bajo, intermedio-1, intermedio-2 y riesgo alto). Se trata de sistemas de puntuación clínica, que pueden complementarse con otros métodos de clasificación según sea necesario. Por ejemplo, el GIPSS (Sistema de Puntuación Pronóstica Inspirado Genéticamente) también tiene en cuenta factores genéticos citogenéticos y moleculares. Éstos pueden facilitar la decisión a favor o en contra del trasplante de células madre en casos poco claros y, por tanto, son especialmente útiles en el grupo de riesgo intermedio-1 [1]. Según las nuevas directrices internacionales, se recomienda el trasplante de células madre para este grupo de personas menores de 65 años si se cumplen ciertos criterios. Entre ellas se incluyen la anemia refractaria relacionada con las transfusiones, los blastos circulantes >2% y una genética citológica o molecular desfavorable [2].
A diferencia del grupo de riesgo intermedio-1, la recomendación del trasplante alogénico de células madre es clara en el grupo intermedio-2 y en el de alto riesgo en los menores de 70 años (resumen 1) . Desde 2017, también se utiliza cada vez más el inhibidor de la tirosina quinasa ruxolitinib. Se utiliza sobre todo en la fase preliminar del trasplante de células madre y en el tratamiento de enfermos de riesgo bajo a intermedio, especialmente en presencia de síntomas relacionados con la enfermedad o de esplenomegalia. Como alternativa a la terapia con ruxolitinib, los pacientes sintomáticos de riesgo bajo e intermedio también pueden recibir un tratamiento orientado al problema. Este enfoque incluye el uso de eritropoyetina, transfusiones de glóbulos rojos, hidroxiurea y esteroides [1].
Así pues, el ruxolitinib, pero también otros inhibidores de JAK, están en auge tanto en el entorno de bajo como de alto riesgo. Por un lado, estos fármacos sirven para controlar los síntomas y, por otro, según los estudios actuales, son capaces de apoyar el trasplante de células madre. Casi diez años después de los datos del primer estudio sobre el ruxolitinib, se ha demostrado que el inhibidor de JAK tiene efectos sostenidos sobre la esplenomegalia y los síntomas de la mielofibrosis relacionados con la enfermedad, con mejoras a largo plazo en la calidad de vida [3,4]. En la Reunión Anual de la ASH de 2020 también se debatió el posible aumento del tiempo de supervivencia del fármaco, para el que cada vez hay más datos prometedores, aunque hasta ahora sólo retrospectivos [5]. Sin embargo, la progresión, especialmente hacia la leucemia mieloide aguda, sigue siendo un problema importante [5].
Posibilidades de mejora
A pesar de los importantes avances que ha experimentado la terapia en los últimos años, aún queda mucho por mejorar. Especialmente en caso de fracaso del tratamiento con ruxolitinib y de intolerancia al principio activo, las opciones siguen siendo actualmente muy limitadas. Aunque la resistencia primaria es rara, la respuesta inadecuada y la pérdida de respuesta son más comunes. Por ejemplo, la duración media de la acción del ruxolitinib sobre la esplenomegalia es de poco más de tres años, lo que a menudo limita su uso en el tiempo y plantea la cuestión de las opciones terapéuticas complementarias [3,4]. Esta necesidad médica también se refleja en las tasas de interrupción del tratamiento con ruxolitinib analizadas en un estudio publicado recientemente, que son del 50 al 60% al cabo de tres años [6]. La mediana de supervivencia tras la interrupción del fármaco es de sólo 14 meses y se reduce aún más en presencia de aberraciones clonales o recuentos bajos de plaquetas [7].
Además, su efecto sobre la anemia, la leucopenia y la trombocitopenia suele ser insuficiente. Se necesitan urgentemente estrategias terapéuticas alternativas para abordar adecuadamente las citopenias que se producen en la mielofibrosis. Después de todo, casi el 40% de los pacientes tienen niveles de hemoglobina inferiores a 10 g/dL en el momento del diagnóstico y el 20% ya dependen de las transfusiones en ese momento [8].
Los efectos positivos del ruxolitinib tampoco pueden ocultar una clara deficiencia: Las remisiones verdaderas con la terapia actual son extremadamente raras en el mundo real [9]. Esto puede deberse, entre otras cosas, al mecanismo de acción, ya que la mutación diana JAK2V617F no es la única responsable del desarrollo de la mielofibrosis. Por lo tanto, no se puede esperar la eliminación de la enfermedad con un bloqueo adecuado mediante un inhibidor de JAK.
Una mirada al futuro
Aunque la curación mediante esta clase de sustancias es difícilmente posible desde el punto de vista mecanicista, la esperanza en el tratamiento de la mielofibrosis sigue residiendo principalmente en el desarrollo de nuevos inhibidores de JAK. Por ejemplo, en la Reunión Anual de la ASH de 2020 se presentaron datos sobre tres nuevas sustancias dirigidas contra la JAK (resumen 2) . Con ellos se pretende complementar la terapia con ruxolitinib en el futuro. El fedratinib ya está aprobado en EE.UU. y Canadá para la terapia de primera línea, y actualmente se están realizando ensayos de fase III para el uso de momelotinib y pacritinib.

Los resultados del estudio JAKARTA-2 [10] muestran que el fedratinib también es prometedor en el tratamiento de segunda línea. Aquí, el fármaco demostró una gran eficacia sobre la esplenomegalia y los síntomas relacionados con la enfermedad en todos los subgrupos pretratados con ruxolitinib. La tasa de respuesta fue del 55,4%. Por tanto, el fedratinib podría utilizarse pronto en casos de resistencia e intolerancia al ruxolitinib, especialmente si los resultados de JAKARTA-2 se confirman en el ensayo aleatorizado y controlado FREEDOM-2, actualmente en curso, un requisito previo para su aprobación en Suiza y Europa.
Con el desarrollo de nuevas opciones terapéuticas, también se plantean diversas cuestiones. Por ejemplo, es necesario evaluar el momento óptimo para cambiar a un inhibidor de JAK alternativo. Hasta ahora, la regla ha sido que la terapia con ruxolitinib debe ser eliminada gradualmente antes del cambio para evitar un rebote. Hoy en día, se esperan tres meses completos para obtener una respuesta antes de considerar que el tratamiento ha fracasado. El creciente número de opciones también dificulta la elección de la terapia. Es probable que en el futuro las preferencias individuales, por ejemplo en cuanto a la frecuencia de uso, así como el espectro respectivo de efectos secundarios, puedan desempeñar un papel más importante.
Fuente: 62ª Reunión Anual de la Sociedad Americana de Hematología (ASH Annual Meeting), 5-8 de diciembre de 2020, conducta virtual.
Literatura:
- Griesshammer M, et al.: Directrices de la Onkopedia: Mielofibrosis primaria (PMF). www.onkopedia.com/de/onkopedia/guidelines/primaere-myelofibrose-pmf/@@guideline/html/index.html (fecha de acceso: 03.01.2021)
- Barbui T, et al: Neoplasias mieloproliferativas clásicas con cromosoma Filadelfia negativo: recomendaciones de gestión revisadas de European LeukemiaNet. Leucemia 2018; 32(5): 1057-1069.
- Verstovsek S, et al: Tratamiento a largo plazo con ruxolitinib para pacientes con mielofibrosis: actualización a 5 años del ensayo aleatorizado, doble ciego, controlado con placebo, fase 3 COMFORT-I. J Hematol Oncol 2017; 10(1): 55.
- Harrison CN, et al: Hallazgos a largo plazo de COMFORT-II, un estudio de fase 3 de ruxolitinib frente a la mejor terapia disponible para la mielofibrosis. Leucemia 2016; 30(8): 1701-1707.
- Al-Ali HK, et al: Primary analysis of JUMP, a phase 3b, expanded-access study evaluating the safety and efficacy of ruxolitinib in patients with myelofibrosis, including those with low platelet counts. Br J Haematol 2020; 189(5): 888-903.
- Harrison CN, Schaap N, Mesa RA: Manejo de la mielofibrosis tras el fracaso del ruxolitinib. Ann Hematol 2020; 99(6): 1177-1191.
- Newberry KJ, et al: Evolución clonal y resultados en la mielofibrosis tras la interrupción del ruxolitinib. Sangre 2017; 130(9): 1125-1131.
- Naymagon L, Mascarenhas J.: Anemia relacionada con la mielofibrosis: estrategias terapéuticas actuales y emergentes. Hemasphere 2017; 1(1): e1.
- Gill H, et al: Neoplasias mieloproliferativas tratadas con hidroxiurea, interferón pegilado alfa-2A o ruxolitinib: respuestas clínico-hematológicas, cambios en la calidad de vida y seguridad en el entorno del mundo real. Hematología 2020; 25(1): 247-257.
- Harrison CN, et al: Inhibidor de la Janus quinasa-2 fedratinib en pacientes con mielofibrosis tratados previamente con ruxolitinib (JAKARTA-2): un estudio de un solo brazo, abierto, no aleatorizado, de fase 2 y multicéntrico. Lancet Haematol 2017; 4(7): e317-e24.
InFo ONCOLOGY & HEMATOLOGY 2021; 9(1): 32-33 (publicado el 24.2.21; antes de impresión).