¿Qué fármacos son adecuados para la radioquimioterapia neoadyuvante? Si hay una respuesta clínica completa, ¿debemos esperar u operar? ¿Y qué pacientes se benefician del tratamiento adyuvante? Estas fueron algunas de las cuestiones que se debatieron en el GICC de la EORTC celebrado en San Gall a principios de marzo.
(rs) “En hasta un 30% de las personas con cáncer rectal distal avanzado, la radioquimioterapia preoperatoria (neoadyuvante) puede lograr una respuesta patológica completa (pCR) y clínica (cCR), evitando potencialmente la cirugía radical”, afirmó la Prof. Angelita Habr-Gama, MD, Sao Paulo, en el GICC de la EORTC en St Gallen. Con el objetivo de estandarizar el procedimiento en el diagnóstico de tumores, el Prof. Habr-Gama y sus colegas definieron criterios clínicos y endoscópicos para la respuesta clínica y, basándose en ellos, el procedimiento ulterior [1]. Además del procedimiento estandarizado, el momento de la evaluación del tumor también desempeña un papel importante. “Diversos estudios demuestran que la evaluación debe tener lugar como muy pronto siete u ocho semanas después del final de la ECA neoadyuvante”, afirmó el profesor Habr-Gama. Hizo referencia a un estudio de Kalady et al. que demostró que un intervalo de tiempo de más de ocho semanas entre el final de la RCT neoadyuvante y la cirugía se asociaba a una pCR significativamente mayor [2]. La supervivencia global (SG) o libre de enfermedad (SLE) no se vio afectada por el retraso en la evaluación del tumor en los estudios.
¿”Vigilar y esperar” u operar inmediatamente?
El prerrequisito para el protocolo “Vigilar y esperar” presentado por el Prof. Habr-Gama y utilizado desde 1991 es una respuesta clínica completa tras un ECA neoadyuvante (Fig. 1 ).
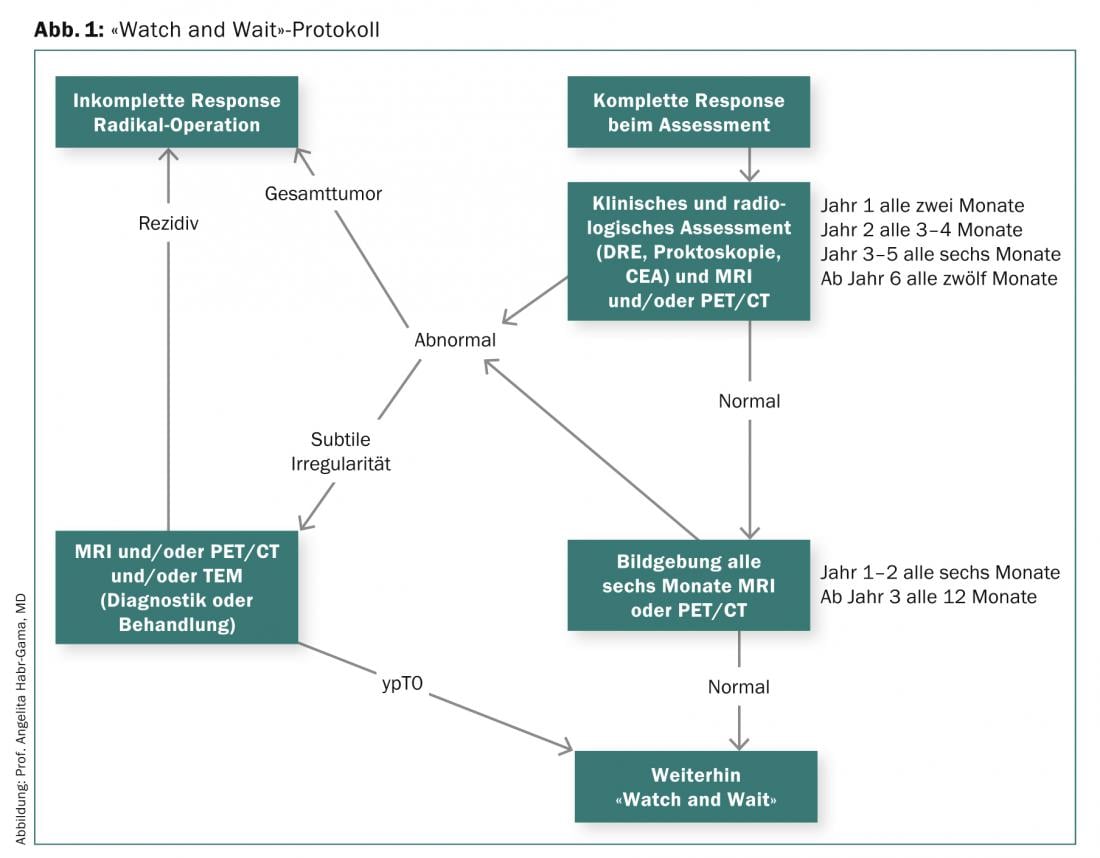
Como muestran los resultados a largo plazo de un estudio de 265 pacientes con cáncer rectal distal que se sometieron a cirugía radical (respuesta incompleta) o a seguimiento (RCR) tras un RCT neoadyuvante, la tasa de supervivencia global y libre de enfermedad fue del 84 frente al 97,7%. Después de cinco años, la tasa de supervivencia global fue de 88 en el grupo de resección y de 100 en el grupo de observación, y la tasa de supervivencia libre de enfermedad fue del 83 y del 92%. Para aumentar el número de pacientes en las que puede evitarse la cirugía radical, el Prof. Habr-Gama y sus colegas investigaron el impacto de un ECA neoadyuvante prolongado con una dosis de radiación más alta, ciclos de quimioterapia más frecuentes y un intervalo más largo hasta la evaluación del tumor [3]. El régimen terapéutico investigado condujo inicialmente a la RCC en el 68% de los pacientes. En los primeros doce meses, 17 y en el transcurso (>12 meses) otro 10% desarrollaron una recidiva local. La mitad de los 70 pacientes incluidos no requirieron cirugía a largo plazo (seguimiento medio de 56 meses).
Socios óptimos para el ECA neoadyuvante
La respuesta a la pregunta de qué quimioterapia es la más adecuada para combinar con la radioterapia en el tratamiento adyuvante del cáncer rectal localmente avanzado se complica por la diferente administración de las fluoropiramidinas. “Sabemos por estudios postoperatorios que el 5-FU más radioterapia es un tratamiento activo y que la administración i.v. continua durante la radioterapia es superior a las inyecciones en bolo”, afirmó el Dr. Hans-Joachim Schmoll, de la Universidad alemana de Halle. El Prof. Schmoll respondió a la pregunta de si el profármaco oral 5-FU capecitabina es preferible a la forma i.v. de 5-FU en el tratamiento perioperatorio basándose en una publicación de Hofheinz y colegas. Esto demostró una ventaja de supervivencia significativa para la capecitabina después de cinco años (76 frente a 67% p=0,0004) [4]. Los resultados del ensayo NSABP-R-04 publicado en ASCO 2013, que investigó el tratamiento con capecitabina más radioterapia (RT) en dos de los cuatro brazos y un ECA con infusión continua de dosis bajas de 5-FU, mostraron un resultado comparable [5]. “Los resultados del estudio muestran un tratamiento comparativamente eficaz”, afirmó el Prof. Schmoll. “Sin embargo, debido a su mayor facilidad de administración, debería preferirse la capecitabina al 5-FU”.
La cuestión de la RCT basada en fluoropiramidina más oxaliplatino para la RCT neoadyuvante en el cáncer de colon localmente avanzado se investigó mediante cinco ensayos: STAR, ACCORD/Prodige2, NSABP R-04, ARO/CAO/AIO 04, PETACC-6. Sólo el ensayo ARO/CAO/AIO-04 mostró una pCR significativamente mayor (17 frente a 13%, p=0,038) [6]. Todos los demás estudios fueron negativos a este respecto. Sin embargo, como demostró el mencionado ensayo NSABP-R-04, que investigó un ECA neoadyuvante con fluoropirimidinas más oxaliplatino en los dos brazos restantes, la toxicidad aumentó significativamente con la combinación.
En ensayos más pequeños se investigó un ECA neoadyuvante con capecitabina e irinotecán. Estos mostraron tasas de pCR entre el 9 y el 27% y una alta tasa de resección R0. La combinación con el inhibidor del VEGF bevacizumab parecía inicialmente prometedora. “Los resultados de los estudios de fase I y II con tasas de pCR de entre el 16 y el 36% no sugieren que la combinación con bevacizumab contribuya significativamente a mejorar los resultados”, afirmó el profesor Schmoll. Lo mismo ocurre con el inhibidor del EGFR cetuximab.
Quimioterapia adyuvante
La cuestión de la quimioterapia postoperatoria (adyuvante) en el tratamiento del cáncer de recto estaba mucho menos clara. Aunque existe un consenso generalizado en que la quimioterapia adyuvante es beneficiosa en pacientes de alto riesgo. Sin embargo, esta conclusión indirecta se extrae de estudios más antiguos con pacientes que en su mayoría no habían recibido terapia neoadyuvante. Por el contrario, se sabe por los ensayos de la EORTC que las pacientes que habían respondido bien a la terapia neoadyuvante son las que más se benefician de la TC adyuvante [7]. Para el tratamiento adyuvante, se recomienda una terapia de seis meses con 5-FU o capecitabina. Los resultados iniciales de los ensayos PETACC-6 y ARO/CAO/AIO-04 proporcionarán información sobre la combinación con oxaliplatino en el TC adyuvante. Se espera que se presenten en ASCO 2014.
Fuente: “Issues in combined modality treatment for rectal cancer”,2ª Conferencia sobre el cáncer gastrointestinal (GICC) 2014 de la EORTC (Organización Europea para la Investigación y el Tratamiento del Cáncer), 7 de marzo de 2014, St.
Literatura:
- Habr-Gama A, et al.: Respuesta clínica completa tras la quimiorradioterapia neoadyuvante para el cáncer rectal distal: caracterización de los hallazgos clínicos y endoscópicos para su estandarización. Dis Colon Rectum 2010; 53(12): 1692-1698.
- Kalady MF, et al: Factores predictivos de la respuesta patológica completa tras la quimiorradiación neoadyuvante para el cáncer de recto. Ann Surg 2009; 250(4): 582-589.
- Habr-Gama, et al: Enfoque de observación y espera tras la quimiorradiación neoadyuvante ampliada para el cáncer rectal distal: ¿nos acercamos al tratamiento del cáncer anal? Dis Colon Rectum 2013; 56(10): 1109-1117.
- Hofheinz RD, et al: Quimiorradioterapia con capecitabina frente a fluorouracilo para el cáncer rectal localmente avanzado: un ensayo aleatorizado, multicéntrico, de no inferioridad, de fase 3. Lancet Oncol 2012; 13(6): 579-588.
- Roh MS, et al: El impacto de la capecitabina y el oxaliplatino en el tratamiento multimodal preoperatorio en pacientes con carcinoma de recto: NSABP R-04. J Clin Oncol 29: 2011 (suppl; abstr 3503).
- Rödel C, et al: Quimiorradioterapia preoperatoria y quimioterapia postoperatoria con fluorouracilo y oxaliplatino frente a fluorouracilo solo en cáncer rectal localmente avanzado: resultados iniciales del ensayo aleatorizado de fase 3 alemán CAO/ARO/AIO-04. Lancet Oncol 2012; 13(7): 679-687.
- Collette L, et al: Pacientes con resección curativa de cáncer de recto cT3-4 tras radioterapia preoperatoria o radioquimioterapia: ¿alguien se beneficia de la quimioterapia adyuvante a base de fluorouracilo? Un ensayo del Grupo de Oncología Radioterápica de la Organización Europea para la Investigación y el Tratamiento del Cáncer. J Clin Oncol 2007; 25(28): 4379-4386.
InFo ONCOLOGÍA Y HEMATOLOGÍA 2014; 2(4): 25-27











