La aparición de dolor como consecuencia de un ictus supone un reto para la medicina del dolor. Aunque el conocimiento de los mecanismos fisiopatológicos del dolor neuropático tras un ictus ha aumentado considerablemente en los últimos años, el éxito de los enfoques terapéuticos farmacológicos, neuroquirúrgicos, intervencionistas y de otro tipo sigue siendo limitado. Por lo tanto, es obligatorio un enfoque terapéutico multimodal. Este artículo pretende ofrecer una visión general de los aspectos diagnósticos y terapéuticos de esta entidad patológica.
El dolor crónico de moderado a intenso es un problema de salud común en Suiza, con una prevalencia del 16%, aunque hay que señalar que pocos pacientes son tratados por especialistas en dolor y que aproximadamente la mitad de los pacientes reciben un tratamiento inadecuado del dolor [1]. La presencia de dolor neuropático puro también es frecuente, con una prevalencia que oscila entre el 3,3% en una encuesta realizada en la población general de Austria [2] y el 7% en la población general de Francia [3].
La incidencia del ictus en Europa es de 1,1 millones al año, con un aumento previsto de aproximadamente 1,5 millones al año para 2025, debido al incremento de la proporción de personas mayores en la población [4]. El dolor crónico asociado al ictus se observa en el 11-55% de todos los pacientes con ictus [5]. Los tipos comunes de dolor que aparecen tras un ictus pueden incluir dolor neuropático central, dolor nociceptivo en el hombro, espasticidad dolorosa y también cefaleas tensionales. El dolor neuropático central se da en el 8% de todos los pacientes que han sufrido un ictus [6]. El dolor nociceptivo de hombro se registra entre un 30 y un 40% en pacientes con ictus con déficits sensoriales y motores, subluxaciones de hombro y restricciones de movimiento [7]. El dolor musculoesquelético también puede aparecer en la espalda y las extremidades inferiores, especialmente en las rodillas y las caderas [8] (Tab. 1).

Dolor central tras un ictus
La definición de dolor neuropático según la Asociación Internacional para el Estudio del Dolor (IASP) presupone una lesión o enfermedad que afecta al sistema somatosensorial [9]. Para diagnosticar el dolor neuropático, deben utilizarse los criterios diagnósticos de la IASP para buscar una historia de dolor que corresponda a una distribución neuroanatómicamente circunscrita y pruebas de una lesión o enfermedad relevante del sistema nervioso periférico o central. El examen clínico debe demostrar signos sensoriales positivos y negativos correspondientes a una distribución circunscrita neuroanatómicamente plausible y coherente con la zona dolorosa. Además, el diagnóstico por aparatos debe demostrar la presencia de una lesión o enfermedad del sistema somatosensorial [9].
En la literatura anglosajona, el dolor neuropático central tras un ictus se denomina “dolor central posterior al ictus” (CPSP, por sus siglas en inglés). Dado que no existen signos patognomónicos para la CPSP, el estudio de Klit et al. siguiendo los mencionados criterios diagnósticos de la IASP, sólo recientemente ha propuesto criterios diagnósticos específicos para el CPSP [10]. En consecuencia, los criterios necesarios para el diagnóstico del CPSP son el dolor en una región del cuerpo correspondiente a una lesión del sistema nervioso central. El historial debe indicar que el paciente ha sufrido un ictus y la aparición del dolor debe haber ocurrido después del ictus. Además, se requiere la confirmación de una lesión del sistema nervioso central mediante estudios de imagen (por ejemplo, tomografía computarizada o resonancia magnética del cráneo) o debe demostrarse la presencia de signos sensoriales negativos o positivos, compatibles con una región corporal, correspondientes a una lesión del sistema nervioso central.
Al tratarse de un diagnóstico clínico de exclusión, deben excluirse o ser poco probables otras causas de dolor como el dolor nociceptivo o neuropático periférico. El diagnóstico puede sustentarse en criterios de apoyo como la ausencia de una relación primaria del dolor con el movimiento (por ejemplo, de las extremidades), la ausencia de signos de inflamación local o de signos de patología tisular local distinta de una causa nociceptiva del dolor. Una descripción típica del dolor puede incluir ardor, hormigueo, presión, pinchazos, punzadas agudas, pinchazos, constricción, dolor frío, dolor electrizante, aunque también se observan otras descripciones. La presencia de alodinia o disestesia al tacto o al frío en la zona dolorida puede proporcionar indicios adicionales (tab. 2).

Características clínicas del CPSP neuropático
La revisión de Klit [10] resume las características clínicas típicas del CPSP. La distribución de la zona dolorida puede afectar sólo a un área pequeña, por ejemplo sólo la mano, o también a zonas extensas del cuerpo, hasta el dolor de medio lado. La cara y el tronco también pueden quedar al margen. Los pacientes con un denominado infarto lateral del bulbo raquídeo y el consiguiente síndrome de Wallenberg también pueden presentar dolor facial en el lado afectado y dolor en el tronco y las extremidades del lado opuesto (síndrome cruzado). También se informa con frecuencia de dolor periorbitario. La hemiplejía se produce a menudo tras una lesión talámica. Los fenómenos sensoriales negativos y positivos también son típicos en la CPSP como en otros síndromes neuropáticos. Las alteraciones térmicas, especialmente de la sensación de frío o también las alteraciones de la sensación de dolor o las alteraciones de la percepción de pinchazos o picos se producen en más del 90% de los casos. Los síntomas negativos relacionados con el tacto o las vibraciones se dan con menos frecuencia. Son frecuentes los fenómenos positivos como el dolor evocado por estímulos térmicos (especialmente el frío) o mecánicos (pinchazos), pero también la alodinia a los estímulos táctiles.
El dolor central tras un ictus no sólo se produce típicamente tras una lesión talámica (“dolor talámico”), sino que también se registra tras una hemorragia e isquemia en otras zonas del cerebro [11]. Datos propios muestran la aparición de dolor central tras un ictus en pacientes con infartos de tronco encefálico, lesiones medulares y lesiones del córtex insular. Se encontraron causas muy diferentes para la génesis del ictus, como infarto cerebral microvascular o embólico, infarto cerebral tras vasoespasmo debido a hemorragia subaracnoidea o hemorragia intracerebral [12].
El tiempo transcurrido entre el inicio del ictus y la aparición del CPSP puede ser variable (aparición inmediata o aparición del dolor al cabo de años), pero la aparición del dolor en unos pocos meses es lo más típico [13]. En un estudio prospectivo de 16 pacientes [6], la CPSP se produjo en diez pacientes en el primer mes, en otros tres pacientes entre uno y seis meses y en tres pacientes después de seis meses. Por lo tanto, una aparición tardía del CPSP debe impulsar el diagnóstico diferencial de otras causas de dolor o incluso la aparición de un nuevo ictus.
Papel del diagnóstico instrumental
Según los criterios diagnósticos de la IASP mencionados al principio, debe realizarse un diagnóstico por imagen del cerebro, significativamente una resonancia magnética para mostrar las estructuras cerebrales. Si se detecta una lesión correspondiente al dolor, no es necesario ningún diagnóstico posterior. En casos aislados, una lesión muy pequeña puede no ser detectable en las imágenes. Si el cuadro clínico es típico (historia de un derrame cerebral y evidencia de los correspondientes fenómenos negativos y/o positivos), se puede hacer un diagnóstico de CPSP. Además, se puede intentar obtener pruebas neurofisiológicas de una lesión. Los potenciales evocados por somatosensor [14] y los evocados por láser [15], pero también las pruebas sensoriales cuantitativas [16] pueden ayudar a detectar una lesión. Nuestros propios datos muestran hallazgos patológicos en el examen de los potenciales evocados por láser y las pruebas sensoriales cuantitativas en la mayoría de los casos de pacientes con dolor neuropático central tras un ictus de distinta génesis [12].
Mecanismos de desarrollo del dolor neuropático tras un ictus
La reciente revisión de Klit et al. [10] ofrece una buena visión general de los posibles mecanismos del dolor central tras un ictus. La hiperexcitabilidad neuronal a nivel cerebral desempeña un papel importante en la fisiopatología del dolor neuropático generado centralmente. Los factores que pueden promover la hiperexcitabilidad neuronal incluyen la activación glial con liberación de quimiocinas y sustancias inflamatorias, el debilitamiento de los sistemas inhibitorios GABA-érgicos del tálamo, el desequilibrio entre los tractos espinotalámicos lateral y medial debido a una lesión en ellos, o la deafferenciación de la entrada sensorial. Las consecuencias de estos mecanismos pueden ser la detección de actividad espontánea en el núcleo ventrocaudal del tálamo o también un cambio del flujo sanguíneo cerebral en el tálamo. Se discuten mecanismos adicionales como una alteración de los bucles de excitación córtico-talamo-corticales o la reorganización cortical y también otros mecanismos.
Enfoques terapéuticos para la CPSP
El dolor crónico tras un ictus puede conducir a una reducción de la calidad de vida que afecta al estado de ánimo, el sueño y el funcionamiento social [17]. En general, la denominada terapia multimodal del dolor con procedimientos somáticos, físicos y psicoterapéuticos es superior a una terapia monodisciplinar para los síndromes de dolor crónico. En este sentido, además de las diversas causas posibles de dolor descritas anteriormente, el tratamiento del dolor tras un ictus debe ser siempre interdisciplinar y multimodal. Especialmente en pacientes con dolor neuropático tras un ictus, los tratamientos psicológicos como las estrategias de afrontamiento y las terapias conductuales pueden conducir a una mejora del dolor [17].
En cuanto al dolor nociceptivo, son útiles principalmente las medidas ortopédicas (por ejemplo, la terapia de las patologías del hombro), fisioterapéuticas (por ejemplo, el tratamiento de los factores de dolor muscular) y de terapia ocupacional en función de la patología musculoesquelética. Además, puede ser necesario el tratamiento de la espasticidad dolorosa con baclofeno oral. En casos especiales, puede ser útil la aplicación de una bomba de espasticidad intratecal.
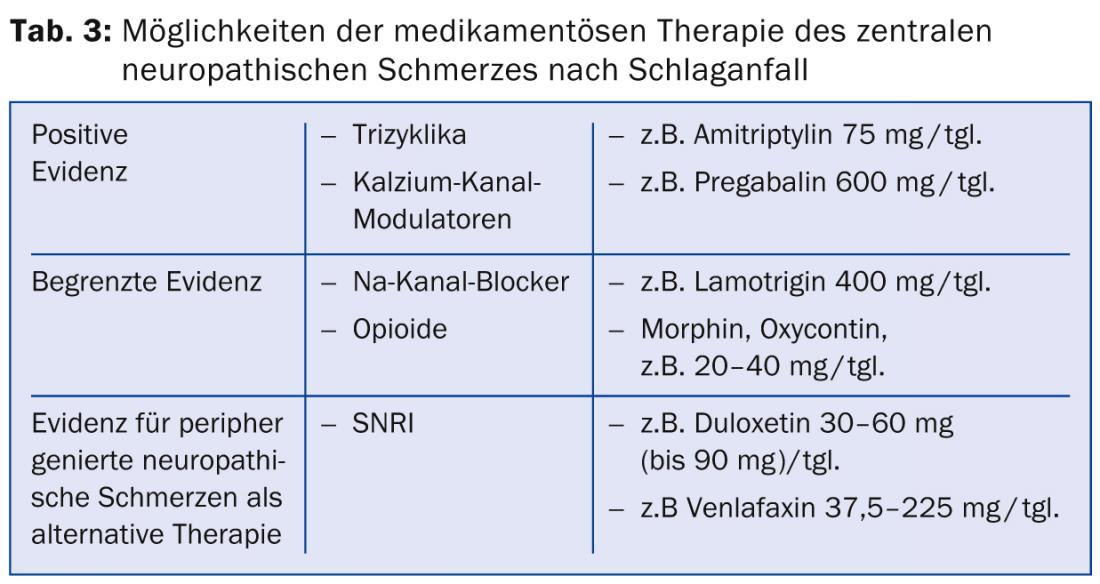
Enfoques terapéuticos farmacológicos: Los enfoques de la farmacoterapia para el dolor neuropático tras un ictus se evalúan en directrices internacionales como la directriz del Grupo de Trabajo sobre Dolor Neuropático de la Sociedad Internacional del Dolor (NeuPSIG) [18] y la directriz de la Federación Europea de Sociedades Neurológicas (EFNS) [19]. Las opciones de tratamiento farmacológico disponibles son limitadas. Es posible que la multitud de mecanismos fisiopatológicos mencionados anteriormente a diferentes niveles neuronales sea la razón de la a menudo escasa respuesta a los fármacos disponibles para el tratamiento del dolor neuropático tras un ictus. Para un gran número de los mecanismos mencionados, aún no se dispone de ninguna terapia.
Existen pocos ensayos controlados aleatorios para el tratamiento del dolor neuropático central tras un ictus. Los tricíclicos y los moduladores de los canales de calcio se consideran los fármacos de primera elección. Se dispone de datos de estudios positivos para la amitriptilina en la dosis de 75 mg [20]. El “número necesario a tratar” (NNT), es decir, el número de pacientes que hay que tratar para conseguir una reducción del dolor del 50%, se dio aquí como 1,7. Se han observado efectos secundarios moderados como fatiga y sequedad de boca.
En cuanto a los anticonvulsivos del grupo de los moduladores de los canales de calcio, un estudio en pacientes con dolor neuropático central mostró una eficacia significativa de la pregabalina con un NNT de 4,0 [21]. Los efectos secundarios incluyeron mareos, deterioro cognitivo, fatiga y náuseas. Además, el fármaco antiepiléptico lamotrigina, del grupo de los bloqueantes de los canales de sodio, mostró una eficacia moderada con una buena tolerabilidad en un estudio sobre el dolor central tras un ictus [22]. En otros trastornos de dolor neuropático, la eficacia de la lamotrigina no está clara, por lo que en general se considera que su eficacia no está clara [23]. Un estudio con carbamazepina a una dosis de 800 mg/tgl. no mostraron eficacia en el dolor neuropático tras el ictus.
En un estudio sobre dolor neuropático de diversas etiologías, los opiáceos orales mostraron una reducción media del dolor del 23%, aunque el número de pacientes con dolor neuropático tras un ictus fue bajo, diez de 81, y siete de ellos abandonaron el estudio debido a los efectos secundarios [24]. Los estudios con administración intravenosa de morfina, lidocaína y propofol mostraron una mejoría del dolor posterior al infarto durante la infusión. Las terapias orales de mantenimiento posteriores con morfina y mexiletina fueron mal toleradas debido a los efectos secundarios [25–27].
Si no se puede lograr una reducción suficiente del dolor con los fármacos mencionados, se recomienda recurrir a los fármacos de primera y segunda elección para la terapia del dolor neuropático generado periféricamente [18]. Entre ellos se incluyen, como fármacos de primera línea, los inhibidores selectivos de la recaptación de serotonina y noradrenalina (IRSN) como la duloxetina y la venlafaxina, y como fármacos de segunda línea, los opiáceos muy potentes como el MST, el oxycontin y otros opiáceos (tab. 3).
Enfoques terapéuticos neuroquirúrgicos e intervencionistas: Como se ha demostrado, las opciones de tratamiento farmacológico para el dolor neuropático tras un ictus son limitadas y, por tanto, a menudo insatisfactorias. Según Dworkin et al. [23], los métodos invasivos pueden intentarse tras agotar los métodos terapéuticos conservadores individuales o combinados. La situación actual de los datos relativos a los enfoques terapéuticos neuroquirúrgicos e intervencionistas se recopila en revisiones recientes [10,28,29]. Dado que las pruebas de estos procedimientos son limitadas, deben reservarse a los centros de tratamiento experimentados.
La estimulación magnética transcraneal repetitiva (EMTr) es un procedimiento neuromodulador no invasivo. En este caso, el efecto es moderado y dura poco tiempo, aunque casi nunca se producen efectos secundarios graves. Los tratamientos repetidos de la corteza motora con EMTr pueden mostrar una mejora significativa del dolor [30,31]. Además, esta terapia puede utilizarse como predictor de la respuesta a la estimulación epidural de la corteza motora [32].
La eficacia de la estimulación epidural de la corteza motora para el dolor central tras un ictus mostró una reducción del dolor de alrededor del 45-50% al cabo de un año [28,33]. Rara vez se registran complicaciones graves. Perioperatoriamente, pueden producirse ataques epilépticos, infecciones, además de problemas técnicos.
La estimulación cerebral profunda (ECP) puede considerarse otra terapia invasiva. Aquí se estimula el tálamo sensorial (nervio ventral posterior) o el gris periventricular. Según los informes, la eficacia oscila entre el 25 y el 67% [34,35]. En general, la eficacia no puede cuantificarse con claridad, por lo que aquí se requieren más estudios [28].
Una nueva modalidad de tratamiento para pacientes con dolor neuropático, incluido el dolor neuropático central tras un ictus, son los ultrasonidos focalizados de alta intensidad (HIFUS), que se aplican de forma transcraneal, no invasiva, para ablacionar térmicamente una zona circunscrita del tálamo centrolateral, lo que puede producir un alivio del dolor [36].
Dr. Gunther Landmann
Dra. Emmanuelle Opsommer
Literatura:
- Breivik H, et al: European Journal of Pain 2006; 10(4): 287-287.
- Gustorff B, et al: Acta Anaesthesiol Scand 2008; 52(1): 132-136.
- Bouhassira D, et al: Dolor 2008; 136(3): 380-387.
- Truelsen T, et al: Eur J Neurol 2006; 13: 581-598.
- Jönsson AC, et al: J Neurol Neurosurg Psychiatry 2006; 77: 590-595.
- Andersen G, et al: Dolor 1995; 61: 187-193.
- Lindgren I, et al: Ictus 2007; 38: 343-348.
- Kuptniratsaikul V, et al: Am J Phys Med Rehabil 2009; 88: 92-99.
- Treede RD, et al: Neurología 2008; 70(18): 1630-1635.
- Klit H, Finnerup NB, Jensen TS: Lancet Neurol 2009; 8(9): 857-868.
- Weimar C, et al: Cerebrovasc Dis 2002; 14: 261-263.
- Landmann G, Stockinger L, Opsommer E: Dolor central post-ictus explorado mediante potenciales evocados por láser y pruebas sensoriales cuantitativas: Un estudio de casos múltiples. 30º Congreso Internacional de Neurofisiología Clínica (ICCN). Berlín, Alemania, 2014.
- Tasker R: Estados centrales del dolor. En: L JD, editor. Bonica’s management of pain Filadelfia: Lipponcott Williams & Wilkins, 2001; 433-445.
- Holmgren H, et al: Pain 1990; 40: 43-52.
- García-Larrea L, et al: Brain 2002; 125: 2766-2781.
- Boivie J: Eur J Pain 2003; 7: 339-343.
- Widar M, et al: J Pain Symptom Manage 2004; 27: 215-225.
- Dworkin RH: Am J Med 2009; 122(10 Suppl): S1-2.
- Attal N, et al: Eur J Neurol 2010; 17(9): 1113-1188.
- Leijon G: Dolor 1989; 36: 27-36.
- Vranken JH, et al: Pain 2008; 136: 150-157.
- Vestergaard K, et al: Neurology 2001; 56: 184-190.
- Dworkin RH, et al: Dolor 2007; 132(3): 237-251.
- Rowbotham MC, et al: N Engl J Med 2003; 348: 1223-1232.
- Attal N, et al: Neurology 2000; 54: 564-574.
- Attal N, et al: Neurology 2002; 58: 554-563.
- Canavero S: Clin Neuropharmacol 2004; 27: 182-186.
- Cruccu G, et al: Eur J Neurol 2007; 14: 952-970.
- Kumar B, et al: Anestesia y analgesia 2009; 108(5): 1645-1657.
- Khedr EM, et al: J Neurol Neurosurg Psychiatry 2005; 76(6): 833-838.
- Leung A, et al: J Pain 2009; 10(12): 1205-1216.
- Andre-Obadia N, et al: Clin Neurophysiol 2006; 117(7): 1536-1544.
- Fontaine D, Hamani C: Revista de neurocirugía 2009; 110: 251-256.
- Katayama Y, et al: Stereotact Funct Neurosurg 2001; 77: 183-186.
- Owen SL, et al: Pain 2006; 120: 202-206.
- Martin E, et al: Ann Neurol 2009; 66(6): 858-861.
PRÁCTICA GP 2014; 9(5): 20-24