Reforzar las defensas del organismo con la ayuda de extractos bacterianos ingeridos por vía oral puede ayudar a combatir las infecciones respiratorias en los seres humanos. En un estudio publicado recientemente, se analizaron los mecanismos de acción subyacentes de este beneficio inmunológico utilizando el coronavirus murino (MCoV) en un modelo de ratón.
Que la ingesta del lisado bacteriano OM-85-BV (Broncho-Vaxom®) en humanos conduce tanto a una frecuencia significativamente menor de infecciones respiratorias recurrentes como a una menor duración global de las infecciones respiratorias ha quedado demostrado en estudios anteriores [1–3]. Para investigar los mecanismos celulares y moleculares implicados, se analizaron los efectos del tratamiento con OM-85-BV sobre el coronavirus murino (MCoV) A59 im. Se demostró que el tratamiento con OM-85-BV provoca una reducción de la carga vírica, una acumulación de macrófagos intersticiales en el tejido pulmonar y una respuesta más rápida asociada de la señalización del interferón de tipo I [4].
Reducción masiva del virus en los días 4 y 10
74 ratones de laboratorio fueron divididos en un grupo de tratamiento y otro de control en una proporción de 1:1. Los animales experimentales en la condición verum recibieron 7,2 mg de OM-85-BV administrados por vía oral (disueltos en 200 μL de D-manitol al 3%) durante un periodo de 10 días [4]. Los ratones en la condición de control recibieron 200 μL de D-manitol al 3%. Se analizaron muestras de tejido a los 2, 4 y 10 días de la infección intranasal por MCoV mediante PCR cuantitativa (qPCR), secuenciación del ARN, histología y citometría de flujo. Para medir la carga viral, se determinaron los dos marcadores virales Nsp12 y PolyU en los pulmones mediante PCR cuantitativa (qPCR). Esto demostró que los ratones con un sistema inmunitario entrenado por el lisado bacteriano mostraron una reducción masiva del virus el día 4, que persistió el día 10.
Acumulación de macrófagos intersticiales específica del pulmón
Los macrófagos son la primera línea de defensa hasta que las células B y T específicas combaten la infección. La población homeostática de macrófagos pulmonares incluye, además de los macrófagos alveolares de origen embrionario, macrófagos intersticiales derivados de monocitos circulantes [5,6]. Los macrófagos alveolares no se alteraron con el tratamiento y se redujeron gradualmente durante la infección, como era de esperar. Sin embargo, se observó un aumento de los macrófagos intersticiales tras el tratamiento con OM-85-BV y antes de la infección viral [4]. En el grupo verum, la acumulación de macrófagos intersticiales en el tejido pulmonar tras la infección por MCoV dio lugar a una respuesta más rápida de la señalización del interferón tipo I. La secuenciación del ARN también mostró que el tejido pulmonar de los animales experimentales que recibieron OM-85-BV el día 4 se asemejaba a un estadio intermedio entre el tejido pulmonar sano y el infectado por el virus, lo que sugiere un retorno más rápido a la homeostasis normal del tejido. En Para determinar si la modulación del sistema inmunitario del pulmón es específica de un órgano, los investigadores analizaron los monocitos y los macrófagos esplénicos antes y durante la infección por MCoV. Independientemente del En el tratamiento con OM-85-BV, no hubo diferencias en la cantidad de monocitos en el torrente sanguíneo ni de macrófagos en el bazo, ni al inicio ni durante la infección por MCoV. Esto indica una acumulación de macrófagos intersticiales específica del pulmón inducida por el pretratamiento con OM-85-BV.
Mejora de la eliminación viral y reducción de la carga apoptótica en los pulmones
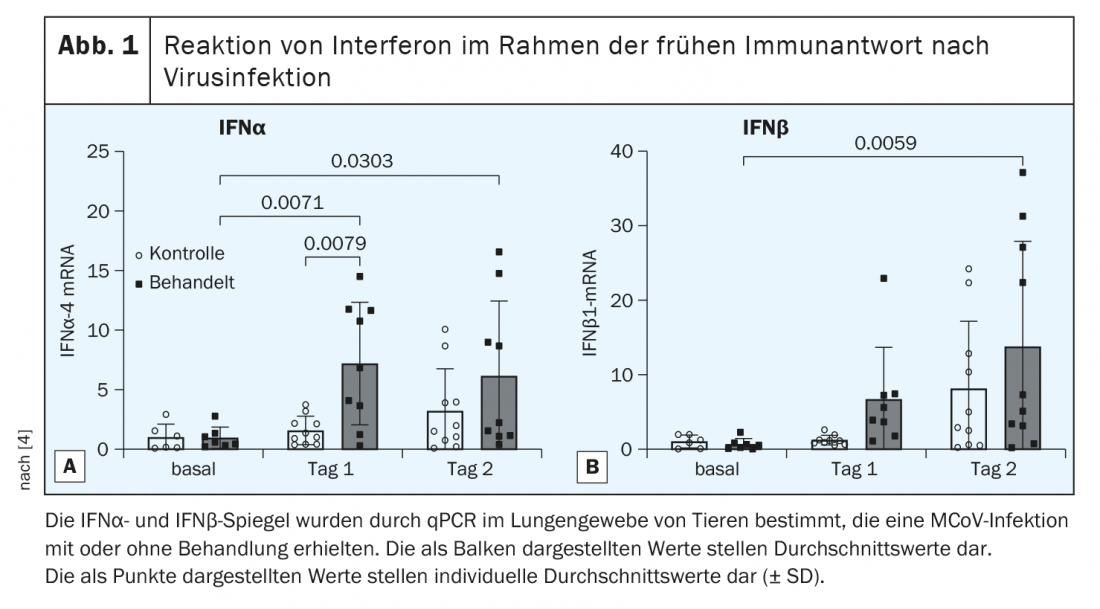
Las infecciones víricas van acompañadas de la apoptosis de las células huésped [7]. Los animales tratados mostraron una carga apoptótica reducida del tejido pulmonar en los días 4 y 10 en comparación con el grupo de control. Además, los datos sugieren que el pretratamiento con OM-85-BV mejoró la respuesta inicial a la infección viral y condujo a una eliminación más rápida del MCoV, probablemente a través de la inducción del interferón de tipo I (IFN). Por lo tanto, se midieron los niveles basales y de activación de la vía del IFN en los días 1 y 2 post-infección. El tratamiento con OM-85-BV no aumentó los niveles basales de IFNα, pero se produjo una fuerte y significativa inducción de IFNα en el día 1 en los animales tratados con OM-85-BV (Fig. 1A) [4]. El IFNβ se indujo significativamente en los animales tratados el día 2 (Fig. 1B) [4]. En general, los resultados indican una fuerte regulación al alza de la respuesta IFN de tipo I Tag 1 tras el tratamiento con OM-85-BV. A nivel celular, la medición citométrica de flujo mostró que en el día 1 en los animales tratados con OM-85-BV, especialmente los macrófagos CD45+CD64+ y los no leucocitos CD45 tenían significativamente más proteína del factor regulador del interferón 1 que los ratones de laboratorio del grupo de control.
Literatura:
- Información sobre medicamentos, www.swissmedicinfo.ch (última consulta: 24.01.2022)
- Yin J, et al: Int Immunopharmacol 2018; 54: 198-209.
- Razi, CH et al: J Allergy Clin Immunol 2010; 126(4):763-769.
- Salzmann M, et al: Journal of Innate Immunity 2021; 1-13.
- Gómez Perdiguero E, et al: Nature 2015; 518: 547-551.
- Schneberger D, Aharonson-Raz K, Singh B: Cell Tissue Res 2011; 343: 97-106.
- Herold S, et al: J Exp Med 2008; 205: 3065-3077.
PRÁCTICA GP 2022; 17(2): 18