El carcinoma urotelial es responsable del 90% de los tumores de vejiga urinaria. Cada año, 1250 personas contraen la enfermedad en Suiza, principalmente hombres mayores. El tratamiento estándar es la quimioterapia que contiene cisplatino. La inmunoterapia desempeña un papel cada vez más importante en las formas metastásicas.
El carcinoma urotelial es responsable del 90% de los tumores de vejiga urinaria. En los países occidentales, el carcinoma de células escamosas, el adenocarcinoma y el carcinoma de células pequeñas son poco frecuentes. Los sarcomas, linfomas o melanomas son aún más raros. El carcinoma urotelial de vejiga urinaria es responsable de cerca del 3% de los casos de cáncer en Suiza, es decir, 1250 nuevos casos cada año [1]. El 75% de los afectados son hombres. Más del 60% tienen más de 70 años en el momento del diagnóstico. Los factores de riesgo son la nicotina y los contaminantes como las aminas aromáticas (enfermedad profesional), la quimio y la radioterapia. En raras ocasiones se producen carcinomas uroteliales del tracto urotelial superior en el contexto del síndrome de Lynch. Los pacientes suelen presentar macrohematuria, polaquiuria, disuria y síntomas de urgencia urinaria en el momento del diagnóstico. Desgraciadamente, entre un 20 y un 25% ya son invasivas para los músculos en su primera manifestación. Históricamente, los pacientes con metástasis tienen una supervivencia media de sólo 12-18 meses.
La etapa localizada
Los estadios iniciales frecuentes (carcinomas uroteliales no músculo-invasivos) se resecan radicalmente mediante resección transuretral (RTU vejiga). Los pacientes con riesgo intermedio o alto son tratados posteriormente con terapia intravesical con BCG o quimioterapia. Los pacientes que no responden a la BCG tienen ahora la opción de ser tratados con inmunoterapia. En el estudio de fase 2 (estudio Keynote-057), los pacientes con cáncer de vejiga no músculo-invasivo de alto riesgo que no habían respondido al BCG fueron tratados con pembrolizumab cada 3 semanas durante 2 años. Se logró una tasa de remisión completa del 41%. Los efectos secundarios son comparables a los del contexto metastásico. La terapia fue aprobada por la FDA en EE.UU. [2].
El carcinoma urotelial músculo-invasivo en estadio localizado sigue siendo un problema importante. Alrededor del 50% de los pacientes con carcinoma vesical músculo-invasivo mueren en un plazo de 3 años debido a metástasis a pesar de la cistectomía. Por lo tanto, a partir del estadio T2 o N+, debe ofrecerse a las pacientes quimioterapia neoadyuvante (NAC). Con 3-4 ciclos de quimioterapia que contenga cisplatino (cisplatino y gemcitabina o MVAC en dosis densas), la supervivencia a 5 años podría incrementarse en un 5% en términos absolutos (Fig. 1). Un metaanálisis mostró una reducción patológica (<pT2) en el 49% de las pacientes con NAC que contenía cisplatino y gemcitabina. Tras la NAC, la tasa postoperatoria de tumores ypT0-N0 fue del 25-30%, lo que tiene un impacto significativo en la supervivencia libre de progresión y global [3]. Por desgracia, la aceptación de la quimioterapia neoadyuvante sólo ha aumentado ligeramente en los últimos años. Sólo algunas de las pacientes reciben quimioterapia neoadyuvante. Además, hay pacientes que no son aptos para la quimioterapia debido a su comorbilidad, es decir, la quimioterapia con cisplatino no es una opción para ellos. La sustitución del cisplatino por carboplatino se asocia a un resultado significativamente peor y, por lo tanto, no debe llevarse a cabo. Los buenos resultados de la inmunoterapia en el contexto metastásico han llevado a añadir la inmunoterapia a la quimioterapia neoadyuvante que se está probando actualmente en varios ensayos. Los estudios de fase 2 han demostrado que la terapia neoadyuvante con los inhibidores de los puntos de control atezolizumab y pembrolizumab puede lograr una tasa de respuesta patológica completa del 30-40% y la tasa de respuesta global (<pT2) fue del 40-50% [4,5]. El factor decisivo fue la expresión de PDL-1, que se asoció a una mejor tasa de respuesta.
Los resultados del estudio BLASST-1, que investigó el nivolumab en combinación con cisplatino y gemcitabina, mostraron una remisión patológica completa del 49% [6]. Con la quimioterapia neoadyuvante con cisplatino/gemcitabina sola, se encuentra una pCR de alrededor del 30%. El estudio SAKK 06/17, que investiga la quimioterapia neoadyuvante con cisplatino y gemcitabina en combinación con la inmunoterapia durvalumab, seguida de terapia de mantenimiento postoperatoria con durvalumab, se cerró recientemente. Un análisis provisional mostró una tasa de remisión patológicamente completa del 30%. Los resultados finales se esperan con impaciencia.
La regla de oro para el tratamiento del carcinoma urotelial músculo-invasivo de los estadios T2-4a, N0-X M0 sigue siendo la cistectomía radical y la linfadenectomía pélvica (con conducto ileal o vejiga de sustitución). En situaciones de alto riesgo, como la recidiva tras la terapia de instilación de BCG o en caso de tumores extensos o multiloculares de alto grado, se recomienda ya la cistectomía precoz a partir del estadio pT1. El momento de la operación tras la NAC es importante. Si el intervalo entre la quimioterapia y la cistectomía supera las 10 semanas, la supervivencia global empeora significativamente. No realizar la cirugía cuando existe una respuesta clínica completa también es una negligencia, ya que el 64% sigue teniendo tumor residual tras la cistectomía. La proporción de carcinomas uroteliales pT3/4 con y sin afectación ganglionar fue del 25%.
La “terapia trimodal” para preservar la vejiga, consistente en una combinación de resección transuretral radical y radioquimioterapia, puede ser una alternativa para pacientes inoperables o con un fuerte deseo de preservar el órgano, pero muestra un peor resultado oncológico [7].
Debe considerarse la quimioterapia adyuvante si no se ha administrado quimioterapia neoadyuvante. Especialmente de los estadios T3 y N+. Los datos de los metaanálisis al respecto son menos sólidos, pero sugieren que estos pacientes también se benefician [8].
Estadios metastásicos
Los pacientes con enfermedad recidivante o metastásica tienen un pronóstico muy malo (12-18 meses). Los factores pronósticos especialmente desfavorables con respecto a la supervivencia global son: un mal estado general con un Karnofsky Performance Status <80% y metástasis viscerales, incluidas las metástasis esqueléticas. La quimioterapia estándar con cisplatino y gemcitabina conduce a una respuesta del 50% [9]. La mediana de supervivencia es de 14 meses. Al fin y al cabo, entre el 13 y el 15% de los pacientes siguen vivos después de 5 años. En pacientes con buen estado general y sin metástasis viscerales, la mediana de supervivencia alcanza los 33 meses y el 20% siguen vivos después de 5 años. Por desgracia, esta terapia no es factible en muchos pacientes de edad avanzada debido a la comorbilidad. En la práctica clínica, el carboplatino se utiliza a menudo en lugar del cisplatino, que es significativamente menos eficaz en el carcinoma urotelial.
Con los inhibidores de los puntos de control, ahora existe una nueva opción terapéutica que también ofrece una opción de tratamiento, especialmente para los pacientes de más edad que no son compatibles con el cisplatino. En el ensayo de fase 2 Keynote-052, los pacientes fueron tratados con pembrolizumab 200 mg cada 3 semanas durante un máximo de 2 años [10]. Esto muestra una respuesta del 29%, incluyendo un 7% de remisión completa. La respuesta se observó principalmente con una expresión de PD-L1 superior al 10% (38%), aunque también se observó respuesta con una expresión de PD-L1 inferior al 10%. En el ensayo de fase 2 IMvigor 210, el atezolizumab logró una mediana de supervivencia de unos 16 meses [11]. Los pacientes que tenían una fuerte expresión de PD-L1 se beneficiaron significativamente más de la inmunoterapia (mediana de supervivencia de 19 meses). La respuesta fue del 32% con un 9% de remisiones completas.
En la 2ª línea tras el fracaso de la terapia que contiene platino, cabe esperar una respuesta de alrededor del 10-20%. La vinflunina se probó en un ensayo de fase 3 frente al mejor tratamiento de apoyo [12]. Hubo una respuesta del 9% y una mediana de supervivencia beneficiosa (6,9 frente a 4,6 meses).
En el IMvigor 211, un ensayo de fase 3 que comparaba el atezolizumab con diferentes agentes quimioterapéuticos, no se observó ningún efecto significativo de la inmunoterapia [13]. Sin embargo, el ensayo de fase 3 Keynote-045, que también comparó la inmunoterapia (pembrolizumab) con las distintas terapias (vinflunina, taxanos) fue positivo, con una supervivencia de 10,3 frente a 7,4 meses. Al cabo de un año, el 44% frente al 33% de los pacientes con quimioterapia seguían vivos [14].
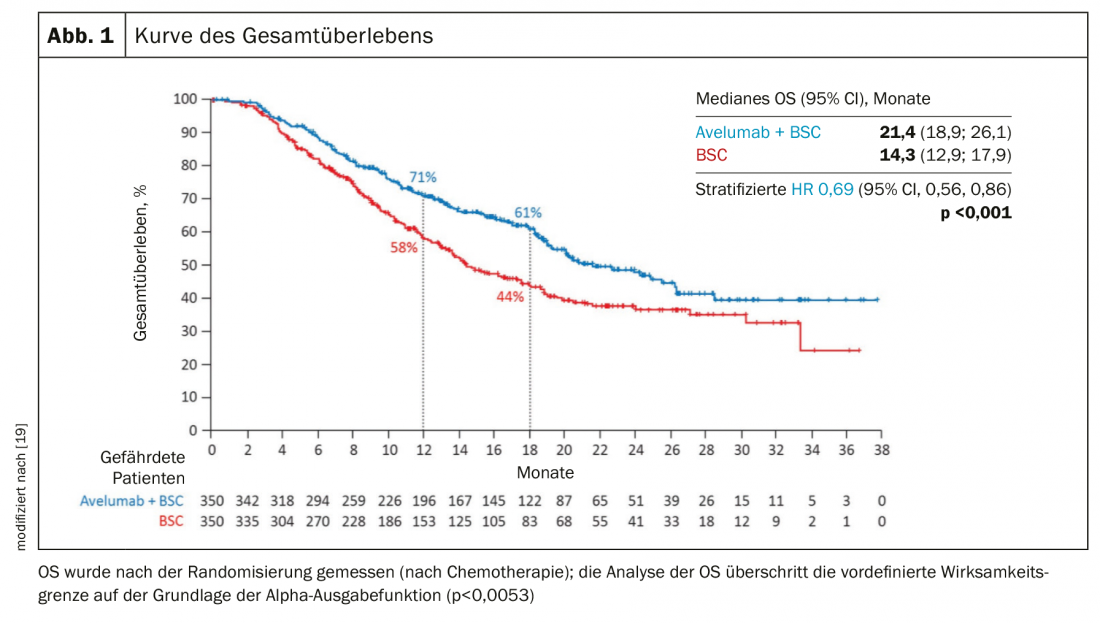
Tras el fracaso de la quimioterapia con platino y la inmunoterapia, puede considerarse la terapia con enfortumab vedotin, un conjugado anticuerpo-fármaco [15]. La respuesta al tratamiento en el estudio de fase 2 fue del 44%, con un 12% de remisiones completas (Fig. 2) . La mediana de respuesta fue de 7,6 meses.
Para los pacientes con una mutación del gen FGFR 3 o una fusión de los genes FGFR 2 o 3, existe la opción de una terapia con el inhibidor del FGFR Erdafitinib. En un ensayo abierto de fase 2, se trató a pacientes con al menos una terapia previa con erdafitinib [16]. Hubo una respuesta del 40% y una supervivencia libre de progresión y global de 5,5 y 5,5 semanas, respectivamente. 13,8 meses. La aprobación en EE.UU. se basó en la tasa de respuesta. En una fase 3, la terapia se está probando ahora frente a la quimioterapia y la inmunoterapia.
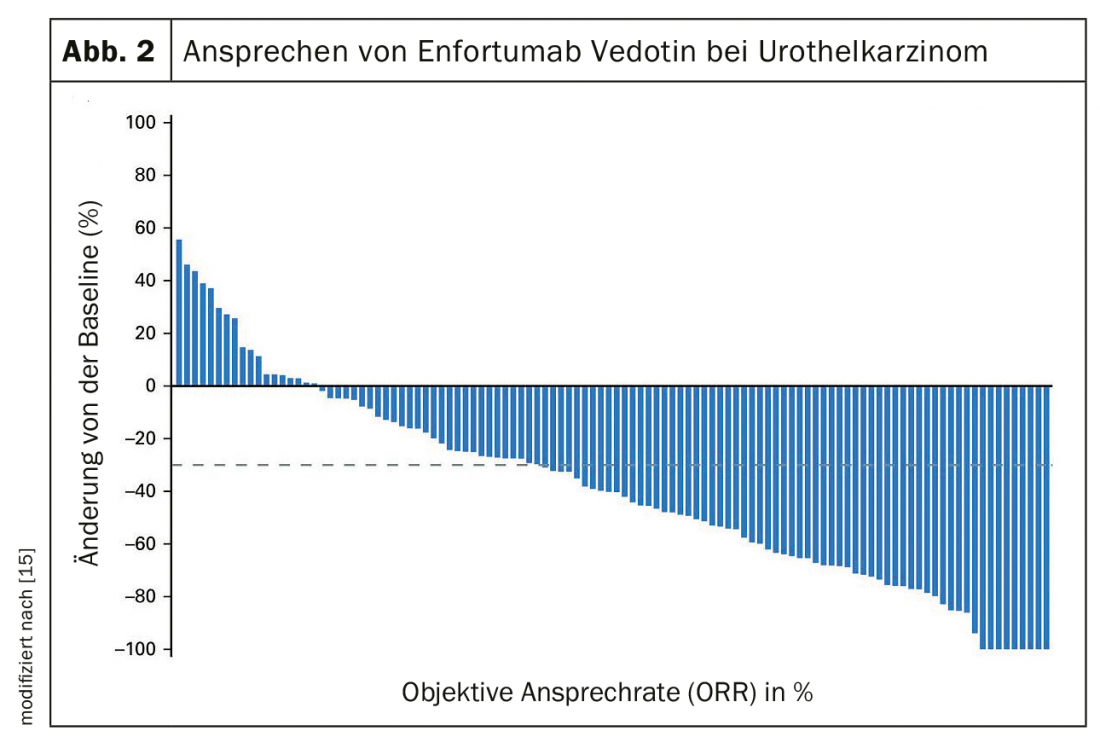
Actualmente no está claro si la quimioinmunoterapia primaria, que ya es estándar en el carcinoma bronquial, también supone una ventaja en el carcinoma urotelial. Debido a la elevada carga mutacional tumoral, que es indicativa de una buena respuesta a la inmunoterapia en muchos tumores, es plausible una ventaja del uso precoz de la inmunoterapia. IMvigor130, un ensayo de fase 3 que comparaba platino/gemcitabina +/- atezolizumab, fue negativo para el criterio de valoración coprimario de supervivencia global [17]. En cambio, la supervivencia libre de progresión fue 1,9 meses mejor (6,3 frente a 8,2 meses). En el ensayo de fase 3 JAVELIN Bladder 100, los pacientes que no habían progresado tras la quimioterapia con cisplatino fueron tratados con inmunoterapia con avelumab. Los pacientes con avelumab vivieron una media de 7 meses más (SG 14,3 frente a 21,4 meses) (Fig. 3) [18].
Mensajes para llevarse a casa
- La quimioterapia neoadyuvante con cisplatino sigue siendo el tratamiento estándar para los tumores localizados en estadio T2 y mejora la supervivencia en un 5% absoluto.
- En el carcinoma urotelial metastásico, la terapia de mantenimiento con el inhibidor de puntos de control avelumab mejora en 7 meses la supervivencia en respuesta a la quimioterapia con platino.
- En pacientes ancianos y polimórbidos con carcinoma urotelial localmente avanzado y metastásico, la opción de la inmunoterapia sola se tolera bien.
- Los marcadores moleculares también están cobrando cada vez más importancia en el tratamiento del carcinoma urotelial con la opción de la “terapia dirigida”, por ejemplo con el inhibidor del FGFR Erdafitinib.
- La terapia con el conjugado anticuerpo-fármaco enfortumab vedotin tiene una elevada tasa de respuesta incluso en pacientes pretratados.
Literatura:
- www.nicer.org
- www.fda.org/drugs
- Colaboración para el metaanálisis del cáncer de vejiga avanzado (ABC): Quimioterapia neoadyuvante en el cáncer de vejiga invasivo: actualización de una revisión sistemática y metaanálisis de datos de pacientes individuales colaboración para el metaanálisis del cáncer de vejiga avanzado (ABC). Eur Urol 2005; 48(2): 202-205.
- Powles T, et al: Estudio de fase II que investiga la seguridad y eficacia del atezolizumab neoadyuvante en el cáncer de vejiga músculo-invasivo (ABACUS). J Clin Oncol.2018;36(suppl 15; abstr 4506).
- Necchi A. et al: Pembrolizumab como terapia neoadyuvante antes de la cistectomía radical en pacientes con carcinoma de vejiga con invasión muscular (PURE-01): un estudio de fase II, abierto, de un solo brazo. J Clin Oncol 2018;36(34): 3353-3360.
- Gupta S, et al: Resultados del ensayo BLASST-1 (Bladder Cancer Signal Seeking Trial) de nivolumab, gemcitabina y cisplatino en cáncer de vejiga músculo-invasivo (MIBC) sometido a cistectomía. J Clin Oncol 2020;38(suppl 6; abstr 439).
- Chedgy ECP, et al: Cistectomía radical y tratamiento multidisciplinar del cáncer de vejiga con invasión muscular. JAMA Oncol 2016;2(7):855-856.
- Leow JJ et al. Quimioterapia adyuvante para el cáncer de vejiga invasivo: revisión sistemática y metaanálisis de ensayos aleatorizados actualizados en 2013. Eur Urol. 2014 Jul;66(1):42-54.
- Van der Maase H, et al: Resultados de supervivencia a largo plazo de un ensayo aleatorizado que compara gemcitabina más cisplatino con metotrexato, vinblastina, doxorrubicina más cisplatino en pacientes con cáncer de vejiga. J Clin Oncol 2005;23(21): 4602-4608.
- Balar AV, et al: Pembrolizumab de primera línea en pacientes elegibles para cisplatino con cáncer urotelial localmente avanzado e irresecable o metastásico (KEYNOTE-052): un estudio multicéntrico, de un solo brazo, de fase 2. Lancet Oncol. 2017;18(11): 1483.
- Balar AV, et al: Atezolizumab como tratamiento de primera línea en pacientes elegibles para cisplatino con carcinoma urotelial localmente avanzado y metastásico: un ensayo de fase 2, multicéntrico y de un solo brazo. Lancet 2017;389(10064): 67.
- Bellmunt J, et al: Ensayo de fase III de vinflunina más los mejores cuidados de apoyo en comparación con los mejores cuidados de apoyo solos tras un régimen con platino en pacientes con carcinoma avanzado de células de transición del tracto urotelial. J Clin Oncol. 2009;27(27): 4454.
- Powles T, et al: Atezolizumab frente a quimioterapia en pacientes con carcinoma urotelial localmente avanzado o metastásico tratado con platino (IMvigor211): ensayo controlado aleatorizado de fase 3, abierto y multicéntrico. Lancet. 2018; 391: 748-757.
- Bellmunt J, et al: Pembrolizumab como terapia de segunda línea para el carcinoma urotelial avanzado. N Engl J Med. 2017;376(11): 1015.
- Rosenberg JE et al. Ensayo pivotal de enfortumab vedotin en carcinoma urotelial tras terapia con platino y anti-muerte programada 1/ligando de muerte programada 1. J Clin Oncol. 2019;37(29):2592.
- Loriot Y et al. Erdafitinib en el carcinoma urotelial localmente avanzado o metastásico. N Engl J Med. 2019;381(4): 338
- IMvigor 130. ESMO 2019.
- Powles, et al: Javelin Bladder 100. ASCO 2020. Journal of Clinical Oncology 38, nº 18_suppl; DOI: 10.1200/JCO.2020.38.18_suppl.LBA1
- Vale CL: Quimioterapia neoadyuvante en el cáncer de vejiga invasivo: Actualización de una revisión sistemática y un metaanálisis. Urología europea 2005.
InFo ONCOLOGÍA Y HEMATOLOGÍA 2020; 8(4): 6-9