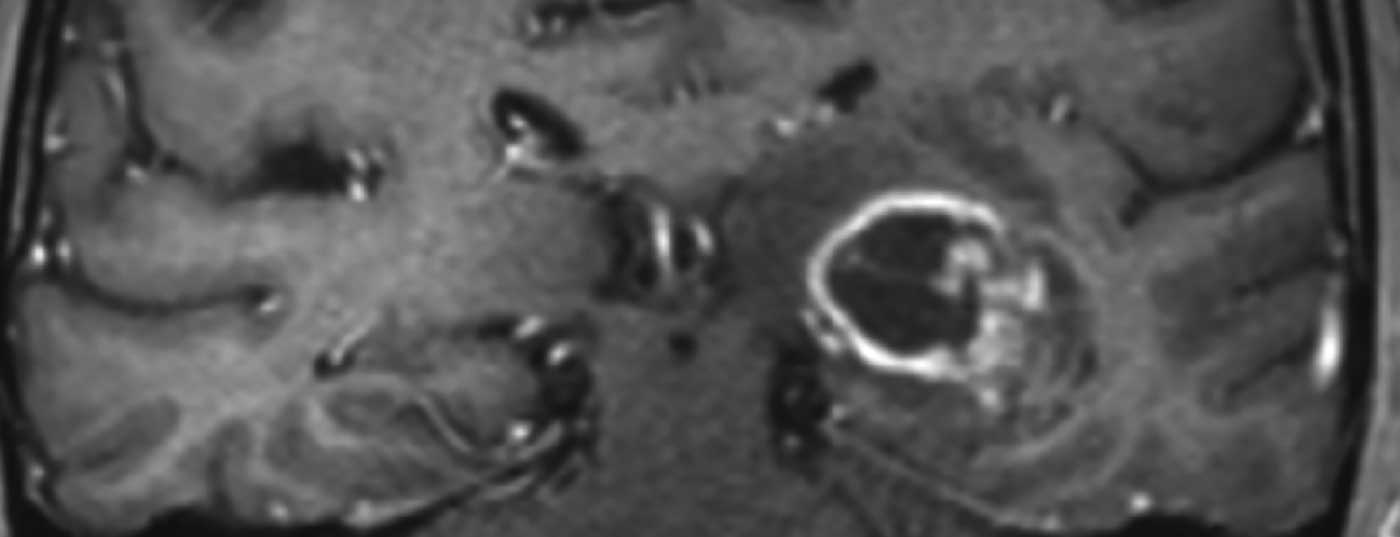
La norma para un glioblastoma recién diagnosticado es una resección lo más completa posible. A continuación se administra radioquimioterapia a base de temozolomida. Uno de los enfoques terapéuticos más recientes es el uso de campos de terapia tumoral.
Los glioblastomas son los tumores cerebrales primarios malignos más frecuentes en adultos y pueden aparecer básicamente a cualquier edad. La incidencia aumenta con la edad y la edad media de aparición es de 64 años. Los hombres se ven afectados con una frecuencia ligeramente superior a la de las mujeres [1]. La supervivencia media de los pacientes con un glioblastoma recién diagnosticado es sólo de unos 16 meses, incluso en los ensayos clínicos, y es significativamente menor en los estudios basados en la población.
En contraste con los escasos avances terapéuticos, la comprensión de las bases biológicas moleculares de los glioblastomas se ha ampliado considerablemente en los últimos diez años. Según la clasificación de la OMS revisada en 2016, los glioblastomas que surgen de novo no presentan una mutación en uno de los dos genes de la isocitrato deshidrogenasa (IDH). Este grupo representa alrededor del 90% de todos los glioblastomas. Por el contrario, los glioblastomas mucho más raros que surgen de un tumor de bajo grado suelen presentar una mutación IDH y tienen un mejor pronóstico. En consecuencia, estos tumores se recogen por separado en la nueva clasificación de la OMS [2]. La O6-metilguanina-ADN metiltransferasa (MGMT) se ha establecido como un biomarcador importante. Es una proteína reparadora del ADN que invierte las alquilaciones en la posición O6 de la guanina. La metilación del promotor MGMT se encuentra en aproximadamente un tercio de los glioblastomas. El resultado de la metilación es una expresión ausente o reducida de MGMT, lo que conduce a una sensibilidad de las células a la quimioterapia alquilante.
Los glioblastomas se manifiestan a través de diferentes síntomas clínicos, que dependen principalmente de la localización del tumor en el cerebro. Además de los cambios de personalidad, las cefaleas, las náuseas y los vómitos en el sentido de los síntomas de presión intracraneal o los déficits neurológicos focales, un ataque epiléptico conduce a menudo a una aclaración diagnóstica. La resonancia magnética craneal suele mostrar una lesión marginalmente absorbente de contraste con necrosis central (Fig. 1). Si existe la sospecha de un glioblastoma u otro tumor cerebral en las imágenes, normalmente debe buscarse un diagnóstico histológico.
Terapia
El objetivo de la intervención quirúrgica, además de obtener tejido, es lograr la máxima resección posible que pueda llevarse a cabo sin provocar nuevos déficits neurológicos. Los tumores cuya resección completa no sea posible debido a su localización en el cerebro sólo deben someterse a biopsia. Lo mismo se aplica a los pacientes con un estado general reducido que pueden no ser capaces de soportar las tensiones de una cirugía extensa. El uso de ácido 5-aminolevulínico e imágenes intraoperatorias puede mejorar el alcance de la resección. Esto conduce a una prolongación de la supervivencia libre de progresión [3,4].
Desde 2005, la radioterapia con terapia concomitante de temozolomida seguida de terapia de mantenimiento con temozolomida durante un máximo de seis ciclos (TMZ/RT -> TMZ) ha sido la terapia estándar para pacientes con glioblastoma recién diagnosticado. La radioquimioterapia es superior a la radioterapia sola [5]. La temozolomida es un alquilano que puede administrarse por vía oral y tiene un perfil de efectos secundarios globalmente favorable. Los efectos secundarios más comunes incluyen fatiga y náuseas, así como mielosupresión, algunos de los cuales requieren un ajuste de la dosis.
Varios intentos de complementar la radioquimioterapia a base de temozolomida con otras sustancias no han conseguido prolongar los tiempos de supervivencia. Esto se aplica en particular al anticuerpo bevacizumab, dirigido contra el factor de crecimiento endotelial vascular (VEGF). La adición de bevacizumab a la terapia estándar resultó en una prolongación de la supervivencia libre de progresión en pacientes con glioblastoma recién diagnosticado, pero no en una prolongación de la supervivencia global [6,7]. La vacuna peptídica rindopepimut, dirigida contra la variante mutante vIII del “receptor del factor de crecimiento epidérmico” (EGFRvIII), también se investigó en un ensayo aleatorizado en pacientes con glioblastoma EGFRvIII-positivo recién diagnosticado. Sin embargo, no se encontró ninguna ventaja de supervivencia en comparación con una vacuna placebo [8].
A diferencia de los fármacos mencionados anteriormente, se ha demostrado que un nuevo enfoque terapéutico con los denominados campos tratantes de tumores prolonga la supervivencia [9]. En este caso, se genera un campo eléctrico a través de electrodos que se aplican en el cráneo, lo que debería conducir a una inhibición de la proliferación de las células tumorales. El tratamiento con campos de terapia tumoral se añade a la terapia de mantenimiento con temozolomida. Lo ideal es llevar el dispositivo al menos 18 horas al día. Los efectos secundarios más comunes incluyen la irritación de la piel por los electrodos adhesivos. Queda por ver cuántos pacientes optarán por este tratamiento además de la quimioterapia en el futuro. Además, la cuestión del reembolso por parte de las compañías de seguros sigue sin estar clara en la mayoría de los países.
La terapia de los pacientes de edad avanzada con glioblastoma plantea un reto especial. Mientras tanto, un estudio aleatorizado ha demostrado que la combinación de radioterapia y quimioterapia con temozolomida también es superior a la radioterapia sola en estos pacientes. Sin embargo, la temozolomida sólo conlleva una ventaja de supervivencia relevante en pacientes con un tumor MGMT-metilado [10]. En consecuencia, puede considerarse la radioterapia sola, sobre todo en pacientes mayores de 70 años con un tumor MGMT no metilado. Los pacientes con tumores MGMT-metilados en los que no esté indicada la radioquimioterapia combinada, por ejemplo debido a un estado general reducido, pueden recibir monoterapia con temozolomida [11]. Especialmente en pacientes de edad avanzada con un estado general reducido, debe evaluarse un concepto de terapia paliativa de apoyo en una fase temprana debido al pronóstico tan desfavorable.
Outlook
En la actualidad, el interés científico se centra principalmente en los enfoques de tratamiento inmunoterapéutico [12]. Además de los conceptos avanzados de vacunación, se están investigando en particular los inhibidores de la vía de señalización de la “muerte celular programada” (PD)-1. El inhibidor de PD1 nivolumab se está utilizando actualmente en dos ensayos aleatorios de fase III. El ensayo Checkmate 498 está comparando la combinación de radioterapia y nivolumab con la terapia estándar (TMZ/RT -> TMZ) en pacientes con glioblastoma no metilado MGMT. El ensayo Checkmate 548, de reclutamiento paralelo, está comparando la adición de nivolumab o placebo a la TMZ/RT -> TMZ en pacientes con glioblastoma recién diagnosticado en los que el tumor presenta metilación del promotor MGMT. Los resultados de éste y otros estudios mostrarán si los enfoques inmunoterapéuticos pueden contribuir a un mejor pronóstico en los pacientes con glioblastoma.
Mensajes para llevarse a casa
- La terapia estándar para un glioblastoma recién diagnosticado consiste en una resección lo más completa posible, seguida de radioquimioterapia a base de temozolomida.
- Añadir bevacizumab a la terapia estándar no prolonga la supervivencia en pacientes con glioblastoma.
- Un estudio de fase III, evaluado como positivo, demostró una prolongación de la supervivencia de varios meses mediante el uso de campos de terapia tumoral.
- Los estudios actualmente en curso investigan en particular diversos enfoques de tratamiento inmunoterapéutico.
Literatura:
- Ostrom QT, et al: Informe estadístico CBTRUS: tumores cerebrales primarios y otros tumores del sistema nervioso central diagnosticados en Estados Unidos en 2009-2013. Neuro Oncol 2016; 18(Suppl 5): v1-v75.
- Louis DN, et al: Clasificación de los tumores del sistema nervioso central de la Organización Mundial de la Salud de 2016: resumen. Acta Neuropathol 2016; 131(6): 803-820.
- Stummer W, et al: Cirugía guiada por fluorescencia con ácido 5-aminolevulínico para la resección del glioma maligno: un ensayo multicéntrico aleatorizado y controlado de fase III. Lancet Oncol 2006; 7(5): 392-401.
- Senft C, et al: Guía intraoperatoria por resonancia magnética y extensión de la resección en la cirugía del glioma: un ensayo aleatorizado y controlado. Lancet Oncol 2011; 12(11): 997-1003.
- Stupp R, et al: Radioterapia más temozolomida concomitante y adyuvante para el glioblastoma. N Engl J Med 2005; 352(10): 987-996.
- Chinot OL, et al: Bevacizumab más radioterapia-temozolomida para el glioblastoma de diagnóstico reciente. N Engl J Med 2014; 370(8): 709-722.
- Gilbert MR, et al: Un ensayo aleatorizado de bevacizumab para el glioblastoma recién diagnosticado. N Engl J Med 2014; 370(8): 699-708.
- Weller M, et al: Rindopepimut con temozolomida para pacientes con glioblastoma EGFRvIII de nuevo diagnóstico (ACT IV): ensayo internacional de fase 3, aleatorizado y doble ciego. Lancet Oncol 2017; 18(10): 1373-1385.
- Stupp R, et al: Terapia de mantenimiento con campos tratantes del tumor más temozolomida frente a temozolomida sola para el glioblastoma: un ensayo clínico aleatorizado. JAMA 2015; 314(23): 2535-2543.
- Perry JR, et al: Radioterapia de corta duración más temozolomida en pacientes ancianos con glioblastoma. N Engl J Med 2017; 376(11): 1027-1037.
- Weller M, et al: Directriz de la Asociación Europea de Neurooncología (EANO) sobre el diagnóstico y tratamiento de los gliomas astrocíticos y oligodendrogliales del adulto. Lancet Oncol 2017; 18(6): e315-e329.
- Weiss T, Weller M, Roth P: Inmunoterapia para el glioblastoma: conceptos y retos. Curr Opin Neurol 2015; 28(6): 639-646.
InFo ONCOLOGÍA Y HEMATOLOGÍA 2017; 5(6): 16-18