El síndrome de ovario poliquístico (SOP) es una de las causas más frecuentes de infertilidad y es uno de los trastornos endocrinológicos más comunes en las mujeres (5-10%) [1,2]. La definición más utilizada actualmente (criterios de Rotterdam) incluye dos de los tres síntomas siguientes: ovarios poliquísticos – oligo/amenorrea, y/o signos clínicos de hiperandrogenemia. Alrededor del 50% de los afectados son obesos. En estas mujeres en particular, suele detectarse resistencia a la insulina, y la transición al síndrome metabólico es suave. En las pacientes delgadas con PCO-S, la hiperandrogenemia y/o la anovulación están en primer plano. La terapia de la PCO-S depende de los síntomas que estén en primer plano.
La enfermedad se presenta en varias formas, desde el PCO-S leve y asintomático hasta la forma extrema, el síndrome de Stein-Leventhal. Las afectadas suelen acudir a la consulta por dos motivos: por un deseo insatisfecho de tener hijos (hasta un 74%) o por trastornos del ciclo, sobre todo oligo- a amenorrea (hasta un 50%), que suelen aparecer durante la pubertad.
Sin embargo, además de los síntomas más comunes, también los hay:
- Signos de androgenización creciente
- Cambios de laboratorio con aumento de LH y niveles normales o disminuidos de FSH.
- Aumento de los niveles de andrógenos
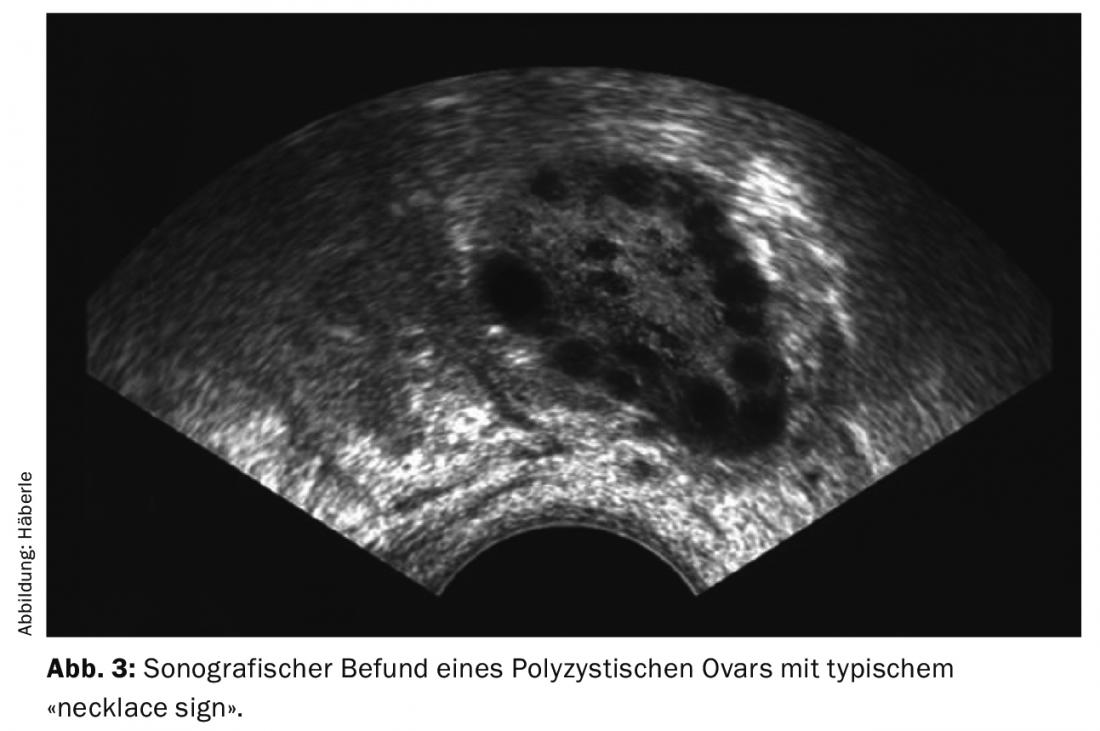
- En el análisis ecográfico, la imagen típica de unos ovarios agrandados con numerosos folículos pequeños dispuestos subcorticalmente como un collar de perlas (signo del collar).
Estos signos clínicos no tienen por qué darse todos al mismo tiempo. Los síntomas individuales también pueden indicar ya una enfermedad.
Mientras que el PCO-S se consideraba inicialmente sobre todo un síndrome caracterizado por la aparición de androgenización y un deseo insatisfecho de tener hijos, el síndrome metabólico asociado al PCO-S y sus consecuencias a largo plazo, que ponen en peligro la vida, están pasando ahora a primer plano [3]. Por lo tanto, el diagnóstico y la terapia precoces son de gran importancia para reducir el posterior aumento del riesgo de enfermedad cardiovascular, diabetes de tipo 2 y carcinoma endometrial.
Debido a su importancia clínica, la PCO-S no sólo preocupa a los ginecólogos y dermatólogos, sino también cada vez más a los internistas. Las causas exactas de la PCO-S aún no están claras. En vista de la agrupación familiar y de los resultados de los estudios de gemelos, se supone que las causas genéticas desempeñan un papel. De hecho, se han identificado varios loci genéticos que se cree que están asociados al desarrollo del SOP [4].
Patogénesis de la PCO-S
Los andrógenos femeninos se producen en proporciones diferentes en la corteza suprarrenal y en los ovarios. La producción de testosterona en la corteza suprarrenal y los ovarios está regulada por la liberación de hormonas de la glándula pituitaria. El cortisol y el estradiol provocan una retroalimentación negativa al inhibir la liberación de hormonas liberadoras (Fig. 1).
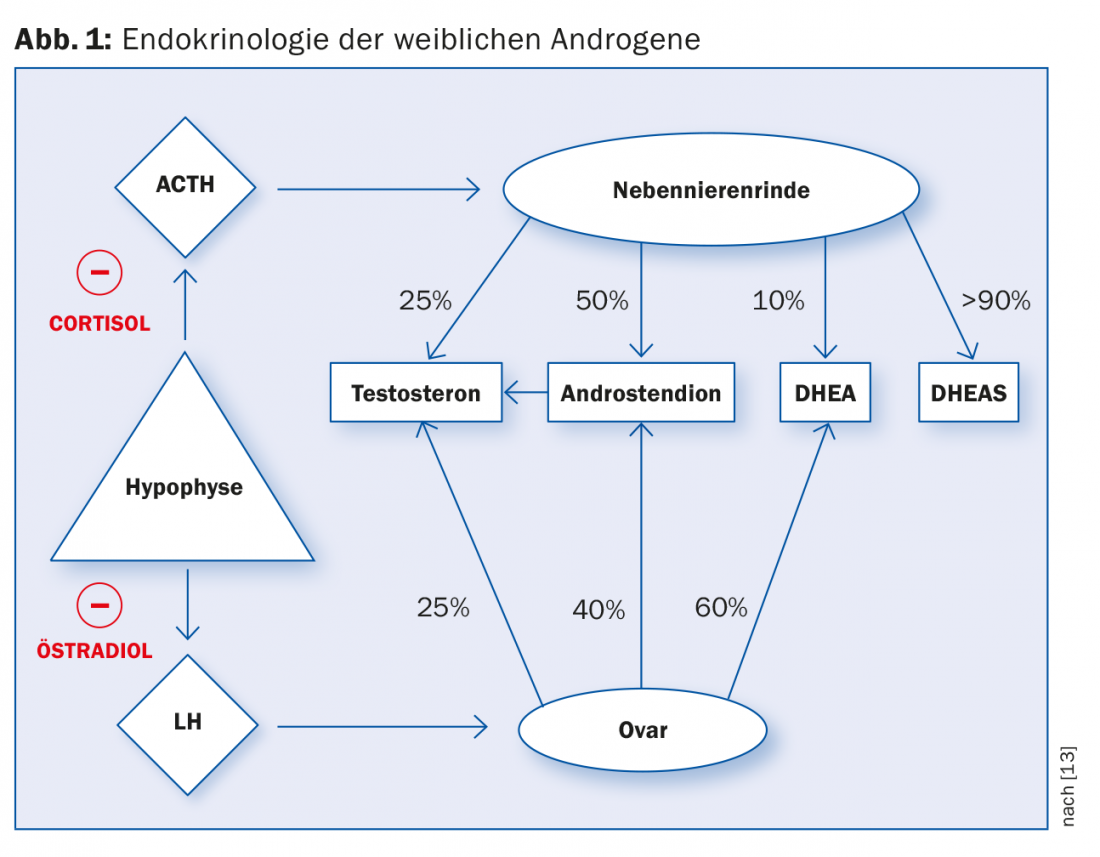
En principio, se supone que la PCO-S está causada por una alteración del circuito endocrino regulador hipotalámico-hipofisario-ovárico. Probablemente exista una falta de actividad de las aromatasas en las células de la granulosa del ovario, que son estimuladas por la FSH en las mujeres sanas. El engrosamiento hialino de la membrana basal conduce a la inhibición de la acción de la FSH, con lo que las células de la granulosa degeneran debido a una estimulación inadecuada. Al mismo tiempo, la biosíntesis de esteroides en el ovario se descarrila debido a la continua estimulación gonadotrópica por la LH, con lo que se producen más andrógenos. El hipotiroidismo subclínico se encuentra en el 10 al 25% de los pacientes. La conexión y la influencia en el circuito regulador hipofisario-ovárico aún no están claras [5].
Medidas de diagnóstico
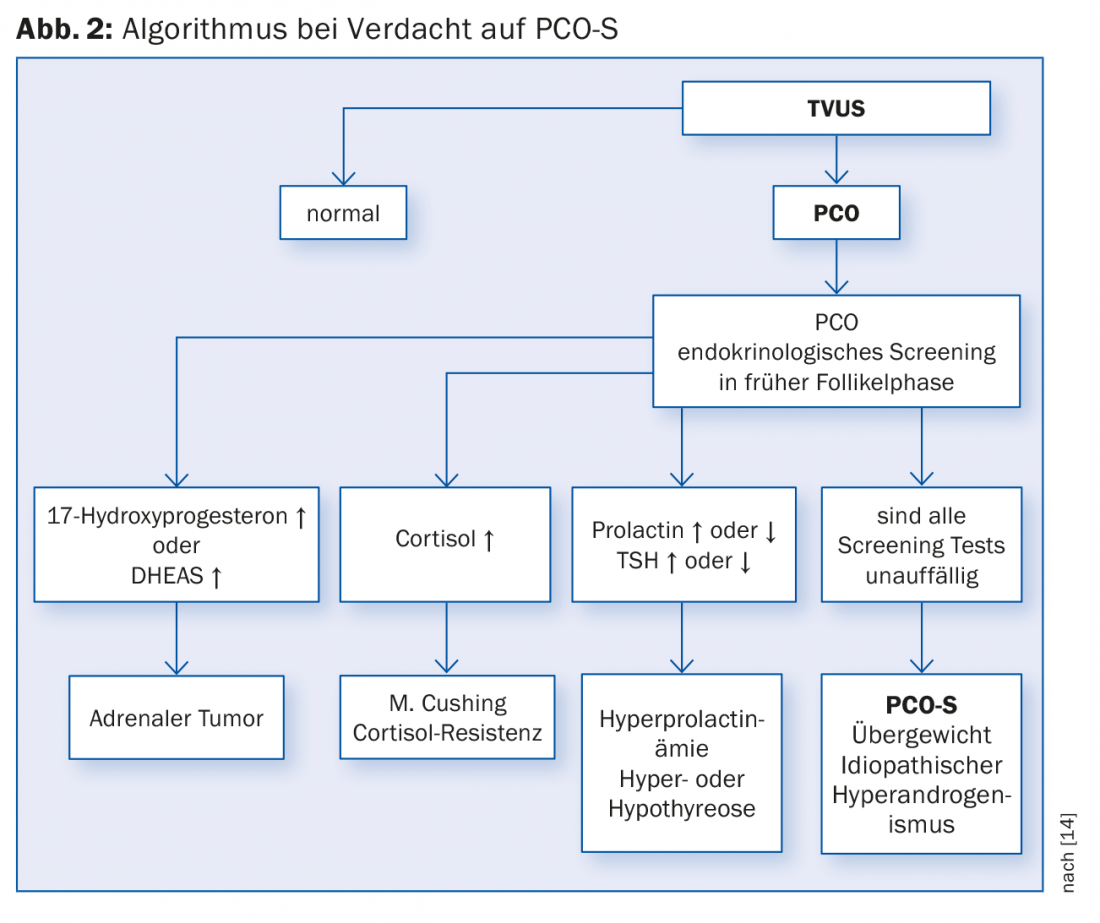
Además de los síntomas más comunes de esterilidad y oligo- resp. amenorrea, forma parte de la confirmación del diagnóstico (véase también Fig. 2):
- Una amplia historia sobre la menarquia, el ciclo menstrual y los antecedentes familiares.
- Un examen clínico con especial atención a la androgenización creciente con hirsutismo de hasta el 70%, acné de hasta el 35%, alopecia, obesidad de hasta el 85% (IMC).
- Evaluación hormonal en la fase folicular temprana, en ayunas con determinación de: LH, FSH, prolactina, estrona (E1), estradiol (E2), SHBG (globulina fijadora de hormonas sexuales), DHEA (dehidroepiandrosterona), DHEA-S (sulfato de dehidroepiandrosterona), 17-alfa-OH-progesterona, cortisol, TSH, testosterona, androstenediona.
- Ecografía transvaginal que muestra ovarios agrandados con numerosos folículos pequeños.
- Si se sospecha de síndrome metabólico, también debe investigarse la resistencia a la insulina. Glucosa en ayunas, insulina en ayunas, cálculo de la puntuación HOMA (Homeostasis Model Assessment), determinación de LDL, HDL y triglicéridos, tensión arterial.
ad 1) Alrededor del 80% de las pacientes refieren trastornos menstruales, principalmente oligo- a amenorrea de hasta el 50% cada una, que suelen aparecer durante la pubertad. Es importante preguntar por la edad de la menarquia y el posterior patrón del ciclo, ya que la hiperandrogenemia suele provocar anovulación crónica o amenorrea secundaria de forma precoz. Pregunte también por otros familiares que hayan tenido acné o hirsutismo.
ad 2) En el examen clínico, el hirsutismo se registra mediante la puntuación de Ferriman y Gallwey [6].
ad 3 ) El aclaramiento hormonal revela un aumento de LH y valores normales o disminuidos de FSH. Esto se debe a que la LH se libera de forma pulsátil desde la hipófisis anterior en respuesta a la liberación pulsátil de GnRH (hormona liberadora de gonadotropina) desde el hipotálamo. También se elevan la androstenediona androgénica, la testosterona y, algo menos frecuentemente, la DHEA. Del mismo modo, los niveles de estrona (E1) son elevados en comparación con los de estradiol (E2) en la fase folicular temprana [7]. En las mujeres con hirsutismo, debe medirse primero la testosterona libre. Si se sospecha de un tumor suprarrenal, también deben medirse la DHEA y la DHEA-S.
Hallazgos hormonales típicos en la PCO-S:
- Andrógenos limítrofes altos o elevados (testosterona, androstenediona, DHEAS)
- Cociente LH/FSH aumentado, (es decir, FSH en el rango normal) > 1,0 al principio del ciclo
- Disminución de la SHBG
ad 4 ) Estos signos clínicos no tienen por qué darse todos simultáneamente. La aparición de síntomas individuales puede indicar ya una enfermedad. Debido a la heterogeneidad de este cuadro clínico, a veces resulta difícil establecer un diagnóstico definitivo. Por ello, distintos grupos han desarrollado diferentes criterios de diagnóstico. En 2012, un taller del Instituto Nacional de Salud (NIH) analizó los diferentes criterios diagnósticos y recomendó que el diagnóstico de la PCO-S se realizara según los criterios de Rotterdam [8]. Los criterios de Rotterdam son el resultado de una reunión internacional de consenso celebrada en Rotterdam en 2003 [9], véase la tabla 1.

El diagnóstico de ovarios poliquísticos (OCP) se realiza ecográficamente (preferiblemente mediante ecografía vaginal) (Fig. 3). Según la definición actual (criterios de Rotterdam), se consideran poliquísticos 12 o más folículos de 2-9 mm por ovario y/o un tamaño ovárico de >10 ml (volumen ovárico = 0,5 × longitud × anchura × grosor). Para el diagnóstico, basta con que un ovario cumpla los criterios. Cuando se toman inhibidores de la ovulación, los ovarios no pueden evaluarse en este sentido.
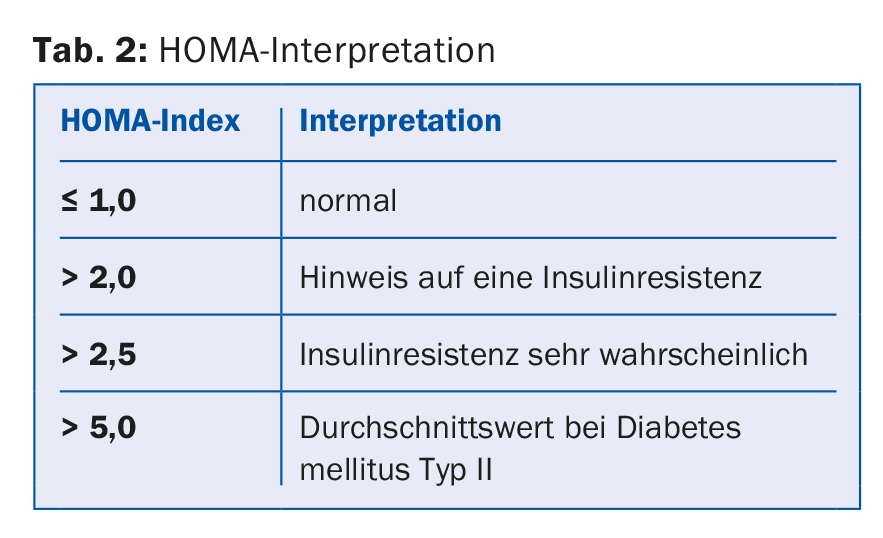
ad 5) Si se sospecha de síndrome metabólico, también debe aclararse la resistencia a la insulina. Para ello, se determinan la glucosa y la insulina en ayunas y a partir de ellas se calcula el índice HOMA. [10] (Tab. 2).
Fórmula para determinar el índice HOMA:
Índice HOMA = insulina (en ayunas, µU/ml) × glucemia (en ayunas, mg/dl) / 405
Índice HOMA = insulina (en ayunas, µU/ml) × glucemia (en ayunas, mmol/l) / 22,5
En lugar de determinar el índice HOMA, también puede realizarse una prueba de tolerancia oral a la glucosa (oGTT) con 75 g de glucosa. El síndrome metabólico en las mujeres obesas también incluye niveles elevados de LDL combinados con niveles bajos de HDL y triglicéridos.
Se está debatiendo si debe determinarse también la concentración de hormona antimülleriana (HAM) en el suero para confirmar el diagnóstico. Pero los datos hasta la fecha no son concluyentes y, por tanto, la determinación de la HAM aún no se recomienda para uso rutinario [11]. El diagnóstico final de PCO-S se realiza una vez excluidos otros diagnósticos diferenciales como el hipotiroidismo primario, la hiperprolactinemia, la hiperplasia suprarrenal, los tumores productores de andrógenos, el síndrome adrenogenital (SGA) y la enfermedad de Cushing. También es importante excluir el suministro de andrógenos exógenos.
Consecuencias a largo plazo para la salud de la PCO-S
Las mujeres con PCO-S diagnosticado según estos criterios tienen un mayor riesgo de padecer las siguientes enfermedades concomitantes: Los ciclos irregulares debidos a la anovulación se deben sobre todo a la falta de progesterona, la “contrapartida” del estrógeno, lo que provoca un deseo insatisfecho de tener hijos. La obesidad conlleva un mayor riesgo de desarrollar síndrome metabólico, diabetes de tipo 2, también como resultado de una historia familiar positiva de diabetes de tipo 2 y una actividad defectuosa de la insulina (resistencia a la insulina y disfunción de las células beta). Por lo tanto, también aumenta el riesgo de hipertensión arterial y enfermedades cardiovasculares. La combinación de obesidad e hiperandrogenismo provoca un aumento de los niveles de estrógenos debido a la aromatización de los andrógenos en el tejido adiposo. Esto aumenta el riesgo de desarrollar cáncer de endometrio.
Terapia
La PCO-S es muy heterogénea no sólo bioquímica sino también clínicamente.
El tratamiento depende principalmente de lo que sea más importante para el paciente. Además, el objetivo a largo plazo es evitar las enfermedades concomitantes.
Esterilidad: El objetivo de la terapia es la inducción de la ovulación mediante estimulación hormonal. La administración del antiestrógeno clomifeno (debe encargarse en Suiza a una farmacia internacional) es el tratamiento de primera elección. Los pacientes que muestren hiperprolactinemia deben ser tratados con bromocriptina o cabegolina. Deben administrarse glucocorticoides a las pacientes con un componente suprarrenal con niveles elevados de DHEA-S antes de estimular con clomifeno. Las gonadotropinas como la gonadotropina menopáusica humana (HMG) o la FSH sólo deben utilizarse si existe resistencia a la terapia. En estos casos, a veces también es útil realizar un tratamiento previo con un agonista de la GnRH antes de la terapia con gonadotropinas, lo que aumenta el éxito de la terapia [12]. Esta forma de terapia sólo debe ser llevada a cabo por clínicos experimentados que también controlen cuidadosamente el crecimiento folicular con ecografía. En las pacientes con PCO-S, una pequeña dosis es a veces suficiente para estimular el crecimiento de los numerosos folículos a pesar de la ausencia espontánea de ovulación. Esto puede provocar un síndrome de hiperestimulación y, en consecuencia, embarazos múltiples de mayor orden.
Un procedimiento quirúrgico como la resección bilateral en cuña del ovario o la destrucción del tejido ovárico con electrocoagulación sólo debe realizarse como “última ratio”. Aún no se ha demostrado que se produzca un ciclo regular después de dicha terapia. Además, pueden producirse adherencias como resultado de dichas operaciones, lo que puede ser un obstáculo para la concepción. Tras una terapia conservadora infructuosa durante seis meses con estimulación hormonal con o sin inseminación, está indicada la FIV/ICSI.
Obesidad y síndrome metabólico con resistencia a la insulina: La primera medida terapéutica es reducir el IMC cambiando el estilo de vida con una actividad física regular, apoyada por un asesoramiento nutricional. Si estas medidas no conducen al éxito, la cirugía bariátrica puede llevar a la meta. La pérdida de peso corrige prácticamente todos los parámetros patológicos en la PCO-S y puede conducir así a un ciclo ovulatorio. Ya una reducción de peso del 5 al 10% mejora el hirsutismo en cerca del 50% de las pacientes en un plazo de seis meses.
Metformina (2 × 500 mg hasta 3 × 850 mg de metformina/día, máx. a 2500 mg/día), un derivado de la biguanida y fármaco antidiabético, mejora la posibilidad de que vuelvan los ciclos ovulatorios normales al reducir la secreción ovárica de andrógenos. La metformina puede combinarse con inhibidores de la ovulación sin ningún problema. Se utiliza cada vez más generosamente para todas las formas de PCO-S.
Acné e hirsutismo: Los antiandrógenos cíclicos (por ejemplo, el acetato de ciproterona) como los progestágenos, los anticonceptivos orales, que por un lado provocan una reducción de la liberación ovárica de andrógenos y por otro un aumento de la concentración periférica de SHBG, ayudan en este caso. Esto suele provocar una reducción de la actividad androgénica periférica. En aproximadamente el 60% de los pacientes, el acné ya no es detectable tras seis meses de tratamiento. Los glucocorticoides se utilizan en pacientes con un aumento de la producción de andrógenos suprarrenales.
Literatura:
- Azziz R, Woods KS, Reyna R, et al: Prevalencia y características del síndrome de ovario poliquístico en una población no seleccionada. J Clin Endocrinol Metab. 2004; 89(6): 2745.
- Ehrmann DA: Síndrome de ovario poliquístico. N Engl J Med 2005 24 de marzo; 352(12): 1223-36.
- Comité de redacción sobre el síndrome de ovario poliquístico de la Asociación Americana de Endocrinólogos Clínicos. Declaración de posición de la Asociación Americana de Endocrinólogos Clínicos sobre las consecuencias metabólicas y cardiovasculares del síndrome de ovario poliquístico. Endocr Pract. 2005 Mar-Abr; 11(2): 126-34.
- World CK, Duran JM: Genética del síndrome de ovario poliquístico. Semin Reprod Med. 2014 mayo;32(3): 177-82.
- Pergialiotis V, et al: Gestión de las enfermedades endocrinas: El impacto del hipotiroidismo subclínico en las características antropométricas, los lípidos, la glucosa y el perfil hormonal de las pacientes con SOP: una revisión sistemática y un metaanálisis. Eur J Endocrinol. 2017 Mar;176(3): R159-R166.
- Hatch R, Rosenfield RL, et al: Hirsutismo: implicaciones, etiología y tratamiento. Am J Obstet Gynecol. 1981 Ago 1;140(7): 815-30.
- Rebar R, Judd HL, et al: Caracterización de la secreción inapropiada de gonadotropinas en el síndrome de ovario poliquístico. J Clin Invest. 1976 mayo;57(5):1320-9.
- NIH. Síndrome de ovario poliquístico (SOP) – Recursos. http://prevention.nih.gov/workshops/2012/pcos/resources.aspx (consultado el 19 de marzo de 2013).
- Grupo del taller de consenso sobre el SOP patrocinado por ESHRE/ASRM de Rotterdam. Consenso revisado de 2003 sobre los criterios diagnósticos y los riesgos para la salud a largo plazo relacionados con el síndrome de ovario poliquístico (SOP). Hum Reprod 2004;19: 41.
- Carmina E, Lobo RA: Uso de la sangre en ayunas para evaluar la prevalencia de la resistencia a la insulina en mujeres con síndrome de ovario poliquístico. Fértil Estéril. 2004 Sep; 82(3): 661-5.
- Eilertsen TB, Vanky, et al: Hormona antimulleriana en el diagnóstico del síndrome de ovario poliquístico: ¿puede sustituirse la descripción morfológica? Hum Reprod. 2012 ago; 27(8): 2494-502.
- Filicori M, Valdiserri A, et al.: Inducción de la ovulación con hormona liberadora de gonadotropina pulsátil: Modalidades técnicas y perspectivas clínicas. Fertil Steril 56: 1, 1991.
- De Burger HG: Fertil Steril. 2002; 77 Suppl 4): S3-S5 y Simon JA: Fertil Steril.2002; 77(Suppl 4): 77-82) y Brand JS et al: Int J Impot Res. 2010; 22(2): 91-104.
- De Buggs C, Rosenfield RL: Síndrome de ovario poliquístico en la adolescencia. Endocrinol Metab Clin North Am 2005; 34: 677.
PRÁCTICA GP 2017; 12(3): 28-32











