La exposición al amianto hasta 1990 está pasando factura, entre otras cosas por el número aún creciente de mesoteliomas pleurales malignos en Suiza. La esperanza de vida de los afectados es extremadamente baja, en torno a los doce meses, y no existe un procedimiento de detección adecuado. No obstante, con la reciente aprobación de la primera opción inmunoterapéutica para esta enfermedad, existe cierta esperanza.
El principal factor de riesgo está claro: la exposición al amianto. Sin embargo, aunque la importación y la transformación del amianto están prohibidas en Suiza desde el 1 de marzo de 1990, el número de casos de mesotelioma pleural maligno sigue aumentando [1,2]. Debido al periodo de latencia de 20 a 55 años, no se espera un máximo de nuevos casos hasta 2030 [1]. Actualmente se diagnostican en Suiza unas 200 enfermedades al año. Los hombres se ven afectados en el 85% de los casos, en su mayoría mayores de 60 años [3]. Por desgracia, el pronóstico es extremadamente desfavorable, con una mediana de supervivencia inferior a un año [4]. Tras décadas en las que la cirugía y la quimioterapia, así como la radioterapia en caso necesario, constituían la espina dorsal de la terapia, los modernos fármacos oncológicos entraron en juego recientemente por primera vez con la aprobación de la inmunoterapia dual con ipilimumab/nivolumab, que esperemos sea el pistoletazo de salida para nuevas mejoras terapéuticas en el futuro.
El amianto como culpable
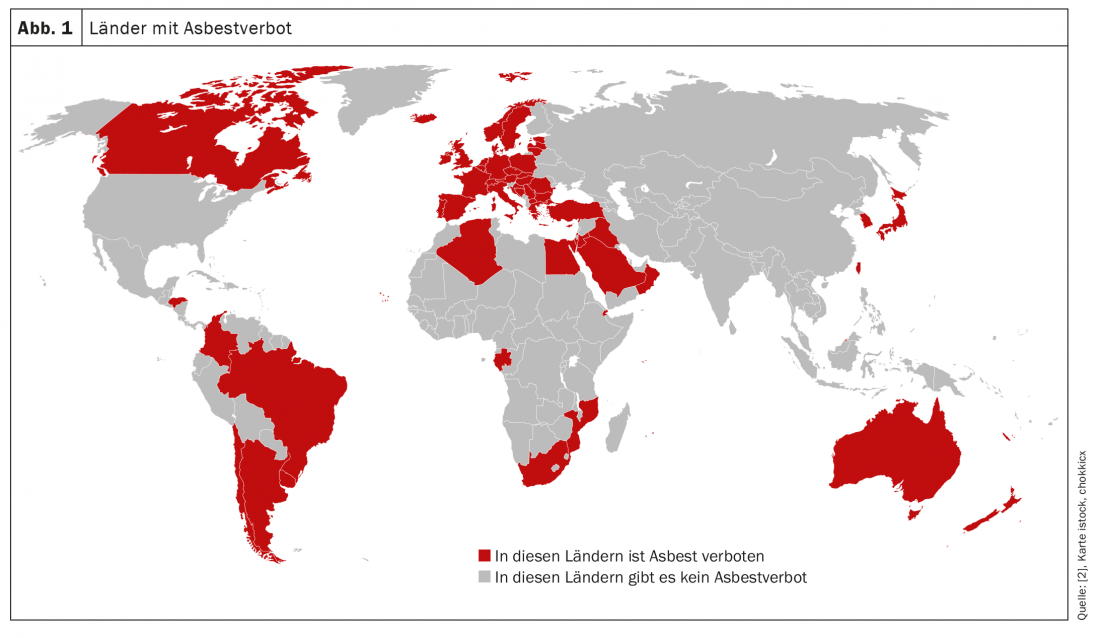
En el 70-90% de los afectados, el mesotelioma pleural maligno se atribuye a una exposición previa al amianto [1]. El amianto entra en los pulmones en forma de polvo; las fibras mortales se producen al procesar el material. Una vez inhaladas, las fibras de amianto se depositan en las vías respiratorias y, debido a su tamaño crítico, no pueden descomponerse ni excretarse. La forma de aguja de las fibras les permite migrar a la pleura e incluso atravesar el espacio pleural. El resultado: fibrosis y, a más largo plazo, cáncer, siendo las neoplasias de pulmón, laringe y pleura las secuelas neoplásicas más frecuentes relacionadas con el amianto [5]. Cuanto mayor sea la dosis acumulada, mayor será el riesgo de enfermedad [6]. Pero no todo el amianto es igual. Por ejemplo, el amianto blanco más utilizado (crisotilo) se considera menos nocivo que otros tipos de amianto como el amianto azul (crocidolita). En términos generales, el material de construcción que aún se utiliza en gran parte del mundo -hasta ahora el amianto sólo se ha prohibido en 67 países (Fig. 1) [2]- es un grupo de minerales cristalinos inorgánicos de origen natural, los llamados silicatos. Con una excelente resistencia al calor y las mejores propiedades aislantes [5].
El mesotelioma pleural maligno tras la exposición profesional al amianto se considera una enfermedad profesional y, por tanto, está cubierto por el seguro obligatorio de accidentes en Suiza. Sin embargo, como la exposición a menudo se remonta a varias décadas atrás, no siempre es fácil asumirla. Los que han tenido un contacto no profesional con el material tienen menos seguridad financiera. Mientras tanto, cada vez hay más servicios de apoyo para los afectados, como la Fundación del Fondo de Compensación para las Víctimas del Amianto (EFA) [7].
El papel de los genes
Además de la exposición al amianto, en los últimos años también se han identificado diversas alteraciones genéticas como factores de riesgo para el desarrollo de mesoteliomas pleurales malignos, sobre todo mutaciones de BAP1 (proteína 1 asociada a BRCA-1), tanto a nivel proteico como de ADN. Suelen observarse en familias con una incidencia superior a la media, en pacientes jóvenes y en presencia de segundos tumores [6,8]. En general, las mutaciones de BAP1 están presentes en aproximadamente dos tercios de los mesoteliomas esporádicos [9]. Algunas regiones de Turquía, muy contaminadas por la fibra de amianto natural erionita, parecen estar especialmente afectadas. Debido a esta incidencia, así como a las mutaciones hereditarias del BAP1, hasta el 50% de las personas mueren de mesotelioma en algunas zonas [9]. Las mutaciones inactivadoras de genes supresores de tumores como CDKN2A, LATS-1 o NF2 también pueden promover el mesotelioma pleural maligno [9].
Presentación clínica y diagnóstico
Debido a los síntomas inespecíficos y en su mayoría tardíos, a menudo la enfermedad sólo se descubre en fases avanzadas. Además de la disnea, la tos y el dolor torácico, lo más frecuente es la pérdida de peso. Los derrames pleurales recurrentes se producen en aproximadamente un tercio de los pacientes. Posteriormente, la hemoptisis, la disfagia, la ronquera y el síndrome de Horners tampoco son infrecuentes [10]. Especialmente en los casos de derrames pleurales unilaterales o engrosamiento pleural, la enfermedad del mesotelioma debe considerarse [11].
Lo primero y más importante en el diagnóstico es la cuestión de una posible exposición al amianto en el pasado. Los antecedentes familiares también desempeñan un papel importante. Si la exposición al amianto sigue siendo inexplicable, las fibras de amianto pueden detectarse mediante microscopía electrónica. Sin embargo, esto no confirma el diagnóstico de mesotelioma pleural, sólo la exposición. El requisito previo es un lavado broncoalveolar o una biopsia pulmonar para obtener material [4]. La derivación a un centro especializado debe realizarse lo antes posible en caso de sospecha de mesotelioma.
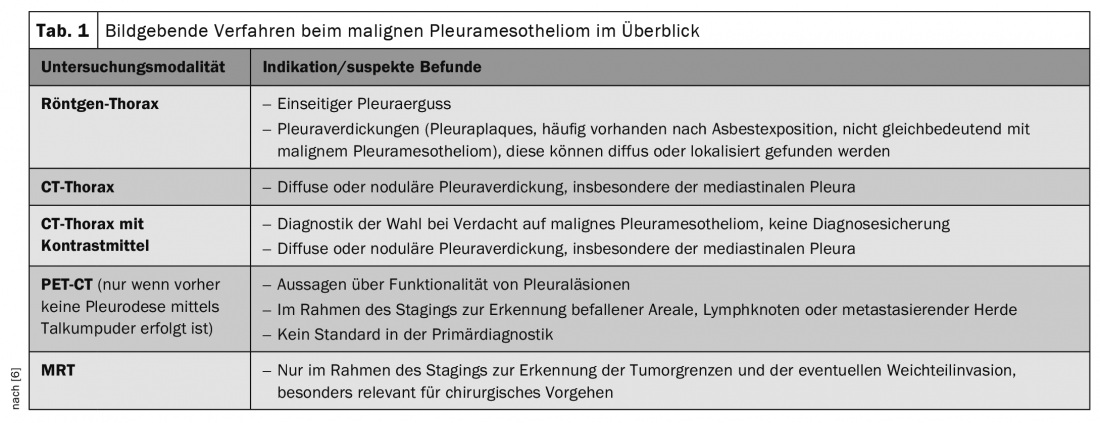
Además de los procedimientos de diagnóstico por imagen, el procesamiento histopatológico de las biopsias y del derrame pleural reviste especial importancia. Los marcadores tumorales no desempeñan actualmente ningún papel en el diagnóstico y tampoco en la evaluación de la progresión [6]. El diagnóstico por imagen mediante radiografía de tórax, ecografía y/o TC puede confirmar la sospecha diagnóstica y determinar el lugar óptimo para la biopsia. Sin embargo, el diagnóstico final sólo puede confirmarse mediante un examen histopatológico de los tejidos. Se recomienda realizar una TC torácica con medio de contraste como diagnóstico por imagen inicial de elección, donde el mesotelioma pleural maligno se presenta característicamente como un engrosamiento pleural difuso o nodular (tab. 1). En el curso de la estadificación, también se utilizan el PET-TAC y posiblemente la IRM. En cualquier caso, la estadificación debe incluir también una ecografía endobraquial y una mediastinoscopia para determinar el estado de los ganglios linfáticos antes de iniciar la terapia. También se utilizan la VATS contralateral (toracoscopias asistidas por vídeo) y las laparoscopias [6]. La estadificación se realiza según la clasificación internacional TNM.
Para confirmar el diagnóstico, se toman biopsias de zonas pleurales morfológicamente conspicuas e inconspicuas, ya sea mediante VATS, biopsia con aguja guiada por ecografía o biopsia pleural abierta [6]. El examen puramente citológico del derrame pleural no puede sustituir a la biopsia debido a la falta de sensibilidad [4]. Los análisis inmunohistoquímicos y de genética molecular se llevan a cabo como parte del estudio histopatológico. Éstas sirven, por un lado, para demostrar el origen mesotelial y, por otro, para distinguirlo de otros cambios malignos. Además, los subtipos histológicos están asociados a diferentes proteínas de superficie [8]. En general, los subtipos epitelioide, bifásico y sarcomatoide se distinguen en función de los patrones de crecimiento histomorfológico, resultando los mesoteliomas pleurales epitelioides más favorables desde el punto de vista pronóstico que los sarcomatoides [12].
Terapia: el camino hacia la modernidad
Hasta el momento, no existen normas uniformes para el tratamiento del mesotelioma pleural maligno. Sin embargo, una cosa está clara: la monoterapia no parece ser suficiente [13]. El objetivo del tratamiento es -si es posible- una resección macroscópicamente completa en un concepto de tratamiento multimodal. En este contexto, la quimioterapia adyuvante o neoadyuvante con platino más pemetrexed ha sido el pilar del tratamiento hasta la fecha. La gemcitabina demostró una eficacia similar con una tolerabilidad significativamente peor [13]. La adición de bevacizumab es una posibilidad, pero no está aprobada en Suiza [14]. En la actualidad, no se recomienda ninguna terapia de mantenimiento y faltan opciones bien probadas para la terapia de segunda línea [6]. En principio, los pacientes deberían ser tratados preferentemente en centros especializados y tener acceso a ensayos clínicos [6].
Además de la cirugía y la quimioterapia, también se utilizan procedimientos radioterapéuticos. Se utilizan, por ejemplo, para aliviar el dolor y podrían influir en el riesgo de recidiva, algo que se está investigando en estudios [6]. La irradiación radical de todo el tumor no suele recomendarse fuera de los estudios debido a la extensión tumoral, en la mayoría de los casos compleja, y a la exposición a la dosis resultante. Los lugares de la biopsia no deben irradiarse profilácticamente para evitar la siembra de células tumorales, en contra de lo que se suponía anteriormente [6].
La terapia quirúrgica radical suele reservarse para aquellos pacientes sin histología sarcomatoide. Otros requisitos previos son un estado de los ganglios linfáticos N<2 y un estadio UICC <IV. Esto significa que no debe haber metástasis [6]. El objetivo no es operar sin tumor residual, sino lograr una resección macroscópicamente completa. Dependiendo de la situación, pueden considerarse procedimientos la neumonectomía extrapleural (PPE), la pleurectomía y decorticación para preservar el pulmón (P/D) y la pleurectomía parcial [8]. La conclusión es que el beneficio de estas operaciones sigue sin estar claro, y el ensayo MARS2 está investigando actualmente el beneficio de la pleurectomía preservadora del pulmón y la decorticación en comparación con un procedimiento sin cirugía. Las intervenciones quirúrgicas también son importantes en el marco de un concepto de tratamiento paliativo. Por ejemplo, puede realizarse una pleurodesis con polvos de talco para los derrames pleurales recurrentes [15].
En el campo de la terapia sistémica, recientemente se ha logrado un gran avance tras una larga tregua. Por ejemplo, el estudio CheckMate-743 demostró una ventaja del tratamiento de primera línea con los dos inhibidores de los puntos de control, nivolumab e ipilimumab, en la situación paliativa [16,17]. La inmunoterapia dual ya ha sido aprobada debido a los resultados convincentes en histología no epitelioide, así como en histología epitelioide y expresión de PD-L1 ≥1% [14]. En el ensayo, dio lugar a una mediana de supervivencia global (SG) de 18,1 meses, en comparación con 14,1 meses en el grupo de quimioterapia (cociente de riesgos 0,74; p=0,002) [17]. Este primer éxito significativo en el campo de las terapias oncológicas modernas plantea otros interrogantes. Entre otras cosas, se está debatiendo la combinación de quimioterapia e inmunoterapia, así como posibles nuevas opciones en segunda línea. Y no son sólo otras nuevas sustancias activas las que pronto podrían abrirse camino en el tratamiento del mesotelioma pleural maligno, sino también vías alternativas de aplicación. Dado que la elevada tasa de recidivas locales es un problema relevante, cada vez se presta más atención a las opciones terapéuticas localizadas, como la terapia intracavitaria. Por ejemplo, actualmente se está llevando a cabo en el Hospital Universitario de Zúrich el ensayo de fase II INFLuenCe-Meso, que pone a prueba la seguridad y eficacia de la quimioterapia intracavitaria tras la resección quirúrgica [13].
Literatura:
- Beeler P, et al: Fuentes de datos sobre la incidencia del mesotelioma pleural maligno en Suiza desde 2001. Revista ASU de Prevención Médica. 2021; 09.
- Unia: 30 años de prohibición del amianto. www.unia.ch/de/arbeitswelt/von-a-z/asbest/30-jahre-asbestverbot (última consulta: 30.09.2021).
- Krebsliga Schweiz: El cáncer en Suiza: cifras importantes. Estado Diciembre de 2020. www.krebsliga.ch/fileadmin/downloads/sheets/zahlen-krebs-in-der-schweiz.pdf (última consulta: 30.09.2021).
- Scherpereel A, et al: Directrices de la Sociedad Respiratoria Europea y la Sociedad Europea de Cirujanos Torácicos para el tratamiento del mesotelioma pleural maligno. Eur Respir J. 2010; 35(3): 479-495.
- Duelo T: Guía oncológica – Mesotelioma pleural | Causas, diagnóstico y tratamiento.www.oncology-guide.com/erkrankung/pleuramesotheliom (última consulta: 30.09.2021).
- Scherpereel A, et al: Directrices ERS/ESTS/EACTS/ESTRO para el tratamiento del mesotelioma pleural maligno. Eur Respir J. 2020; 55(6).
- Fundación EPT. www.stiftung-efa.ch (última consulta: 30.09.2021).
- Baas P, et al: Mesotelioma pleural maligno: Guía de práctica clínica de la ESMO para el diagnóstico, tratamiento y seguimiento. Ann Oncol. 2015; 26 Suppl 5: v31-9.
- Duell T: Terapia sistémica del mesotelioma pleural. Terapia farmacológica. 2017; 35(06).
- Mesotelioma pleural maligno – síntomas, tratamiento y búsqueda de médicos: Deutscher Verlag für Gesundheitsinformation, Heidelberg, Alemania; www.leading-medicine-guide.ch/erkrankungen/tumoren/mesotheliom#topics (última consulta: 30.09.2021).
- Gill RR: Imagen del mesotelioma. Resultados recientes Cancer Res. 2011; 189: 27-43.
- Husain AN, et al: Directrices para el diagnóstico patológico del mesotelioma maligno: actualización de 2012 de la declaración de consenso del Grupo Internacional de Interés en Mesotelioma. Arch Pathol Lab Med. 2013; 137(5): 647-667.
- Terapia del mesotelioma pleural maligno. www.usz.ch/fachbereich/thoraxchirurgie/angebot/malignes-pleuramesotheliom (última consulta: 30.09.2021).
- Información sobre medicamentos de Swissmedic. www.swissmedicinfo.ch (última consulta: 30.09.2021).
- Bielsa S, et al: El tipo de tumor influye en la eficacia de la pleurodesis en los derrames malignos. Pulmón. 2011; 189(2): 151-155.
- Nowak AK, Jackson A, Sidhu C: Tratamiento del mesotelioma pleural avanzado: en la encrucijada. JCO Oncol Pract. 2021: Op2100426.
- Baas P, et al: Nivolumab en primera línea más ipilimumab en el mesotelioma pleural maligno irresecable (CheckMate 743): un ensayo multicéntrico, aleatorizado, abierto, de fase 3. Lancet. 2021; 397(10272): 375-386.
InFo ONCOLOGÍA Y HEMATOLOGÍA 2021; 9(5): 32-33