El hierro es esencial para diversas funciones bioquímicas y fisiológicas. La carencia de hierro está muy extendida y es una de las principales causas de anemia. Como profilaxis, es importante un aporte adecuado de ferritina a través de la dieta. En presencia de una carencia de hierro, puede recurrirse a la sustitución oral o intravenosa, cuya eficacia y tolerabilidad varían de un individuo a otro.
El hierro es uno de los cuatro elementos más comunes de la corteza terrestre. Es un oligoelemento importante para todos los seres vivos, incluido el ser humano. Debe su papel esencial en la biología a su capacidad para transportar y unir electrones de forma reversible. En la hemoglobina, por ejemplo, es responsable de garantizar que el oxígeno, altamente electronegativo, pueda ser transportado eficazmente. Por la misma razón, el hierro es un componente central de numerosos sistemas enzimáticos que se encargan de muchas funciones bioquímicas y fisiológicas.
Más de 1.200 millones de personas en todo el mundo sufren carencia de hierro [1]. Ésta es una de las principales causas de anemia [2]. En Europa, las recopilaciones de datos entre las mujeres en edad fértil muestran una prevalencia de carencia de hierro del 10-32%, con una prevalencia estimada de anemia del 2-5%. Se calcula que el porcentaje de mujeres con reservas bajas de hierro es del 40-55% [3]. Las prevalencias de la carencia de hierro en niños pequeños se registraron localmente y mostraron valores del 4-48%. Así pues, los niños pequeños representan otro grupo de riesgo para la carencia de hierro [4].
¿Por qué uno de los elementos más extendidos es al mismo tiempo responsable de una carencia mundial de peso? La razón reside en la capacidad del hierro para promover la formación de radicales reactivos tóxicos. Además, el hierro es prácticamente insoluble en forma libre a pH fisiológico (es decir, en todas partes del cuerpo excepto en el ácido gástrico). La absorción del hierro es, por tanto, naturalmente limitada. Para que sea utilizado, debe ser captado en forma ligada: asociado a proteínas que puedan ligarlo de forma fuerte pero reversible.
Metabolismo y absorción del hierro
Hasta la fecha, no se conoce ningún mecanismo de excreción activa del hierro; la excreción renal es irrelevante para el equilibrio del hierro. Por lo tanto, el equilibrio del hierro humano debe regularse activamente durante la absorción a partir de los alimentos en el intestino delgado, donde los enterocitos desempeñan un papel clave.
El hierro en los alimentos existe en dos formas principales: Hierro hemo (en productos animales) y hierro no hemo (en productos animales y no animales). Se absorbe principalmente en el intestino delgado, donde el pH del contenido intestinal aumenta sucesivamente a lo largo de un gradiente hasta casi la neutralidad. El hierro no hemo procedente de los alimentos se vuelve más insoluble a lo largo de este gradiente, lo que probablemente explica por qué la absorción en el intestino distal desempeña un papel subordinado. La solubilidad del hierro en el intestino delgado es un factor importante en la absorción del hierro de los alimentos y puede verse influida significativamente por la composición de una comida.
A nivel celular, el hierro hemo y el hierro no hemo son captados por diferentes transportadores. Ambos contribuyen a la concentración de hierro en los enterocitos, que es crucial para la regulación del hierro celular. Influye directamente en la conformación de las proteínas de respuesta al hierro (IRP), que controlan la síntesis de las proteínas de transporte celular. Así, el hierro interviene directamente en la síntesis de los mecanismos de transporte que lo importan o exportan en la célula. Esto es especialmente importante para el control del equilibrio sistémico del hierro en los enterocitos, macrófagos y hepatocitos.
Un segundo componente regulador de acción sistémica es la hormona hepcidina, que se sintetiza en el hígado. La hepcidina está regulada por diferentes señales: El aumento de la eritropoyesis o la hipoxia conducen a concentraciones bajas, mientras que los estímulos inflamatorios/infecciosos (interleucina-6) y el propio estado del hierro en el organismo (saturación de la transferrina) aumentan la síntesis. La hepcidina se une al único exportador celular de hierro conocido, la ferroportina, provocando su degradación. Así, el hierro permanece en las células y ya no puede entrar en el torrente sanguíneo, lo que a su vez afecta a los IRP y a su cascada de reacciones. Dado que este proceso está regulado sistémicamente, afecta a todos los tipos de células. Un equilibrio de hierro equilibrado es, por tanto, el resultado de los procesos de todos los equilibrios de hierro celulares individuales y su orquestación sistémica por la hepcidina [5]. El descubrimiento de esta hormona en la década de 2000 ha ampliado enormemente la comprensión de la regulación del hierro: la elevación crónica de la hepcidina conduce a una anemia marcada que no puede corregirse, o sólo parcialmente, mediante la ingesta oral de hierro; por ejemplo, la anemia causada por enfermedades inflamatorias o infecciosas crónicas.
Recuperación de hierro mediante reciclaje
El contenido de hierro en los adultos es ≈4 g y se encuentra principalmente en los glóbulos rojos (≈2,8 g). El 90% de las necesidades diarias se cubre mediante la recuperación de los glóbulos rojos viejos. Este ciclo de reciclaje tiene lugar entre la médula ósea, los glóbulos rojos y los macrófagos. En la médula ósea se producen los eritrocitos (≈300 mg), los macrófagos recogen los eritrocitos viejos, los descomponen y liberan el hierro de nuevo en el torrente sanguíneo, donde puede ser utilizado de nuevo por la médula ósea (≈600 mg). Las reservas de hierro varían de forma individual y se encuentran principalmente en el hígado. El hierro que debe transportarse en el torrente sanguíneo está unido a la transferrina, que constituye una proporción dinámica pero pequeña (3-4 mg) del contenido total de hierro. Esta fracción es responsable del transporte entre las células y los tejidos, por lo que tiene una gran importancia funcional.
Debe ingerirse a través de los alimentos un 10-20% de las necesidades diarias de hierro (1-2 mg) para compensar las pérdidas diarias naturales de hierro (por ejemplo, por pequeñas hemorragias, a través de las mucosas, etc.). Dado que la cantidad que debe absorberse al día es muy pequeña en comparación con el contenido del organismo, la carencia de hierro sólo puede ser el resultado de un déficit de hierro a largo plazo. Las mujeres jóvenes, las embarazadas o los niños son los más afectados, ya que la pérdida de sangre durante la menstruación y el crecimiento provocan un aumento de las necesidades de hierro.
La anemia aumenta el riesgo de complicaciones en el embarazo y puede provocar un parto prematuro. La carencia de hierro puede ser crónica y asintomática. Sintomáticamente, se manifiesta en fatiga, falta de concentración, irritabilidad, tolerancia reducida al frío, dificultad para respirar durante la actividad física, síndrome de pica y síndrome de piernas inquietas. Otros síntomas incluyen palidez cutánea y conjuntival, estomatitis y coiloniquia.
Biomarcador de la carencia de hierro
Las medidas bioquímicas del estado del hierro reflejan el tamaño relativo de los diferentes compartimentos y, al mismo tiempo, informan sobre el estado general del hierro en el organismo. El patrón oro es la medición del contenido de hierro en la médula ósea. Si es demasiado bajo, se recicla muy poco hierro en la circulación del organismo. Este déficit no puede ser compensado por la dieta o las reservas hepáticas, lo que provoca una reducción de la eritropoyesis y anemia.
Un signo de anemia ferropénica es también el aumento de la hemoglobina tras la administración de hierro en pacientes anémicos.
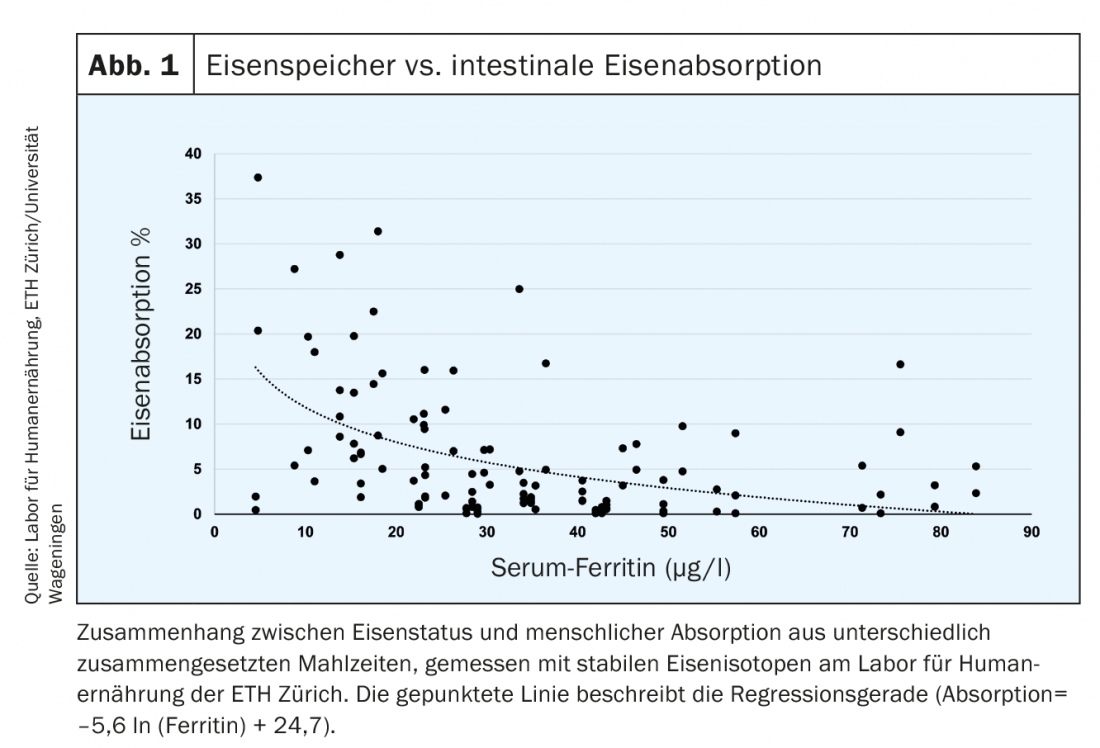
Además, la absorción de hierro medida con isótopos de hierro radiactivos o estables está aumentada en pacientes con deficiencia de hierro (Fig. 1) [6]. En las personas sanas, los límites de ferritina sérica (FS) están linealmente relacionados con las reservas de hierro. 1 µg/l de SF corresponde a unos 120 µg de reservas de hierro/kg de peso corporal o a unos 8-10 mg de reservas de hierro [7]. El valor límite definido de 15 µg/l indica la ausencia de hierro detectable en la médula ósea y refleja almacenes vacíos. Por lo tanto, una nueva reducción del valor por debajo de 15 µg/l carece de importancia cuantitativa. Bioquímicamente, el SF es la molécula de almacenamiento intracelular del hierro y refleja la acumulación de ferritina intracelular en macrófagos y hepatocitos. En pacientes sanos, el SF refleja así las reservas de hierro en el hígado. Con una eritropoyesis defectuosa (talasemia), se produce una acumulación de hierro intercelular en los macrófagos, lo que también provoca un aumento de la ferritina. Durante una infección o una inflamación, el nivel de hepcidina aumenta. El hierro celular sólo se exporta de forma reducida y debe almacenarse celularmente (en moléculas de ferritina). Esto puede dar lugar a un “falso” aumento de la ferritina, que en este caso no indica un aumento de las reservas de hierro.
Por ello, en pacientes con enfermedades infecciosas o inflamatorias debe determinarse otro marcador: el receptor soluble de transferrina en el suero (sTfR), que es proporcional a la necesidad de hierro de las células. En la práctica, este valor refleja el “hambre” de hierro de las células de la médula ósea. El cociente de SF y sTfR ha demostrado ser muy predictivo [8]. Desgraciadamente, el muy útil marcador sTfR no está bien estandarizado; distintos métodos definen diferentes umbrales para la carencia de hierro.
La saturación de transferrina es otro marcador útil que representa la disponibilidad actual de hierro sistémico y que disminuye durante la deficiencia. Este marcador puede dar indicios de una carencia funcional de hierro, especialmente en relación con un aumento de la SF debido a una infección o inflamación. Lynch et al. ofrecen una visión general de los biomarcadores establecidos y experimentales para el hierro. [8].
Prevención mediante una dieta adecuada
La biodisponibilidad de hierro de la dieta viene definida tanto por su contenido en hierro como por su composición [9]. Los niveles de hierro de medios a altos se encuentran en las legumbres, la carne, los huevos, los productos integrales, los alimentos enriquecidos, los frutos secos y las semillas. El hierro hemo se absorbe en mayor cantidad (intacto) (20-50%). La absorción es menos susceptible a los inhibidores y promotores de la absorción del hierro y está menos influida por el estado personal de hierro. El hierro no hemo, por su parte, es más sensible a la composición de la dieta y al estado del hierro, lo que da lugar a una gran variabilidad en la absorción del hierro (2-50%). A pesar de la pequeña cantidad de hierro hemo que se consume en la dieta, representa un alto porcentaje de la ingesta dietética de hierro porque es más biodisponible.
Varios componentes definen la absorción del hierro en el intestino delgado, en la que también influye la solubilidad: La carne muscular o el ácido ascórbico (vitamina C) tienen un efecto promotor. Sin embargo, los cereales y los productos integrales, que en realidad son ricos en hierro, contienen ácido fítico, que reduce el porcentaje de absorción. Los polifenoles y los taninos del té y el café tienen un efecto similar. El ácido ascórbico de las frutas y verduras contrarresta la inhibición. Se recomiendan especialmente las combinaciones de alimentos ricos en hierro y vitamina C (resumen 1). Una dieta variada con mucho ácido ascórbico, carne de músculo o pescado muestra una absorción del 15-17% [10].

Suplementos orales e intravenosos
Aunque la optimización de la dieta puede ser eficaz para la prevención primaria de la carencia de hierro, se recomienda la administración de suplementos en casos de carencia de hierro demostrada para corregir rápidamente la anemia, revertir la carencia de hierro en los tejidos y reponer las reservas de hierro.
Los suplementos de hierro son eficaces, pero también pueden causar efectos secundarios dependientes de la dosis. En un estudio realizado en pacientes ancianos, se administraron 15, 50 o 150 mg de Fe durante tres meses. Aunque la eficacia fue similar al final del estudio, los grupos que recibieron 50 y 150 mg de Fe mostraron más efectos secundarios [11].
El hierro aumenta la concentración de hepcidina durante varias horas. A dosis de ≥60 mg de Fe, la hepcidina aumenta de forma dependiente de la dosis tras la administración de un suplemento de hierro y permanece elevada hasta 24 horas. Este aumento se asocia a una reducción de la absorción de alrededor del 35%. Por esta razón, los suplementos de hierro pueden administrarse en días alternos para aumentar la eficacia de absorción manteniendo la misma dosis [12]. Además, se ha demostrado que dividir la dosis en el mismo día (por ejemplo, 2× 60 mg Fe en lugar de 1× 120 mg Fe) no tiene ningún valor añadido en términos de aumento de la absorción [13].
Es probable que las dosis <60 mg Fe tengan un efecto menor sobre la hepcidina. Además, dosis más pequeñas no sólo pueden prevenir eficazmente la carencia de hierro, sino que también tienen menos efectos secundarios [14].
Debe tenerse en cuenta que con la suplementación oral en dosis más pequeñas, el porcentaje de absorción aumenta, pero la cantidad total de hierro absorbido disminuye. Por lo tanto, a la hora de recomendar la administración alterna de hierro, también debe tenerse en cuenta su estado. Los posibles efectos secundarios deben sopesarse frente al efecto que se quiere conseguir.
El hierro intravenoso se recomienda como tratamiento de primera línea para la ferropenia sintomática grave con anemia [1]. Generalmente se tolera bien y rara vez tiene efectos secundarios. Se evita cualquier efecto negativo sobre el ecosistema intestinal, por ejemplo en pacientes con estrés previo. En Suiza, sin embargo, el uso más frecuente de terapias intravenosas también suscitó críticas, principalmente por los costes más elevados [15]. La Oficina Federal de Salud Pública ha iniciado ahora una “Evaluación de Tecnologías Sanitarias”.
La terapia para la ferropenia y la anemia ferropénica debe ser personalizada. La elección de la terapia “adecuada” debe tener en cuenta las posibles causas, el grado de deficiencia de hierro, las comorbilidades, la duración de la deficiencia y las preferencias del paciente. Además de las razones clínicas/fisiológicas, la nutrición y el estilo de vida (deporte, anticonceptivos) desempeñan un papel importante en la prevención de las deficiencias y en el mantenimiento de un estado saludable del hierro tras la terapia en pacientes por lo demás sanos.
Mensajes para llevarse a casa
- Para prevenir la carencia de hierro, debe recomendarse una dieta variada rica en hierro y con una elevada biodisponibilidad de hierro.
- Con la suplementación oral, las dosis bajas (entre 30 y 60 mg de Fe/día) se absorben mejor en términos porcentuales y es probable que causen menos efectos secundarios.
- La terapia de suplementación con hierro debe individualizarse al máximo. Debe recomendarse una terapia oral en días alternos (por ejemplo, si la carencia de hierro no es grave: 60 mg/día, en días alternos).
Literatura:
- Camaschella C: Deficiencia de hierro. Sangre 2019; 133(1): 30-39.
- Zimmermann MB, Hurrell RF: Deficiencia nutricional de hierro. Lancet 2007; 370(9586): 511-520.
- Milman N, et al: Estado del hierro en mujeres embarazadas y en edad reproductiva en Europa. Am J Clin Nutr 2017; 106(Suppl 6): 1655S-1662S.
- Van der Merwe LF, Eussen SR: Estado del hierro de los niños pequeños en Europa. Am J Clin Nutr 2017; 106(Suppl 6): 1663S-1671S.
- Hentze MW, et al.: Dos para bailar tango: regulación del metabolismo del hierro en mamíferos. Cell 2010; 142(1): 24-38.
- Daru J, et al: La ferritina sérica como indicador del estado del hierro: ¿qué necesitamos saber? Am J Clin Nutr 2017; 106(Suppl 6): 1634S-1639S.
- Cook JD: Diagnóstico y tratamiento de la anemia ferropénica. Best Pract Res Clin Haematol 2005; 18(2): 319-332.
- Lynch S, et al: Biomarcadores de la nutrición para el desarrollo (BOND)-Revisión del hierro. J Nutr 2018; 148(Suppl 1): 1001S-1067S.
- Hurrell R, Egli I: Biodisponibilidad del hierro y valores de referencia dietéticos. Am J Clin Nutr 2010; 91(5): 1461s-1467s.
- OMS/FAO: Necesidades de vitaminas y minerales en la nutrición humana: informe de una consulta conjunta de expertos FAO/OMS. Ginebra: OMS/FAO 2004.
- Rimon E, et al.: ¿Estamos dando demasiado hierro? La terapia con dosis bajas de hierro es eficaz en octogenarios. American J Med 2005; 118(10): 1142-1147.
- Moretti D, et al.: Los suplementos orales de hierro aumentan la hepcidina y disminuyen la absorción de hierro a partir de dosis diarias o dos veces al día en mujeres jóvenes con falta de hierro. Sangre 2015; 126(17): 1981-1989.
- Stoffel NU, et al: Absorción de hierro a partir de suplementos orales de hierro administrados en días consecutivos frente a alternos y como dosis única matinal frente a dosis divididas dos veces al día en mujeres con carencia de hierro: dos ensayos controlados aleatorios abiertos. Lancet Haematol 2017; 4(11): e524-e533.
- Bialkowski W, et al: Las estimaciones del hierro corporal total indican que 19 mg y 38 mg de hierro oral son equivalentes para la mitigación de la deficiencia de hierro en individuos sometidos a flebotomía repetida. Am J Hematol 2017; 92(9): 851-857.
- Giger M, Achermann R: [Sustitución con hierro en pacientes ambulatorios en Suiza: aumento de los costes asociados a la administración intravenosa]. Z Evid Fortibld Qual Gesundhwes 2013; 107(4-5): 320-326.
PRÁCTICA GP 2019; 14(2): 15-18
CARDIOVASC 2020; 19(3): 6-9