La etiología del SII es multifactorial. La modificación del estilo de vida es un componente importante de la terapia básica. La elección del método terapéutico debe hacerse junto con el paciente. Debe ofrecerse psicoterapia para los cursos graves y las comorbilidades psicológicas.
El síndrome del intestino irritable es sintomático de muchas maneras, siendo el dolor abdominal, la irregularidad de las heces y la flatulencia los principales síntomas [1,2]. Los síntomas provocan una restricción subjetivamente muy sentida de la calidad de vida y de la vida cotidiana de los afectados, sin que se expliquen suficientemente los correlatos somáticos (bioquímicos y/o estructurales) [3].
Definiciones
A nivel nacional e internacional, se pueden aplicar diferentes definiciones al SII. A nivel mundial, los criterios más utilizados son los criterios de Roma IV (2017) [4]. En Alemania, la definición se ajusta a la directriz S3 (actualmente en revisión) [1]. Según esta directriz, son características las molestias relacionadas con el intestino, excluidas las enfermedades orgánicas, que existan desde hace al menos tres meses y reduzcan la calidad de vida del paciente [1]. El síndrome del intestino irritable postinfeccioso es una forma especial que probablemente esté causada por cambios en el microbioma, el eje intestino-cerebro y la respuesta inmunitaria [5]. Los criterios de Roma IV se dividen en cuatro subtipos (clasificación mediante la escala de forma de las heces de Bristol [BSFS]) [4,6]:
- SDR-D (diarrea)
- >25% de heces líquidas o con grumos blandos (tipo 6 y 7)
- RDS-C (estreñimiento)
- >25% de heces en glóbulos sólidos o en forma de salchicha, grumosas (tipo 1 y 2)
- RDS-M (mixto)
- >25% de sillas tipo 1 y 2; >25% tipo 6 y 7
- RDS-U (sin subtitular)
- No clasificable según el BSFS
Comorbilidades: Las enfermedades concomitantes desempeñan un papel importante en el contexto del SII. Un metaanálisis demostró que hasta el 94% de todos los pacientes con SII padecen comorbilidades psicológicas, que repercuten en el curso de la enfermedad y en la gravedad de los síntomas [7]. Los trastornos de ansiedad y la depresión son dos comorbilidades psicológicas que suelen asociarse al SII y, a su vez, también aumentan significativamente el riesgo de génesis del SII [8,9].
Aspectos epidemiológicos: Los estudios actuales muestran una prevalencia cada vez más elevada del SII (11,2% en todo el mundo). Cabe señalar que esta cifra supera las prevalencias totales de las enfermedades inflamatorias intestinales y la enfermedad celíaca [3,10]. La enfermedad afecta con más frecuencia a las mujeres que a los hombres (2:1) [11]. Dada la elevada prevalencia, también se puede adivinar la magnitud de los costes socioeconómicos ocasionados. Así, sólo los costes directos ascienden a una media de 572 EUR por paciente y año [12].
Fisiopatología
Los factores etiológicos que influyen en el SII aún no se han investigado ni comprendido del todo. Lo que es seguro, sin embargo, es la génesis multifactorial, por lo que el modelo biopsicosocial de la enfermedad ofrece el mejor enfoque explicativo [13]. Según esto, los factores somáticos, psicológicos y sociales se entrelazan y en combinación causan el síndrome del intestino irritable (Fig. 1).
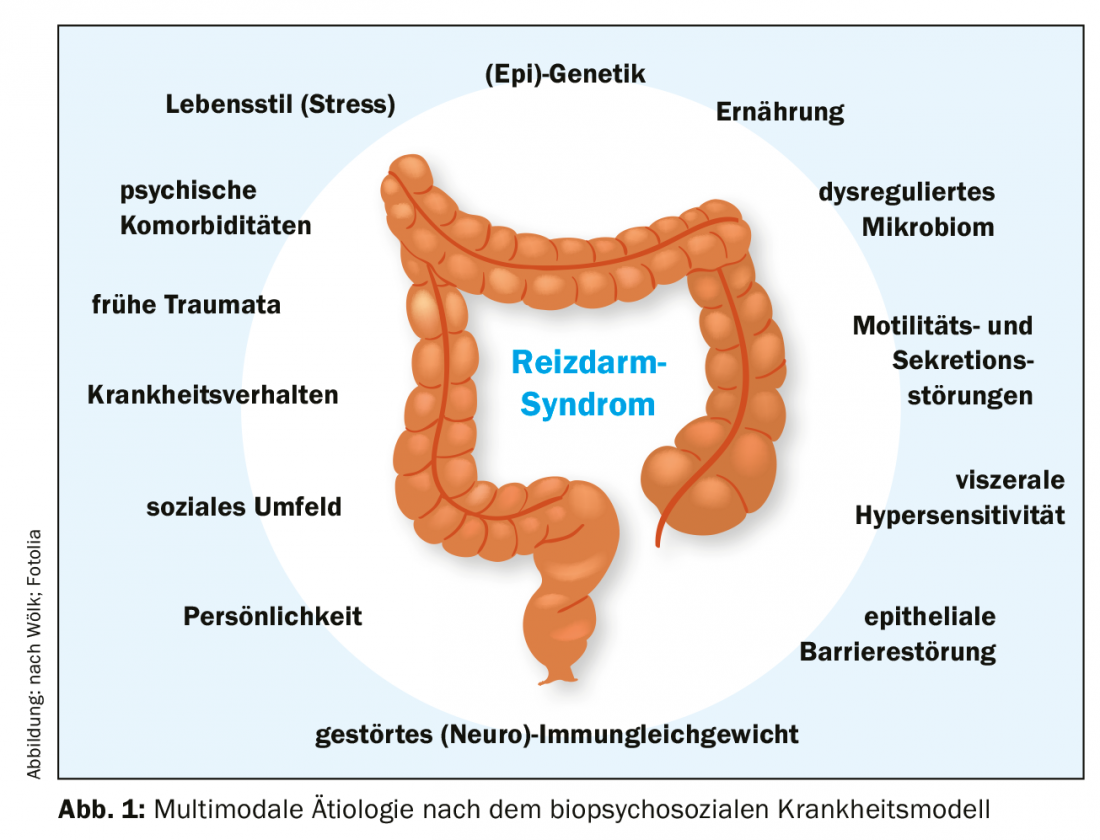
Aspectos biológicos: Los factores somáticos que influyen son actualmente un fuerte foco de investigación. El microbioma también debe mencionarse aquí como un posible punto de partida de importancia terapéutica [14,15]. Puede detectarse una composición alterada de la flora intestinal en los pacientes en comparación con los sujetos de control sanos [14], aunque los datos al respecto aún no son uniformes. El microbioma también parece influir en el eje intestino-cerebro disfuncional en el SII (eje microbioma-intestino-cerebro) y explicaría la forma postinfecciosa del SII, así como el mayor riesgo tras el uso de antibióticos [3,5,16].
Otros cambios biológicos incluyen el aumento de la sensibilidad visceral [17] y el aumento de la permeabilidad de la barrera epitelial gastrointestinal [18], a menudo asociados a alteraciones del equilibrio (neuro)inmunitario con aumento de las células endocrinas/paracrinas activas en la mucosa [19]. Por último, pero no menos importante, hay que mencionar los aspectos genéticos [3].
Además, la motilidad y la secreción del colon se ven alteradas, por lo que es necesario un enfoque terapéutico [20]. El eje intestino-cerebro desempeña un papel importante en estos cambios y muy probablemente también contribuye a la asociación con la enfermedad mental [21].
Aspecto psicosocial: Las comorbilidades psicológicas, por un lado, contribuyen al desarrollo del SII y, por otro, aumentan el riesgo de cursos graves y refractarios de la enfermedad [7]. A la inversa, el SII también es un factor de riesgo para los trastornos de ansiedad, la depresión y otros trastornos somatomorfos [8,9]. El eje hipotalámico-pituitario-adrenal (eje HPA) desempeña un papel importante en este contexto [22,23]. La estimulación crónica (por ejemplo, por estrés prolongado) desencadena cascadas de señalización inflamatoria en el tracto gastrointestinal, que pueden contribuir al mantenimiento y/o la exacerbación de los síntomas. La conducta de enfermedad aprendida, el estatus socioeconómico y las experiencias traumáticas en la primera infancia son otros aspectos importantes que pueden contribuir al desarrollo y la persistencia del SII [10,24,25].
Diagnóstico
Debido al gran número de manifestaciones sintomáticas, es de especial importancia disponer de un algoritmo de diagnóstico uniforme. La directriz S3 proporciona un esquema claro para ello, según el cual el diagnóstico de exclusión del SII debe asignarse tras un diagnóstico básico definido y la exclusión individual de los diagnósticos diferenciales relevantes (Fig. 2) [1]. Existen muchos diagnósticos diferenciales posibles, por lo que es necesario proceder según la constelación y el curso temporal de los síntomas [1].
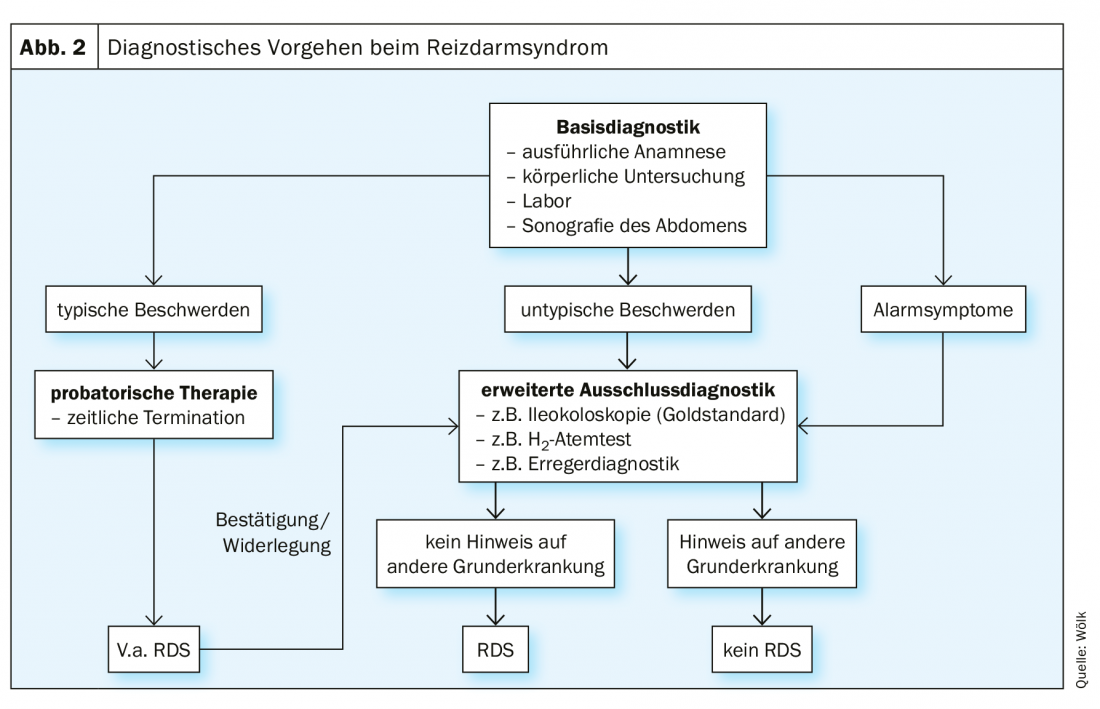
La primera etapa del diagnóstico básico es la anamnesis, en la que debe prestarse especial atención a los síntomas de alarma (por ejemplo, pérdida de peso, sangre en las heces, etc.) [1]. Éstas dan pistas sobre los correlatos de las dolencias a nivel somático, lo que requiere una aclaración adecuada [1]. A continuación se realiza un examen físico, la recogida de una analítica basal y una ecografía del abdomen [1]. Sin embargo, el diagnóstico definitivo sólo puede hacerse tras un diagnóstico de exclusión individual [1]. Esto incluye una ileocolonoscopia, especialmente en casos de diarrea [1]. Si se presentan los síntomas típicos, debe sospecharse el diagnóstico de síndrome del intestino irritable e iniciarse una terapia de prueba [1].
Terapia
La patogénesis multifactorial descrita anteriormente abre un amplio abanico de opciones terapéuticas, que incluyen medidas generales, farmacológicas y psicológicas. Sin embargo, esto también dificulta la formulación de recomendaciones terapéuticas generales. De especial importancia en el tratamiento del SII es la relación de confianza entre médico y paciente [1,26]. De este modo, puede obtenerse la mejor estrategia terapéutica en el sentido de la toma de decisiones compartida [27]. Una discusión psicoeducativa inicial constituye la base de este [26]. Los objetivos del tratamiento podrían definirse como el alivio de los síntomas y la mejora de la calidad de vida, ya que sólo el 10% de los pacientes logran liberarse por completo de los síntomas [28]. Las opciones de tratamiento se dividen a continuación en tres categorías.
Modificación del estilo de vida y de la dieta
Estilo de vida equilibrado: Deben realizarse ajustes individuales con respecto al estilo de vida. Los procedimientos relajantes y el ejercicio moderado regular (3-5 veces a la semana) para estimular la motilidad colónica mostraron un efecto positivo sobre la gravedad de los síntomas en un ensayo clínico aleatorizado (ECA) [29].
El yoga puede considerarse una técnica de relajación eficaz. Incorporar el yoga a la vida diaria es una opción que, según un metaanálisis reciente de seis ECA, mejora significativamente los síntomas, los niveles de ansiedad y la calidad de vida [30].
Además, debe garantizarse un sueño suficiente, ya que los trastornos del sueño también son un fenómeno acompañante frecuente en el síndrome del intestino irritable [31]. El consumo de nicotina no es un factor de riesgo basado en pruebas, pero debe reducirse al mínimo como parte de un estilo de vida saludable en general [31,32]. La influencia del estilo de vida en el eje HPA puede afectar a la gravedad del SII [22,23].
Medidas dietéticas: La dieta es uno de los principales factores asociados con la expresión subjetiva de los síntomas y la reducción de la calidad de vida, por ejemplo a través de la evitación y el miedo a alimentos específicos [33,34]. En caso de intolerancias alimentarias conocidas, especialmente malabsorción de hidratos de carbono, éstos deben reducirse en consecuencia en la dieta [35,36]. Puede considerarse la posibilidad de seguir una dieta reducida en gluten, ya que puede aliviar los síntomas, sobre todo en pacientes con niveles elevados de inmunoglobulina G (IgG), como muestra un metaanálisis [37,38]. Sin embargo, aún es necesario seguir investigando sobre el patomecanismo exacto. Debe tenerse en cuenta que los intentos de terapia deben reevaluarse al cabo de tres meses como máximo [1].
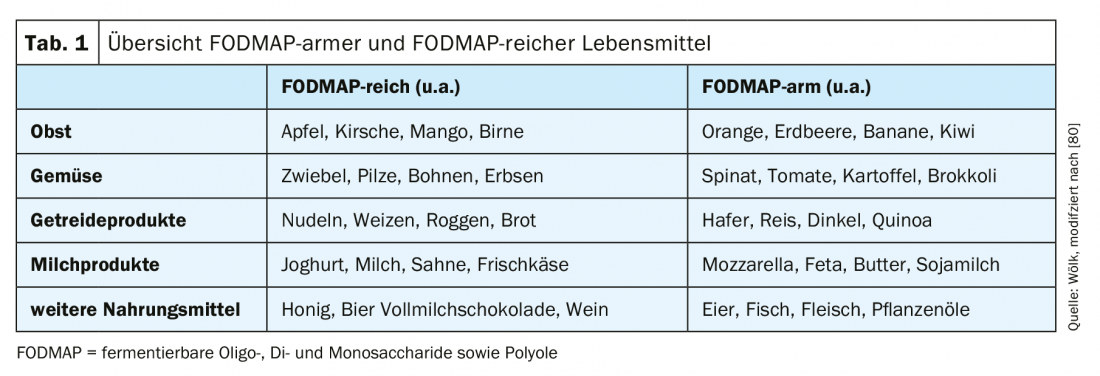
La llamada “dieta baja en FODMAP” (“oligo-, di- y monosacáridos fermentables, así como polioles”) es actualmente el centro de la terapia para el SII (Tab. 1) . Los FOPMAP son descompuestos y fermentados en el intestino por el microbioma. Como consecuencia, se producen gases y ácidos grasos libres, así como una mayor fijación de agua, lo que puede conducir a un agravamiento de los síntomas a través de un aumento de la secreción [3,39,40]. Sin embargo, especialmente con dietas muy estrictas y a largo plazo, existe el riesgo de que aparezcan síntomas de carencia [41]. Los metaanálisis muestran efectos positivos de la dieta baja en FODMAP, aunque a menudo se ha evaluado de forma aguda y los estudios a largo plazo están pendientes [42,43]. En un metaanálisis reciente con un total de doce estudios (seis ECA y seis estudios de cohortes), se demostró que una reducción de los FODMAP puede lograr una mejora de los síntomas, especialmente del dolor abdominal y la hinchazón [42]. Así pues, la dieta baja en FODMAP puede ser un componente terapéutico sensato en el tratamiento del SII, pero prestando atención al suministro de suficientes micronutrientes, vitaminas y oligoelementos.
Terapia pre, pro y antibiótica: Tal y como están las cosas, todavía hay escasas pruebas del beneficio terapéutico de una terapia dirigida al microbioma [44]. Los prebióticos se definen como componentes alimentarios no digeribles que estimulan el crecimiento de algunas cepas de bacterias. Los probióticos son bacterias vivas que influyen positivamente en el microbioma, y los antibióticos se dirigen al microbioma, reduciendo al máximo las especies productoras de gases [44].
Para un tratamiento eficaz de los síntomas en función del subtipo, es esencial conocer las combinaciones necesarias de cepas bacterianas y sustancias activas, que, sin embargo, siguen siendo actualmente objeto de investigación [44]. La metodología heterogénea de los distintos ensayos clínicos aleatorizados sobre diferentes cepas bacterianas (también en combinación, a menudo en concentraciones muy diferentes) dificulta actualmente una recomendación clara de tratamiento [44,45]. Sin embargo, las cepas Bifidobacterium (B.) infantis y B. animalis ssp. lactis contra la flatulencia, Lactobacillus casei Shirota también contra el estreñimiento (nivel de evidencia B en la directriz S3) [1]. El antibiótico rifaximina reduce las especies bacterianas formadoras de gas y puede utilizarse a modo de prueba en el contexto de las molestias por flatulencia [44,46].
Farmacoterapia orientada a los síntomas
Si las medidas generales no tienen suficiente éxito, debe llevarse a cabo una terapia farmacológica sintomática específica de las dolencias del paciente (tab. 2) [1]. Esto difiere en función del subtipo.
Dolor: La primera clase de sustancias para el dolor abdominal son los espasmolíticos como la butilescopolamina [1]. El efecto anticolinérgico del fármaco parasimpático inhibe el músculo liso y reduce los espasmos y el dolor [47].
Como alternativa o complemento, se pueden probar los fitoterapéuticos, especialmente el aceite de menta o el aceite de alcaravea, ambos demostraron lograr reducciones significativas del dolor en un gran metaanálisis de 2008 y también según los análisis actuales [1,48,49]. El aceite de menta en una composición especial liberado en el intestino delgado mostró buenos efectos en el síndrome del intestino irritable en un reciente ensayo clínico aleatorizado [50]. Si el dolor no se reduce lo suficiente, existe la opción de los antagonistas 5HT3 (por ejemplo, el ondansetrón), que tienen un efecto antiespasmódico e inhibidor de la motilidad por acción antiserotoninérgica.
Los antidepresivos (antidepresivos tricíclicos [TZA] para el subtipo SII-D e inhibidores selectivos de la recaptación de serotonina [SSRI] para el SII-O) administrados en dosis bajas también muestran buenos efectos [1,3,51,52]. En dosis más altas, los antidepresivos también son eficaces contra las comorbilidades mentales y se utilizan en consecuencia [52].
Diarrea: Las irregularidades de las heces en el sentido de una mayor frecuencia y consistencia líquida pueden tratarse con medicación prolongando el paso colónico e inhibiendo la secreción [3]. Las clases de sustancias adecuadas son, por tanto, los agonistas de los receptores opioides, como el agonista de los receptores μ-opioides loperamida (que no se mueve por la barrera hematoencefálica) [1]. Según las investigaciones actuales, la eluxadolina puede ser más beneficiosa como agonista de los receptores μ- y κ-opioides, así como antagonista de los receptores δ-opioides, porque además actúa sobre el dolor [53]. Sin embargo, la terapia con eluxadolina es muy costosa [54].
Además, los inhibidores de la resorción de ácidos biliares (por ejemplo, la colestiramina) son una opción terapéutica [1]. Se ha demostrado que el subtipo SDR-D puede asociarse a una mayor pérdida de ácidos biliares [55]. La colestiramina reduce el efecto laxante de los ácidos biliares libres uniéndolos [55], por lo que las quejas de pérdidas marcadas de ácidos biliares se han aliviado con un 96% de éxito [55]. Los espasmolíticos, los antagonistas 5HT3 y los ATC (especialmente la amitriptilina) también pueden utilizarse para el subtipo SII-D [1,51,52].
Estreñimiento: El estreñimiento se trata con medicación aumentando la secreción y disminuyendo el tiempo de tránsito del colon [3]. Los fármacos de elección son los laxantes de tipo osmótico (por ejemplo, el macrogol), que licúan las heces al ligar el agua y facilitan la defecación [1,48,54]. Las fibras alimentarias hidrosolubles, como el psilio, funcionan según el mismo principio y también deben tenerse en cuenta, al tiempo que se garantiza una ingesta adecuada de líquidos (de 1,5 a 2 l/d) [1,56].
Para inducir la secreción en el colon y aumentar la motilidad, la lubiprostona activa los canales de cloruro, proporcionando una alternativa [57]. La prucaloprida (agonista 5HT4) y los ISRS estimulan la motilidad colónica como fármacos proserotoninérgicos y pueden probarse en el estreñimiento grave refractario a la terapia [1,52,58]. Los ATC suelen provocar estreñimiento como efecto secundario, por lo que no deben utilizarse en este caso [1,52]. Como fitoterapéutico, el STW-5 tuvo un efecto beneficioso [59].
Flatulencia: Los síntomas de flatulencia en el sentido de meteorismo, distensión abdominal y flatulencia surgen del aumento de la producción de gas por el microbioma y a menudo están presentes como síntoma acompañante en el estreñimiento [1,3]. Los aglutinantes de gas (por ejemplo, la simeticona) pueden ser un intento de terapia, pero a menudo sólo tienen un efecto limitado [1]. Especialmente contra la flatulencia, se pudo demostrar que el antibiótico rifaximina, que actúa reduciendo principalmente las especies bacterianas productoras de gas de la flora intestinal, lograba buenos efectos [46,60]. Sin embargo, el efecto sólo fue detectable a corto plazo (41% de mejora con el tratamiento con rifaximina frente al 23% en el grupo placebo) [46,60].
Psicoterapia
La psicoterapia está disponible como tercer pilar terapéutico, especialmente para los cursos graves y refractarios. Así lo recomiendan las directrices, ya que también abordan la etiología multimodal por parte de los aspectos psicológicos y sociales [1]. El eje intestino-cerebro, que ya se ha mencionado en varias ocasiones, es bidireccional, por lo que las dolencias gastrointestinales, por un lado, tienen un efecto negativo sobre, por ejemplo, la ansiedad y la depresión (ascendente); por otro, los rasgos de carácter, los patrones de conducta y pensamiento, así como el comportamiento en las relaciones, determinan la percepción y la gravedad de los síntomas (descendente) [61]. El enfoque psicoterapéutico tiene un impacto particular en la calidad de vida de los pacientes [62].
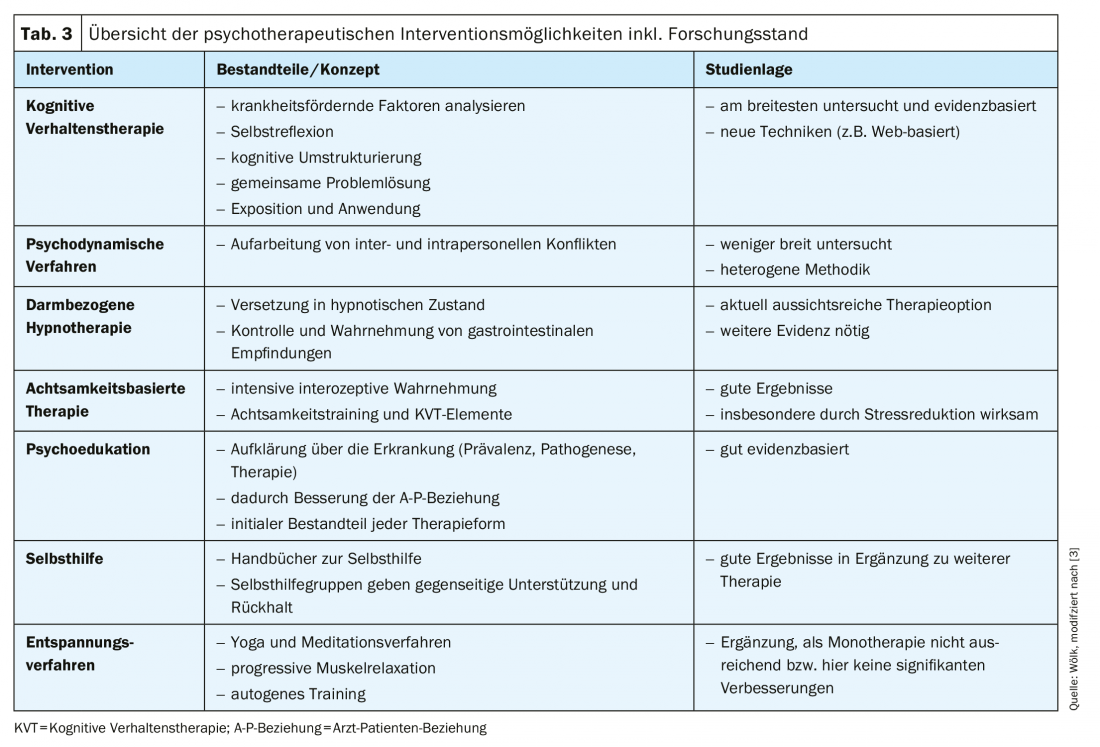
La forma de psicoterapia con mayor evidencia es la terapia cognitivo-conductual (TCC) [63], con un metaanálisis de 18 ensayos clínicos aleatorios (n=1380) que muestra un número necesario a tratar (NNT) de tres pacientes para la TCC [3,63]; esto es significativamente mejor que para, por ejemplo, las intervenciones farmacológicas. Además, los métodos psicodinámicos, la hipnoterapia visceral, así como la terapia basada en la atención plena y otros métodos (psicoeducación, autoayuda y métodos de relajación) representan puntos de partida psicoterapéuticos y se presentan a continuación (Tab. 3) [3].
Terapia cognitivo-conductual: Una base importante del éxito de la TCC es la relación abierta y de confianza del terapeuta con el paciente [64]. Ya en 1995, un estudio prospectivo demostró que una relación médico-paciente positiva reducía la necesidad de consultas de seguimiento [64].
El terapeuta trabaja psicoeducativamente informando primero al paciente sobre los antecedentes y vínculos del cuadro clínico [65]. Ayuda a reflexionar sobre el propio comportamiento y pensamiento exacerbador de los síntomas y, posteriormente, a reestructurarlo cognitivamente [65]. Después, la terapia incluye una búsqueda conjunta de estrategias de solución y la aplicación de éstas mediante la exposición a situaciones desencadenantes de estrés [65]. Este procedimiento produjo un aumento significativo de la calidad de vida (d=0,49) [66–68]. Sin embargo, no se encontró ninguna ventaja sobre otros procedimientos psicoterapéuticos [3]. La limitada disponibilidad de TC en la atención primaria crea la necesidad de seguir investigando, por ejemplo, los servicios de TC basados en la web [69].
Métodos psicodinámicos: Como alternativa a la TCC, pueden utilizarse métodos psicodinámicos en la terapia. Su objetivo es abordar los conflictos interpersonales e intrapersonales que pueden estar implicados en el desarrollo de los síntomas del SII [70].
Sin embargo, los estudios sobre esta forma de terapia no son tan amplios como los del TC. El contenido de la terapia en los estudios también es más heterogéneo que en la TC [3]. Este
La heterogeneidad reduce la comparabilidad de los estudios correspondientes. No obstante, los métodos psicodinámicos son una opción relativamente barata para el tratamiento de los pacientes, especialmente de aquellos con cursos graves de la enfermedad [71].
Sin embargo, un ensayo clínico aleatorizado (n=257) no logró demostrar la superioridad de la terapia psicodinámica en comparación con el tratamiento con paroxetina sola (ISRS, 20 mg/d) durante tres meses. Ambos grupos mostraron una mejora significativa de la calidad de vida en comparación con la terapia estándar [1,71].
Hipnoterapia relacionada con el intestino: Como forma especial de hipnoterapia, debe distinguirse de los demás procedimientos enumerados [3]. El objetivo del estado alterado de conciencia es recuperar el control sobre las percepciones gastrointestinales y mejorar así los síntomas [72].
La hipnoterapia se presenta actualmente como una intervención psicoterapéutica prometedora. En una gran cohorte de 1.000 pacientes con SII, se logró una reducción significativa de la gravedad de los síntomas, definida como una reducción de al menos 50 puntos en la puntuación de gravedad de los síntomas del SII (IBS-SSS), en el 76% de los pacientes [73].
El NNT es de cuatro pacientes, y se refiere a 452 pacientes de siete ensayos clínicos aleatorizados [3]. Según una revisión reciente, hasta el 73% de los pacientes responden positivamente a la hipnoterapia relacionada con el intestino [3,72]. Las desventajas de la hipnoterapia intestinal son su disponibilidad, todavía muy limitada en la actualidad, y sus costes relativamente elevados [3].
Terapia basada en la atención plena: El último método psicoterapéutico que debe considerarse con más detalle es la terapia basada en la atención plena, ya que reduce especialmente la angustia que se siente como consecuencia de la enfermedad [74]. Mediante la combinación de elementos relacionados con la atención plena y cognitivos, se entrenan la percepción y la autorreflexión al poder tratar mejor los síntomas tras una percepción interoceptiva intensiva [3]. La terapia suele durar ocho semanas [3,74].
Por desgracia, los estudios disponibles no son muy exhaustivos. Un ensayo clínico aleatorizado en 75 mujeres demostró que la terapia reducía significativamente los síntomas (26,4% frente a 6,2%) en comparación con el grupo de control y que la mejoría persistía después de tres meses, mientras que otro ensayo clínico describió una igualación de la mejoría de los síntomas con la terapia en comparación con el grupo de control después de seis meses (n=90). [74,75]. Esto sugiere un efecto más bien a corto plazo de esta forma de terapia. Sin embargo, las deficiencias metodológicas reducen la importancia de los estudios, por lo que se recomienda seguir investigando. Un estudio piloto realizado este año mostró resultados prometedores para la terapia basada en la atención plena (mayor reducción del estrés que en la terapia dialéctica conductual) [76].
Otras alternativas: Las intervenciones psicoterapéuticas alternativas son complementarias a las formas de terapia enumeradas. Las directrices recomiendan como opciones la psicoeducación, la autoayuda y los métodos de relajación [1].
La psicoeducación en el sentido de explicar la génesis biopsicosocial como ya se ha descrito es importante para que la relación médico-paciente sea funcional y para que el paciente se sienta percibido y comprendido con su sufrimiento [13,64].
La autoayuda la proporcionan, por ejemplo, los manuales, que pueden recomendarse según los estudios actuales (reducción significativa, del 60%, de las consultas al médico cuando se utiliza un manual al cabo de un año) [1,77]. Las técnicas de relajación pueden utilizarse en combinación; no existen pruebas convincentes para la monoterapia [1,78].
Outlook
El síndrome del intestino irritable es un cuadro clínico multifactorial de prevalencia mundial [12]. Los posibles factores patogénicos conllevan una variedad de enfoques terapéuticos. Los papeles de la nutrición (por ejemplo, el contenido de FODMAP) y del microbioma deben considerarse importantes aquí, ya que los pre, pro y antibióticos y posiblemente también la transferencia del microbioma fecal (FMT) pueden influir en la flora bacteriana. Sin embargo, el TFM debe considerarse con cautela, ya que aún faltan estudios sobre él y hasta ahora sólo se han demostrado éxitos menores dentro de un ensayo clínico aleatorizado [79]. Además, existen diversas opciones medicinales para la terapia sintomática. Aunque los psicofármacos no son muy populares entre los pacientes (y a menudo tampoco entre los médicos), los metaanálisis muestran que son opciones terapéuticas muy favorables. Debe ofrecerse psicoterapia especialmente a los pacientes con cursos graves y comorbilidades mentales. La KVT, la psicoterapia psicodinámica, pero también la hipnoterapia intestinal y la terapia basada en la atención plena son métodos adecuados en este caso.
Mensajes para llevarse a casa
- La génesis del SII es multifactorial y puede explicarse mediante el modelo de enfermedad biopsicosocial.
- Las modificaciones del estilo de vida (por ejemplo, la reducción del estrés) deben llevarse a cabo como terapia básica.
- La hipnoterapia relacionada con el intestino sigue siendo difícil de realizar debido a su limitada disponibilidad.
- La elección de la forma de terapia debe hacerse junto con el paciente.
- Debe ofrecerse psicoterapia para los cursos graves y las comorbilidades mentales.
Literatura:
- Layer P, et al.: Síndrome del intestino irritable: directrices de consenso alemanas sobre definición, fisiopatología y tratamiento. Z Gastroenterol, 2011. 49(2): 237-293.
- Mearin F, et al: Trastornos intestinales. Gastroenterología, 2016.
- Enck P, et al: Síndrome del intestino irritable. Nature Reviews Disease Primers, 2016. 2: 16014.
- Lacy BE, Patel NK: Criterios de Roma y enfoque diagnóstico del síndrome del intestino irritable. J Clin Med, 2017. 6(11).
- Lee YY, Annamalai C,Rao SSC: Síndrome del intestino irritable postinfeccioso. Curr Gastroenterol Rep, 2017. 19(11): 56.
- Lewis SJ. Heaton KW: Escala de forma de las heces como guía útil del tiempo de tránsito intestinal. Scand J Gastroenterol, 1997. 32(9): 920-924.
- Whitehead WE, Palsson O, Jones KR: Revisión sistemática de la comorbilidad del síndrome del intestino irritable con otros trastornos: ¿cuáles son las causas y las implicaciones? Gastroenterología, 2002. 122(4): 1140-1456.
- Ford AC, et al: Síndrome del intestino irritable: una historia natural de 10 años de síntomas y factores que influyen en la conducta de consulta. Am J Gastroenterol, 2008. 103(5): 1229-1239; quiz 1240.
- Sibelli A, et al: Una revisión sistemática con metaanálisis del papel de la ansiedad y la depresión en la aparición del síndrome del intestino irritable. Psychol Med, 2016. 46(15): 3065-3080.
- Lovell RM, Ford AC: Prevalencia global y factores de riesgo del síndrome del intestino irritable: un metaanálisis. Clin Gastroenterol Hepatol, 2012. 10(7): 712-721.e4.
- Lovell RM, Ford AC: Efecto del sexo en la prevalencia del síndrome del intestino irritable en la comunidad: revisión sistemática y metaanálisis. Am J Gastroenterol, 2012. 107(7): 991-1000.
- Thomas G, Grobe SS, Szecsenyi J: BARMER-Arztreport 2019 en Schriftenreihe zur Gesundheitsanalyse. 2019.
- Tanaka Y, et al: Modelo biopsicosocial del síndrome del intestino irritable. J Neurogastroenterol Motil, 2011. 17(2): 131-139.
- Carroll IM, et al: Alteraciones en la composición y diversidad de la microbiota intestinal en pacientes con síndrome del intestino irritable con diarrea predominante. Neurogastroenterol Motil, 2012. 24(6): 521-530, e248.
- Carroll IM, et al: Molecular analysis of the luminal- and mucosal-associated intestinal microbiota in diarrhea-predominant irritable bowel syndrome. Am J Physiol Gastrointest Liver Physiol, 2011. 301(5): G799-807.
- Moser G, Fournier C, Peter J: Eje microbioma intestinal-intestino-cerebro y síndrome del intestino irritable. Wien Med Wochenschr, 2018. 168(3-4): 62-66.
- Zhou Q, Zhang B, Verne GN: Permeabilidad de la membrana intestinal e hipersensibilidad en el síndrome del intestino irritable. Dolor, 2009. 146(1-2): 41-6.
- Piche T, et al.: Alteración de la integridad de la barrera intestinal en el colon de pacientes con síndrome del intestino irritable: implicación de mediadores solubles. Gut, 2009. 58(2): 196-201.
- Barbara G, et al: El sistema inmunitario en el síndrome del intestino irritable. J Neurogastroenterol Motil, 2011. 17(4): 349-359.
- Larsson MH, et al.: Diferencia de potencial transmucoso relacionada con la motilidad elevada en la parte superior del intestino delgado en el síndrome del intestino irritable. Neurogastroenterol Motil, 2007. 19(10): 812-820.
- Elsenbruch S, et al.: Los pacientes con síndrome del intestino irritable tienen alterada la modulación emocional de las respuestas neuronales a los estímulos viscerales. Gastroenterología, 2010. 139(4): 1310-1319.
- Walter SA, et al.: Estrés preexperimental en pacientes con síndrome del intestino irritable: valores elevados de cortisol ya antes de la provocación de síntomas con distensiones rectales. Neurogastroenterol Motil, 2006. 18(12): 1069-1077.
- FitzGerald LZ, Kehoe, Sinha K: Disregulación del eje hipotalámico-hipofisario-suprarrenal en mujeres con síndrome del intestino irritable en respuesta al estrés físico agudo. West J Nurs Res, 2009. 31(7): 818-836.
- O’Mahony SM, et al: Síndrome del intestino irritable y comorbilidades psiquiátricas relacionadas con el estrés: atención al estrés en los primeros años de vida. Handb Exp Pharmacol, 2017. 239: 219-246.
- Whitehead WE, et al: Comportamiento de enfermedad aprendida en pacientes con síndrome del intestino irritable y úlcera péptica. Dig Dis Sci, 1982. 27(3): 202-208.
- Di Palma JA, Herrera JL: El papel de la comunicación eficaz entre médico y paciente en el tratamiento del síndrome del intestino irritable y el estreñimiento crónico. J Clin Gastroenterol, 2012. 46(9): 748-751.
- Towle A, Godolphin W: Marco para la toma de decisiones compartida e informada sobre la enseñanza y el aprendizaje. Bmj, 1999. 319(7212): 766-771.
- Hauser W, et al: Trastornos intestinales funcionales en adultos. Dtsch Arztebl Int, 2012. 109(5): 83-94.
- Johannesson E, et al: La actividad física mejora los síntomas del síndrome del intestino irritable: un ensayo controlado aleatorizado. Am J Gastroenterol, 2011. 106(5): 915-922.
- Schumann D, et al: Efecto del yoga en la terapia del síndrome del intestino irritable: una revisión sistemática. Clin Gastroenterol Hepatol, 2016. 14(12): 1720-1731.
- Tu Q, et al: Alteraciones del sueño en el síndrome del intestino irritable: una revisión sistemática. Neurogastroenterol Motil, 2017. 29(3).
- Sirri L, Grandi S, Tossani E: El tabaquismo en el síndrome del intestino irritable: una revisión sistemática. J Dual Diagn, 2017. 13(3): 184-200.
- Bohn L, Storsrud S, Simren M: Ingesta de nutrientes en pacientes con síndrome del intestino irritable en comparación con la población general. Neurogastroenterol Motil, 2013. 25(1): 23-30.e1.
- Bohn L, et al: Los síntomas gastrointestinales autoinformados relacionados con la comida en el SII son frecuentes y se asocian a síntomas más graves y a una menor calidad de vida. Am J Gastroenterol, 2013. 108(5): 634-641.
- Goldstein R, Braverman D, Stankiewicz H: Malabsorción de carbohidratos y el efecto de la restricción dietética en los síntomas del síndrome del intestino irritable y las molestias funcionales intestinales. Isr Med Assoc J, 2000. 2(8): 583-587.
- Shepherd SJ, et al: Factores dietéticos desencadenantes de los síntomas abdominales en pacientes con síndrome del intestino irritable: pruebas aleatorias controladas con placebo. Clin Gastroenterol Hepatol, 2008. 6(7): 765-771.
- Wahnschaffe U, et al.: Predictores de la respuesta clínica a la dieta sin gluten en pacientes diagnosticados de síndrome del intestino irritable con diarrea predominante. Clin Gastroenterol Hepatol, 2007. 5(7): 844-850; quiz 769.
- Atkinson W, et al: Eliminación de alimentos basada en anticuerpos IgG en el síndrome del intestino irritable: un ensayo controlado aleatorizado. Gut, 2004. 53(10): 1459-1464.
- Cummings JH, Macfarlane GT: Papel de las bacterias intestinales en el metabolismo de los nutrientes. JPEN J Parenter Enteral Nutr, 1997. 21(6): 357-365.
- Gibson PR, Shepherd SJ: Tratamiento dietético basado en la evidencia de los síntomas gastrointestinales funcionales: El enfoque FODMAP. J Gastroenterol Hepatol, 2010. 25(2): 252-258.
- Catassi G, et al.: La dieta baja en FODMAP: muchos signos de interrogación para un acrónimo pegadizo. Nutrientes, 2017. 9(3).
- Altobelli E, et al: La dieta baja en FODMAP mejora los síntomas del síndrome del intestino irritable: un metaanálisis. Nutrientes, 2017. 9(9).
- Varju P, et al.: La dieta baja en oligosacáridos fermentables, disacáridos, monosacáridos y polioles (FODMAP) mejora los síntomas en adultos que padecen síndrome del intestino irritable (SII) en comparación con la dieta estándar para el SII: un metaanálisis de estudios clínicos. PLoS One, 2017. 12(8): e0182942.
- Ford AC, et al: Revisión sistemática con metaanálisis: la eficacia de los prebióticos, probióticos, simbióticos y antibióticos en el síndrome del intestino irritable. Aliment Pharmacol Ther, 2018. 48(10): 1044-1060.
- Didari T, et al: Eficacia de los probióticos en el síndrome del intestino irritable: revisión sistemática actualizada con metaanálisis. World J Gastroenterol, 2015. 21(10): 3072-3084.
- Pimentel M, et al: Terapia con rifaximina para pacientes con síndrome del intestino irritable sin estreñimiento. N Engl J Med, 2011. 364(1): 22-32.
- Krueger D, et al.: Efecto del butilbromuro de hioscina (Buscopan(R)) en las vías colinérgicas del intestino humano. Neurogastroenterol Motil, 2013. 25(8): e530-539.
- Ford AC, Lacy BE, Talley NJ: Síndrome del intestino irritable. N Engl J Med, 2017. 376(26): 2566-2578.
- Ford AC, et al: Efecto de la fibra, los antiespasmódicos y el aceite de menta en el tratamiento del síndrome del intestino irritable: revisión sistemática y metaanálisis. Bmj, 2008. 337: a2313.
- Cash BD, Epstein MS, Shah SM: Un novedoso sistema de administración de aceite de menta es una terapia eficaz para los síntomas del síndrome del intestino irritable. Dig Dis Sci, 2016. 61(2): 560-571.
- Garsed K, et al: Ensayo aleatorizado del ondansetrón para el tratamiento del síndrome del intestino irritable con diarrea. Gut, 2014. 63(10): 1617-1625.
- Moret C, Briley M: Antidepresivos en el tratamiento de la fibromialgia. Neuropsychiatr Dis Treat, 2006. 2(4): 537-548.
- Lacy BE, et al: Eficacia de la eluxadolina en pacientes con SII-D que informan del uso previo de loperamida. Am J Gastroenterol, 2017. 112(6): 924-932.
- Defrees DN, Bailey J: Síndrome del intestino irritable: epidemiología, fisiopatología, diagnóstico y tratamiento. Prim Care, 2017. 44(4): 655-671.
- Wedlake L, et al.: Revisión sistemática: prevalencia de la malabsorción idiopática de ácidos biliares diagnosticada mediante la exploración SeHCAT en pacientes con síndrome del intestino irritable con diarrea predominante. Aliment Pharmacol Ther, 2009. 30(7): 707-717.
- Zuckerman MJ: El papel de la fibra en el tratamiento del síndrome del intestino irritable: recomendaciones terapéuticas. J Clin Gastroenterol, 2006. 40(2): 104-108.
- Li F, et al: La lubiprostona es eficaz en el tratamiento del estreñimiento idiopático crónico y el síndrome del intestino irritable: revisión sistemática y metaanálisis de ensayos controlados aleatorizados. Mayo Clin Proc, 2016. 91(4): 456-68.
- Corsetti M, Tack J: Nuevas opciones de tratamiento farmacológico para el estreñimiento crónico. Expert Opin Pharmacother, 2014. 15(7): 927-941.
- Madisch A, et al: Tratamiento del síndrome del intestino irritable con preparados a base de plantas: resultados de un ensayo multicéntrico doble ciego, aleatorizado y controlado con placebo. Aliment Pharmacol Ther, 2004. 19(3): 271-279.
- Pimentel M: Artículo de revisión: posibles mecanismos de acción de la rifaximina en el tratamiento del síndrome del intestino irritable con diarrea. Aliment Pharmacol Ther, 2016. 43 Suppl 1: 37-49.
- Fond G, et al: Comorbilidades de ansiedad y depresión en el síndrome del intestino irritable (SII): una revisión sistemática y metaanálisis. Eur Arch Psychiatry Clin Neurosci, 2014. 264(8): 651-660.
- Guthrie E, et al: Un ensayo controlado aleatorio de psicoterapia en pacientes con síndrome del intestino irritable refractario. Br J Psychiatry, 1993. 163: 315-321.
- Laird KT, et al: Eficacia a corto y largo plazo de las terapias psicológicas para el síndrome del intestino irritable: revisión sistemática y metaanálisis. Clin Gastroenterol Hepatol, 2016. 14(7): 937-947.e4.
- Owens DM, Nelson DK, Talley NJ: El síndrome del intestino irritable: pronóstico a largo plazo e interacción médico-paciente. Ann Intern Med, 1995. 122(2): 107-112.
- Kinsinger SW: Terapia cognitivo-conductual para pacientes con síndrome del intestino irritable: perspectivas actuales. Investigación psicológica y gestión del comportamiento, 2017. 10: 231-237.
- Laird KT, et al: Eficacia comparativa de las terapias psicológicas para mejorar la salud mental y el funcionamiento diario en el síndrome del intestino irritable: revisión sistemática y metaanálisis. Clinical Psychology Review, 2017. 51: 142-152.
- Radziwon CD, Lackner JM: Terapia cognitivo-conductual para el SII: ¿hasta qué punto es útil, con qué frecuencia y cómo funciona? Informes actuales de gastroenterología, 2017. 19(10): 49.
- Li L, et al.: Terapia cognitivo-conductual para el síndrome del intestino irritable: un metaanálisis. J Psychosom Res, 2014. 77(1): 1-12.
- Kawanishi H, et al: Terapia cognitivo-conductual con exposición interoceptiva y materiales de vídeo complementarios para el síndrome del intestino irritable (SII): protocolo para un ensayo controlado aleatorizado multicéntrico en Japón. Biopsicosoc Med, 2019. 13: 14.
- Palsson OS, Whitehead WE: Tratamientos psicológicos en los trastornos gastrointestinales funcionales: un manual para el gastroenterólogo. Gastroenterología clínica y hepatología, 2013. 11(3): 208-216.
- Creed F, et al: La rentabilidad de la psicoterapia y la paroxetina para el síndrome del intestino irritable grave. Gastroenterología, 2003. 124(2): 303-317.
- Peters SL, Muir JG, Gibson PR: Artículo de revisión: hipnoterapia dirigida al intestino en el tratamiento del síndrome del intestino irritable y la enfermedad inflamatoria intestinal. Aliment Pharmacol Ther, 2015. 41(11): 1104-1115.
- Miller V, et al: Hipnoterapia para el síndrome del intestino irritable: una auditoría de mil pacientes adultos. Aliment Pharmacol Ther, 2015. 41(9): 844-855.
- Gaylord SA, et al: El entrenamiento en atención plena reduce la gravedad del síndrome del intestino irritable en mujeres: resultados de un ensayo controlado aleatorizado. Am J Gastroenterol, 2011. 106(9): 1678-1688.
- Zernicke KA, et al.: Reducción del estrés basada en la atención plena para el tratamiento de los síntomas del síndrome del intestino irritable: un ensayo aleatorizado controlado en lista de espera. Int J Behav Med, 2013. 20(3): 385-396.
- Mohamadi J, Ghazanfari F, Drikvand FM: Comparación del efecto de la terapia conductual dialéctica, la terapia cognitiva basada en la atención plena y la psicoterapia positiva sobre el estrés percibido y la calidad de vida en pacientes con síndrome del intestino irritable: un ensayo piloto controlado aleatorizado. Psychiatr Q, 2019. 90(3): 565-578.
- Robinson A, et al: Ensayo controlado aleatorizado de intervenciones de autoayuda en pacientes con diagnóstico de síndrome del intestino irritable en atención primaria. Gut, 2006. 55(5): 643-648.
- Ford AC, et al: Eficacia de los antidepresivos y las terapias psicológicas en el síndrome del intestino irritable: revisión sistemática y metaanálisis. Gut, 2009. 58(3): 367-378.
- Johnsen PH, et al: Trasplante de microbiota fecal frente a placebo para el síndrome del intestino irritable de moderado a grave: un ensayo doble ciego, aleatorizado, controlado con placebo, de grupos paralelos y realizado en un único centro. Lancet Gastroenterol Hepatol, 2018. 3(1): 17-24.
- Storr M: La guía nutricional de la dieta FODMAP: La dieta algo diferente para el síndrome del intestino irritable, la intolerancia al trigo y otros trastornos digestivos. 2017: W. Zuckschwerdt Verlag.
GPS 2019; 14(9): 9-15