El melanoma maligno de piel tiene una elevada tasa de metástasis y es responsable de más del 90% de todas las muertes relacionadas con el cáncer de piel. Por lo tanto, la detección precoz y el mejor tratamiento posible son muy importantes. La Asociación Europea de Dermatooncología (EADO), junto con el Foro Europeo de Dermatología (EDF) y la Organización Europea para la Investigación y el Tratamiento del Cáncer (EORTC), ha publicado nuevas directrices para el diagnóstico y el tratamiento del melanoma en 2022.
El Prof. Dr. med. Claus Garbe, de la Clínica Dermatológica Universitaria de Tubinga, ofreció una visión actual de aspectos importantes de la directriz [1,2] con motivo de la Reunión Anual de la Asociación Europea de Dermato-Oncología (EADO). En cuanto al cribado y el diagnóstico, el presidente en funciones de la EADO explicó que para la evaluación de las lesiones cutáneas pigmentadas y no pigmentadas, la dermatoscopia sigue considerándose el estándar. Para los pacientes de alto riesgo, la directriz también recomienda el uso de la fotografía de cuerpo entero para detectar los melanomas lo antes posible. La dermatoscopia digital también puede mejorar la detección precoz del melanoma y debe utilizarse en pacientes de alto riesgo con un número total elevado de nevus. Alrededor del 70% de los melanomas son de nueva formación y el 30% se desarrollan a partir de nevos melanocíticos, explicó el Prof. Garbe. Utilizando tecnologías modernas como el “escáner corporal”, pueden identificarse nuevas lesiones de forma fiable. Las imágenes de cuerpo entero actuales se comparan automáticamente con las del último examen, de modo que se detectan tanto los nevus modificados como los de nueva aparición. Si existe una sospecha clínica de melanoma, la confirmación histopatológica es obligatoria. Se pueden distinguir cuatro tipos principales de melanoma maligno según el patrón de crecimiento y la localización: el melanoma de extensión superficial es el más común, seguido del melanoma nodular, el lentigo maligno y el melanoma acrolentiginoso [3].
Se recomienda la ecografía de los ganglios linfáticos locorregionales
Para la estadificación de los melanomas primarios pT1b**, se recomienda el diagnóstico ecográfico de los ganglios linfáticos locorregionales y de la vía en tránsito tanto durante el estudio inicial como durante el seguimiento. Si existe una sospecha clínica de melanoma, debe extirparse completamente de inmediato con un pequeño margen de seguridad (1–3 mm) (recuadro). Las biopsias incisionales son útiles para lesiones grandes como las de la cara (por ejemplo, lentigo maligno), para lesiones acrales o para lesiones en la zona genital. Si el examen histológico demuestra que se trata de un melanoma maligno, debe realizarse una nueva reexcisión con un margen de seguridad de 1–2 cm [4] para evitar la probabilidad de recidiva local. En el caso de algunos subtipos de melanoma, como el lentigo maligno o los melanomas genitales y acrales, puede recurrirse a la cirugía controlada microscópicamente para preservar el tejido circundante y garantizar una resección completa. En Alemania se utiliza con relativa frecuencia, informó el ponente. Por ejemplo, se utiliza la técnica “Mohs lento”.
** pT = tumor primario evaluado histopatológicamente
La biopsia del ganglio linfático centinela: un tema muy discutido
Para una correcta clasificación tumoral (estadificación) y como base para la decisión terapéutica, a las pacientes con un grosor tumoral ≥1,0 mm (o en caso de factores de riesgo histológico adicionales de ≥0,8 mm) se les debe ofrecer una biopsia del ganglio linfático centinela (BGC) [1,2]. “Esto será motivo de debate en el futuro”, afirmó el profesor Garbe, añadiendo que no se sabe con certeza si la SLNB se seguirá realizando dentro de unos años [1]. Originalmente, la BSGC servía para establecer la indicación de una linfadenectomía completa. Pero estudios recientes demuestran que la supervivencia no mejora en los pacientes con linfadenectomía completa, según informó el presidente de la EADO [1]. Según la directriz actual, las pacientes con micrometástasis en el ganglio linfático centinela ya no deben someterse a una linfadenectomía completa. Se trata de una indicación de terapia sistémica adyuvante. En caso de oligo-metástasis, puede considerarse la resección completa u otros procedimientos destructivos. En el pasado se recomendaba la metastasectomía, pero hoy en día se favorece el tratamiento con inhibidores de puntos de control inmunitarios o terapia dirigida. La radioterapia del tumor primario rara vez está indicada en el melanoma. Pero para los pacientes que rechazan el tratamiento quirúrgico, por ejemplo, podría considerarse la radioterapia.
Mejores resultados gracias a los modernos regímenes de farmacoterapia
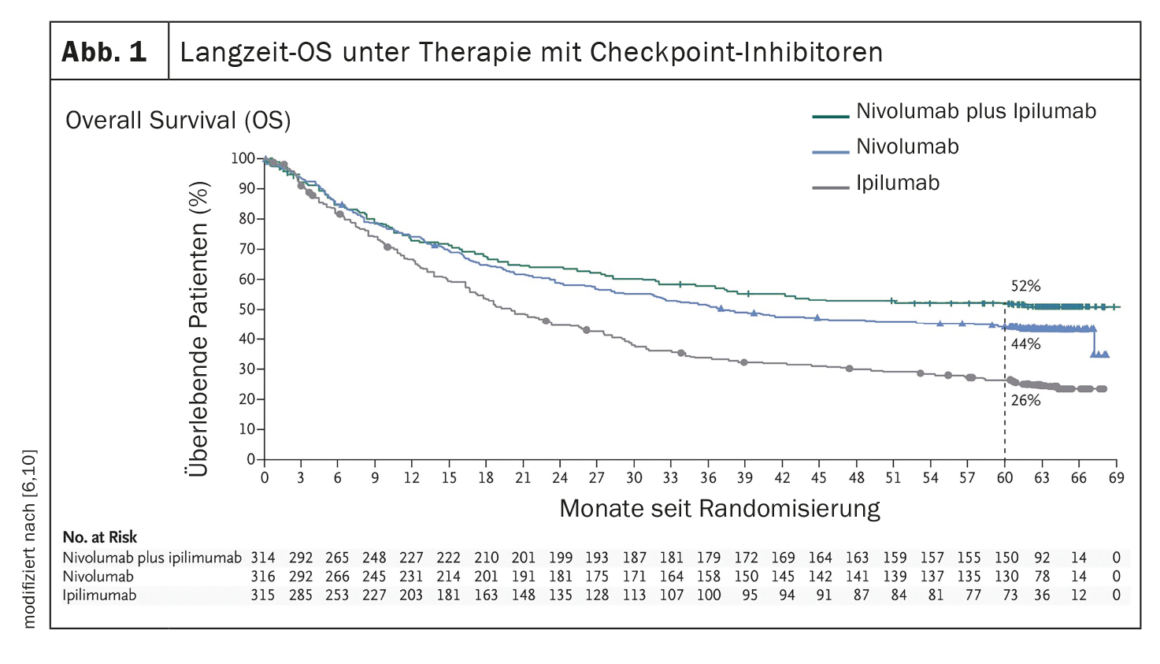
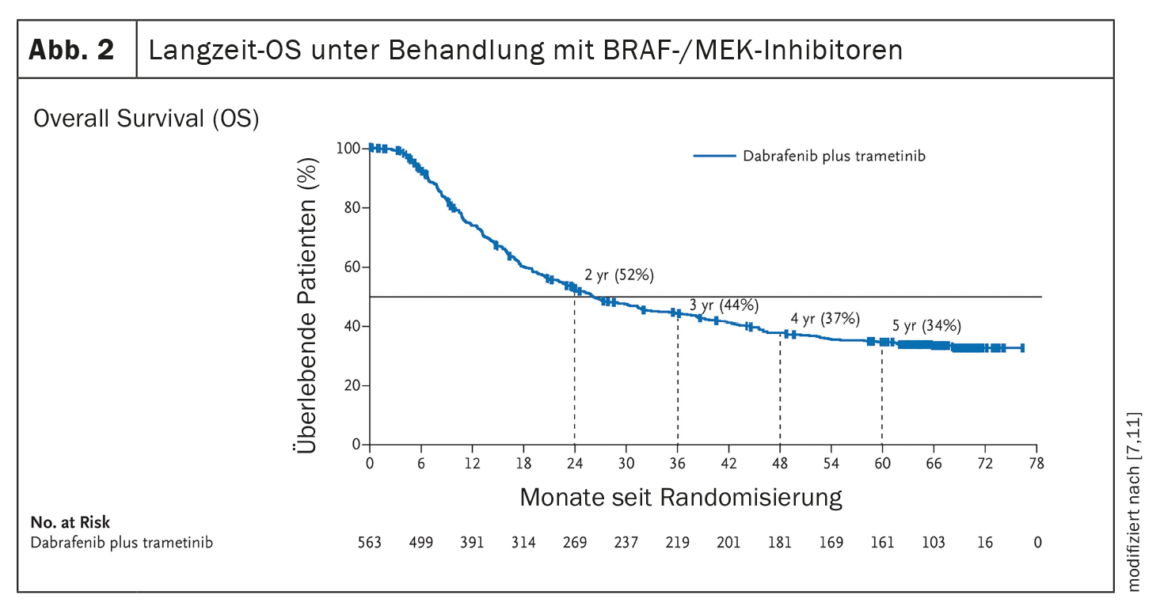
El establecimiento de terapias sistémicas como la inhibición de puntos de control inmunitarios o la terapia dirigida con inhibición de BRAF/MEK (en presencia de una mutación BRAF V600) han supuesto una mejora significativa de la evolución clínica de los pacientes con melanoma metastásico. (Fig. 1, Fig. 2). En la era de la quimioterapia, la supervivencia media de los pacientes con metástasis irresecables era de 7 meses y la supervivencia a 3 años del 5%, según datos publicados en 2008 [5]. Por el contrario, los datos del ensayo CheckMate067 publicados en 2019 muestran una supervivencia global (SG) a 5 años del 52% en el brazo de tratamiento con nivolumab más ipilimumab y del 44% con nivolumab en monoterapia, respectivamente, cuando se trata con inhibidores de puntos de control inmunitarios (Fig. 1 ) [6]. Y el tratamiento con el inhibidor de BRAF dabrafenib (150 mg dos veces al día) más el inhibidor de MEK trametinib (2 mg una vez al día) logró unas tasas de SG a 5 años del 34% (IC del 95%; 30-38) [7] (Fig. 2 ).
¿Inmunoterapia o terapia dirigida como primera línea?
Según los datos actuales, la inhibición de puntos de control inmunitarios debería ofrecerse como tratamiento de primera línea en pacientes en estadio IV, también independientemente del estado de la mutación BRAF. El Prof. Garbe explicó que el tratamiento combinado con nivolumab e ipilimumab es preferible a la monoterapia. En el melanoma en estadio IV, la determinación de la expresión de PD-L1 no es necesaria y no debe ser un criterio para la toma de decisiones terapéuticas. En determinadas situaciones, a los pacientes con melanoma en estadio IV y mutación BRAFV600E o V600K demostrada se les puede ofrecer un tratamiento de primera línea con inhibidores de BRAF/MEK como alternativa a la inmunoterapia. Hay datos que demuestran que ciertos pacientes se benefician cuando la terapia dirigida se utiliza desde el principio.
Terapia en el contexto adyuvante
Durante muchos años se han ensayado conceptos de terapia sistémica adyuvante para prevenir las metástasis a distancia, prolongar el tiempo de supervivencia y aumentar la tasa de supervivencia a largo plazo. La terapia adyuvante puede reducir el riesgo de recidiva en pacientes con melanoma maligno resecado y debería ofrecerse a todos los pacientes en estadio IIIA-IIID [1,2]. La terapia anti PD-1 es una opción independientemente del estado de la mutación, mientras que para los pacientes con mutación BRAFV600/K, también puede considerarse la terapia adyuvante con inhibidores de BRAF/MEK. Para el tratamiento adyuvante del melanoma en estadio IV (tras la resección completa), la directriz aconseja sugerir nivolumab como opción de tratamiento a los pacientes, independientemente del estado de la mutación. “Estas terapias adyuvantes son asombrosamente eficaces”, subrayó el Prof. Garbe y afirmó que actualmente no conocía ninguna otra entidad tumoral con opciones terapéuticas adyuvantes de eficacia comparable. El hecho de que la combinación de nivolumab e ipilumab lograra una supervivencia libre de recidiva (SSR) del 70% a los 24 meses en pacientes con melanoma en estadio IV NED (“sin evidencia de enfermedad”; sin residuos tras la resección), en comparación con el 42% con monoterapia de nivolumab y el 14% con placebo, subraya la eficacia de la inhibición de los puntos de control en el contexto adyuvante. [1,8]. Sin embargo, el tratamiento adyuvante mediante la inhibición de BRAF/MEK también ha proporcionado pruebas convincentes de su eficacia i. El dabrafenib más trametinib redujo el riesgo de recurrencia tumoral o muerte (RFS) en un 53% en comparación con el placebo tras una mediana de seguimiento de 2,8 años (HR 0,47; IC 95%; 0,39-0,58; p<0,001) [1,9,13].
Congreso: EADO Annual Meeting
Literatura:
- «Recommendations from the updated European Interdisciplinary Melanoma Guideline 2022 (EADO/EORTC)», Prof. Dr. med. Claus Garbe, Symposium 4, EADO Annual Meeting, 20.04.2023.
- Garbe C, et al.; EDF, EADO, and EORTC. European consensus-based interdisciplinary guideline for melanoma. Part 2: Treatment – Update 2022. Eur J Cancer 2022; 170: 256–284.
- Innovationsreport 2021, www.tk.de/resource, (letzter Abruf 22.05.2023)
- Läuchli S: Chirurgische Techniken: Dermatochirurgische Möglichkeiten für die Behandlung von Hauttumoren in der Praxis. Dermatologie Praxis 2023; 2: 12–15.
- Korn EL, et al.: Meta-analysis of phase II cooperative group trials in metastatic stage IV melanoma to determine progression-free and overall survival benchmarks for future phase II trials. J Clin Oncol 2008; 26(4): 527–534.
- Larkin J, et al.: Five-Year Survival with Combined Nivolumab and Ipilimumab in Advanced Melanoma. N Engl J Med 2019; 381(16): 1535–1546.
- Robert C, et al.: Five-Year Outcomes with Dabrafenib plus Trametinib in Metastatic Melanoma. N Engl J Med 2019; 381(7): 626–663.
- Schadendorf D, et al.: ESMO 2019 Oral BA67.
- Hauschild A: Abstract LBA6_PR, ESMO 2017.
- Larkin J, et al.: Five-Year Survival with Combined Nivolumab and Ipilimumab in Advanced Melanoma. N Engl J Med 2019; 381(16): 1535–1546.
- Robert C, et al.: Five-Year Outcomes with Dabrafenib plus Trametinib in Metastatic Melanoma. N Engl J Med 2019; 381(7): 626–636
- Diaz-Ramón JL, et al.: Cancers 2023; 15: 2174. www.mdpi.com/2072-6694/15/7/2174#, (letzter Abruf 23.05.2023)
- ESMO 2017: Adjuvant Dabrafenib Plus Trametinib Significantly Lowers Risk of Death in Stage III BRAF V600–Mutated Melanoma, www.esmo.org/oncology-news/archive; (letzter Abruf 23.05.2023)
DERMATOLOGIE PRAXIS 2023; 33(3): 26–27