El carcinoma de células de Merkel es una forma rara pero agresiva de cáncer de piel. Afecta principalmente a las personas mayores; la edad media en el momento del diagnóstico es de 75 años. Tras la extirpación quirúrgica del tumor primario, se recomienda la radioterapia adyuvante. En un estadio avanzado o en caso de metástasis a distancia, debe considerarse la inmunoterapia. El único anticuerpo PD-L1 aprobado en Suiza hasta la fecha ha revolucionado las opciones de tratamiento.
“El carcinoma de células de Merkel es extremadamente heterogéneo en su presentación clínica”, informó la Dra. Anja Wysocki, Co-Jefa de Dermatología del Hospital Cantonal de Lucerna [1]. Además de la forma nodular más común, rara vez se dan variantes en forma de placa; éstas se encuentran principalmente en el tronco y las extremidades proximales.
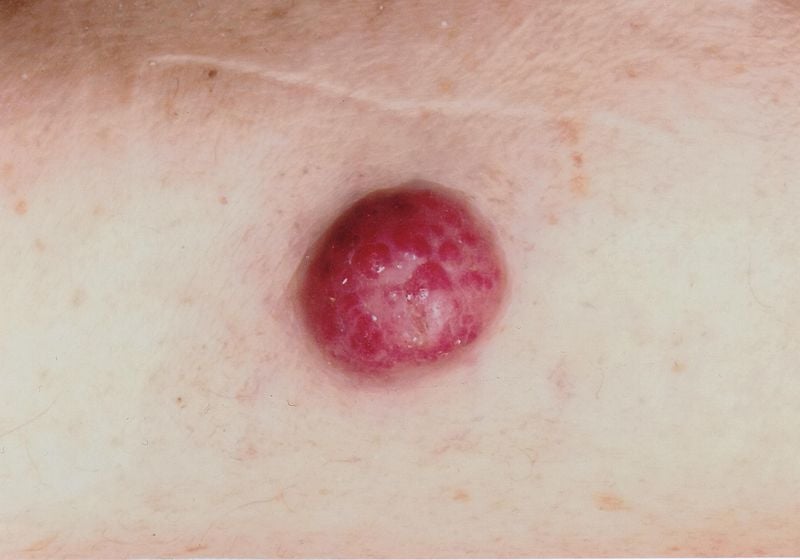
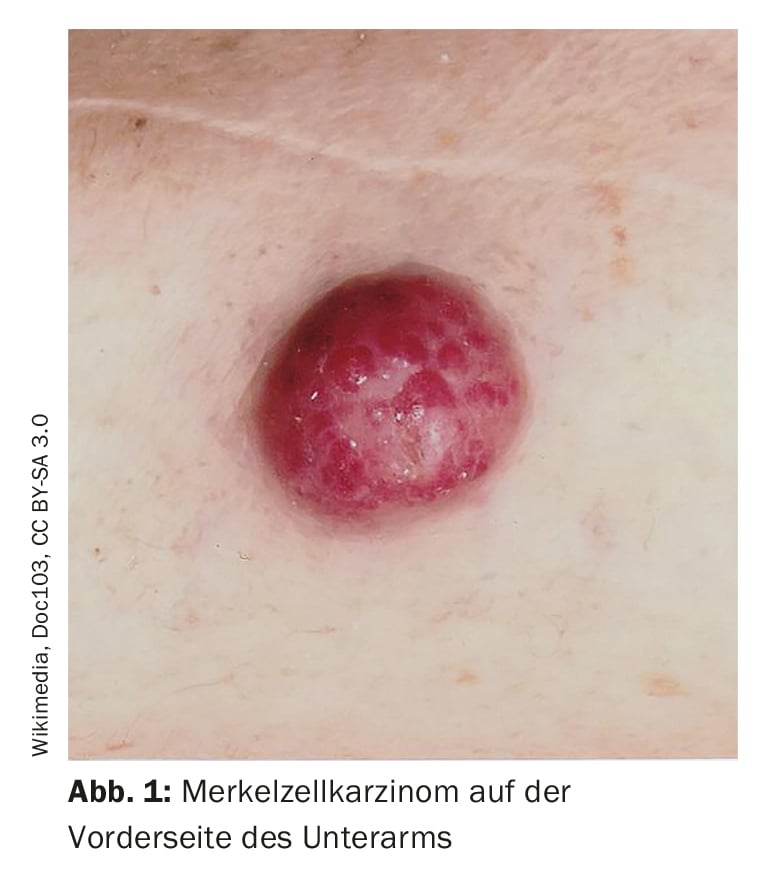
Los diagnósticos erróneos son relativamente frecuentes, señaló el ponente. Existe confusión con foliculitis, dermatofibromas, lipomas o angiomas, por ejemplo, y a veces un carcinoma de células de Merkel se interpreta erróneamente como carcinoma basocelular, espinoma, melanoma o sarcoma. El carcinoma de células de Merkel (CCM) se desarrolla rápidamente, por lo general a lo largo de semanas o unos pocos meses, como un tumor asintomático, abultado, de color púrpura rojizo, con una superficie lisa y generalmente brillante. (Fig. 1). En la dermatoscopia, el CCM se presenta como zonas rosadas, sin estructura, con finas líneas blancas; en estadios avanzados también pueden observarse ulceraciones, y es más frecuente encontrar metástasis satelitales. La localización preferida del CCM es la piel crónicamente dañada por el sol de la región de la cabeza y el cuello (más de la mitad de los casos) y las extremidades distales (aproximadamente un tercio de los casos) [2]. Además de la exposición a los rayos UV como factor de riesgo significativo del CCM, existe una asociación con el poliomavirus de células de Merkel (MCPyV) en más de la mitad de las pacientes [2].
Además de la directriz s2k en alemán sobre el carcinoma de células de Merkel de Becker et al. También se publicó una directriz en inglés en 2022 [2,3]. El ponente profundizó en algunas recomendaciones importantes de las directrices sobre diagnóstico y terapia.
¿Cómo reconocer un CCM de alto riesgo?
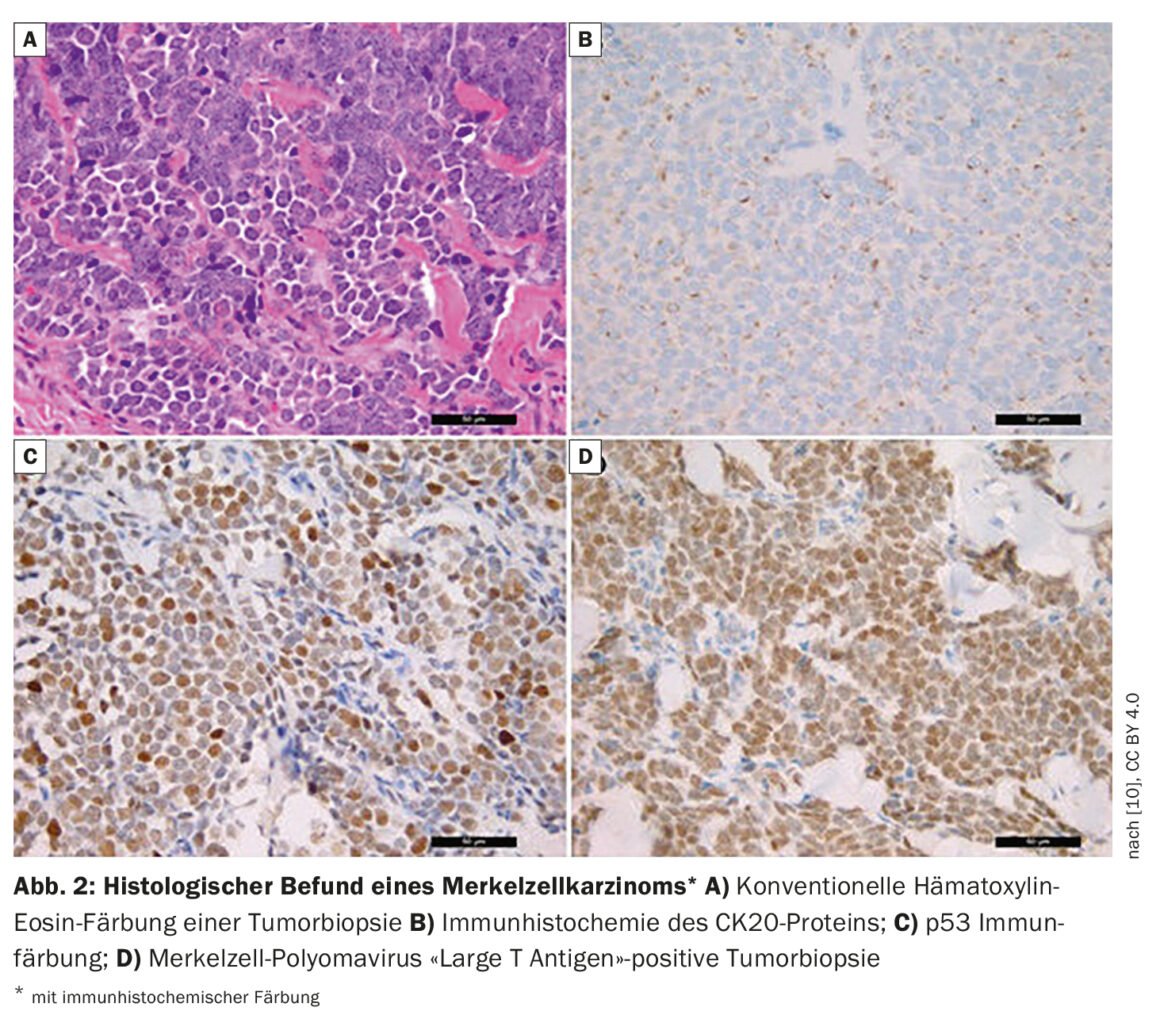
“Una cuarta parte de los pacientes ya tienen metástasis en los ganglios linfáticos en el momento del diagnóstico inicial y un 8% tienen metástasis a distancia”, afirma el Dr. Wysocki [1]. En pacientes con sospecha de CCM, además de la inspección se realiza una biopsia o una escisión total. Si se ha encontrado evidencia histológica de CCM (recuadro, Fig. 2) , se realiza una FDG-PET/TC. Si los hallazgos son negativos, es decir, si la paciente no presenta metástasis en los ganglios linfáticos u otros órganos, se realiza una biopsia del ganglio linfático centinela. Las características de los pacientes con CCM de alto riesgo incluyen la edad superior a 77 años y la exposición a los rayos UV (los antecedentes de PUVA multiplican por 100 el riesgo). Los hombres tienen un riesgo 2,5 veces superior y las personas inmunodeprimidas (VIH, neoplasias hematológicas, receptores de trasplantes de órganos) también tienen un riesgo mayor. Otros criterios para un CCM de alto riesgo son el tamaño del tumor >2 cm, y la invasión profunda más allá del tejido adiposo subcutáneo. El ponente considera importante que el grosor del tumor y la profundidad de penetración se documenten en los informes patológicos. A menudo, las pacientes ya tienen ganglios linfáticos patológicamente detectables o existe invasión linfovascular. Según las directrices 2021 de la NCCN (National Comprehensive Cancer Network), este último es un criterio de alto riesgo [4].
Escisión: la distancia de seguridad óptima es difícil de definir
Cuanto antes se detecte el carcinoma de células de Merkel y se extirpe completamente durante la intervención quirúrgica, mejor será el pronóstico. “La definición del margen de seguridad en el carcinoma de células de Merkel es controvertida”, subrayó el Dr. Wysocki [1]. Algunos expertos sugieren tomar una distancia de seguridad de 1 cm y después la post-radiación adyuvante. Las distancias de escisión <1 cm también son tolerables si posteriormente se administra posradiación adyuvante. La cirugía de Mohs es tan segura como la elección de amplios márgenes de seguridad para una escisión local estándar. Este es el resultado de una publicación de Carrasquillo et al. publicada en 2022. surgió [5]. Si no utiliza adyuvante tras la radiación, debe mantener una distancia de seguridad de unos 2 cm. “Pero la distancia de seguridad óptima es difícil de definir y debe determinarse en la junta tumoral en cada caso individual”, subrayó el ponente [1].
Los expertos aconsejan la radioterapia adyuvante
Tras la cirugía, la radioterapia adyuvante del lecho tumoral y de las vías de drenaje linfático circundantes puede reducir el riesgo de recidiva de la enfermedad. Sin embargo, la radioterapia adyuvante no sólo es importante para prevenir una recidiva, sino que también mejora la supervivencia global (SG), la supervivencia libre de enfermedad y contrarresta la aparición de metástasis a distancia, declaró el Dr. Wysocki [1,3]. La irradiación adyuvante del lecho tumoral primario debe realizarse en las 8 semanas siguientes a la escisión quirúrgica con una dosis total de 50-55 Gy para la localización del tumor en la región de la cabeza y el cuello o de 60-66 Gy para márgenes microscópica y macroscópicamente positivos. “Cuando reextirpamos el tumor primario, también realizamos la biopsia del ganglio centinela al mismo tiempo si la estadificación no presentaba complicaciones”, informó el ponente [1]. Esto se debe a que alrededor de una cuarta parte de los pacientes con CCM ya presentan metástasis microscópicas en los ganglios linfáticos en el momento de la aparición del tumor primario. Sin embargo, esto se decide de forma individual en función del estado general del paciente, la capacidad para ser anestesiado y la localización. En el Hospital Cantonal de Lucerna, todos los casos de CCM se debaten en la junta interdisciplinar de tumores. La radioterapia también puede utilizarse como complemento de la cirugía y la terapia sistémica para los tumores metastásicos de células de Merkel. Una recomendación basada en el consenso establece que, en caso de una biopsia positiva del ganglio linfático centinela, debe realizarse una postirradiación adyuvante en la región del ganglio linfático o combinarse con una disección completa del ganglio linfático.
anticuerpo anti-PDL-1 avelumab: mejores resultados que la quimioterapia
En el pasado, las quimioterapias sólo tenían una mediana de SG de 9 meses en la situación metastásica. Los anticuerpos anti-PDL-1 representan un gran paso adelante en este sentido, subrayó el Dr. Wysocki [1]. El anticuerpo anti-PD-L1 avelumab (Bavencio®) está aprobado en Suiza para el CCM metastásico (CCMm) desde 2017 [6]. En el ensayo de fase II JAVELIN Merkel 2000, se evaluó el avelumab en pacientes que ya habían recibido al menos una terapia citostática previa para el CCM [7,8].
En los 88 pacientes estudiados con avelumab de segunda línea, se alcanzó una tasa de respuesta objetiva del 33% tras una mediana de seguimiento de 65 meses; la mediana de duración de la respuesta fue de 40,5 meses [7]. La mediana de supervivencia sin progresión (SLP) fue de 2,7 meses y la tasa de SLP después de 24 meses fue del 26%. La mediana de la SG fue de 12,6 meses y la tasa de SG fue del 31% después de 42 meses. Se trata de resultados muy buenos en comparación con la quimioterapia, resumió el ponente [2]. El estudio se amplió posteriormente para incluir a pacientes en primera línea de tratamiento [9]. De 116 pacientes tratados con avelumab como primera línea (mediana de seguimiento: 21,2 meses), 35 pacientes respondieron durante un periodo ≥6 meses, lo que corresponde a una tasa de respuesta duradera (TRD) del 30,2%. La tasa de respuesta global (ORR) fue del 39,7%. La mediana de la SLP fue de 4,1 meses y la SG a 1 año de alrededor del 60%, ligeramente superior a la del avelumab como tratamiento de primera línea, explicó el ponente [1,2]. Los efectos secundarios inducidos por la terapia se produjeron en el 81% de los pacientes tratados con avelumab, pero fueron en su mayoría leves (fatiga, debilidad, picor). Se documentaron efectos secundarios graves (en su mayoría de grado 3 ó 4) en el 14,7% de los participantes en el estudio.
En general, la conclusión sobre el avelumab como opción terapéutica es extremadamente positiva. “Realmente podemos ofrecer a los pacientes una buena terapia de sistema”, resumió el Dr. Wysocki [1]. La dosis recomendada es de 10 mg/kg cada quince días. El tratamiento se administra hasta la progresión o la aparición de efectos secundarios graves. “Desgraciadamente, aún no se ha aprobado el tratamiento adyuvante o neoadyuvante”, afirmó el ponente [1].
Congreso: Swiss Derma Day
Literatura:
- “Puesta al día sobre el carcinoma de células de Merkel”, Dra. Anja Wysocki, Swiss Derma Day 12.01.2023
- Becker JC, et al: Directriz S2k – Carcinoma de células de Merkel – Actualización 2022. J Dtsch Dermatol Ges 2023; 21(3): 305-317.
- Gauci ML, et al.: Foro Europeo de Dermatología (EDF), la Asociación Europea de Dermato-Oncología (EADO) y la Organización Europea para la Investigación y el Tratamiento del Cáncer (EORTC). Diagnóstico y tratamiento del carcinoma de células de Merkel: directriz interdisciplinar europea basada en el consenso – Actualización 2022. Eur J Cancer 2022; 171: 203-231.
- Guías de práctica clínica en oncología de la NCCN: Carcinoma de células de Merkel, versión 1.2021 – 18 de febrero de 2021, https://merkelcell.org/wp-content/uploads/2021/02/NCCN-2021.pdf,(última consulta: 21.03.2023).
- Carrasquillo OY, et al: Cirugía micrográfica de Mohs frente a escisión local amplia en el tratamiento del carcinoma de células de Merkel: una revisión sistemática. Dermatol Surg 2022; 48(2): 176-180.
- Información sobre medicamentos, www.swissmedicinfo.ch,(último acceso 21.03.2023)
- D’Angelo SP, et al.: Avelumab in patients with previously treated metastatic Merkel cell carcinoma (JAVELIN Merkel 200): updated overall survival data after >5 years of follow-up. ESMO Open. 2021; 6(6): 10029.
- Kaufman HL, et al.: Updated efficacy of avelumab in patients with previously treated metastatic Merkel cell carcinoma after ≥ 1 year of follow-up: JAVELIN Merkel 200, a phase 2 clinical trial. J Immunother Cancer 2018; 6(1): 7.
- D’Angelo SP, et al.: First-line avelumab in a cohort of 116 patients with metastatic Merkel cell carcinoma (JAVELIN Merkel 200): primary and biomarker analyses of a phase II study. J Immunother Cancer 2021; 9(7): e002646.
- Mokánszki A, et al.: Molecular Profiling of Merkel Cell Polyomavirus-Associated Merkel Cell Carcinoma and Cutaneous Melanoma. Diagnostics 2021, 11, 212. https://doi.org/10.3390/diagnostics11020212, www.mdpi.com/2075-4418/11/2/212, (última consulta: 21.03.2023)
DERMATOLOGIE PRAXIS 2023; 33(2): 45–46
InFo ONKOLOGIE & HÄMATOLOGIE 2023; 11(2): 22–23