La stéatose hépatique non alcoolique (NAFLD) est la maladie du foie la plus fréquente dans le monde occidental. Pour distinguer la NAFLD de la stéatose hépatique alcoolique, la consommation d’alcool doit être généralement sans danger, c’est-à-dire <20 grammes/jour pour les femmes et <30 grammes/jour pour les hommes. Avec l’augmentation de la prévalence de l’obésité et des maladies associées telles que le diabète sucré de type 2, la dyslipidémie, l’hypertension et l’apnée obstructive du sommeil, la prévalence de la NAFLD a également augmenté de manière significative au cours des dernières années.
Étiologie et facteurs de risque
La maladie du foie gras non alcoolique (NAFLD) est la maladie du foie la plus fréquente dans le monde occidental. Pour distinguer la NAFLD de la stéatose hépatique alcoolique, la consommation d’alcool doit être généralement sans danger, c’est-à-dire <20 grammes/jour pour les femmes et <30 grammes/jour pour les hommes. Dans les pays où la proportion de personnes en surpoids ou obèses est élevée, environ un quart à un tiers des adultes souffrent de NAFLD. (Fig.1). Avec l’augmentation de la prévalence de l’obésité et des maladies associées telles que le diabète sucré de type 2, la dyslipidémie, l’hypertension et l’apnée obstructive du sommeil, la prévalence de la NAFLD a également augmenté de manière significative au cours des dernières années. Aux États-Unis, par exemple, alors que la NAFLD touchait 6% des adultes en 2003, ce chiffre est passé à 18% en 2011 et s’élève actuellement à près de 25% [1]. Dans les populations à risque, c’est-à-dire les patients souffrant d’obésité et de diabète sucré de type 2, la prévalence de la NAFLD est même supérieure à 50% [2]. L’augmentation mondiale de la consommation de boissons sucrées, en particulier celles à forte teneur en fructose, a également contribué à l’augmentation des taux de prévalence de la NAFLD. En raison de ces facteurs de risque métaboliques évidents, la NAFLD est également appelée manifestation hépatique du syndrome métabolique. Il convient de distinguer d’autres causes pouvant entraîner une stéatose hépatique, telles qu’une perte de poids rapide, une alimentation parentérale totale, une infection par le génotype 3 de l’hépatite C, la maladie de Wilson et certains médicaments (par exemple le méthotrexate). Des études menées sur des jumeaux monozygotes et des études familiales ont fourni des indications sur les facteurs de risque génétiques, montrant que le risque que des parents de premier degré soient également atteints de NAFLD peut atteindre 50%. Les patients d’origine asiatique et sud-américaine sont particulièrement concernés [3]. En outre, il existe des gènes à risque, tels que le domaine 3 de la phospholipase patatin-like (PNPLA3), le membre 2 de la superfamille transmembrane 6 (TM6SF2), la 17-bêta hydroxystéroïde déshydrogénase 13 (HSD17B13), le domaine 7 de la O-acyltransférase liée à la membrane (MBOAT7) ou le canal 4 transmembrane-like (TMC4), qui influencent le développement de la stéatose hépatique et de la fibrose chez une partie des patients NAFLD. Il est possible qu’à l’avenir, la détermination des variants génétiques à risque puisse être utilisée pour la stratification des risques, mais ils ne jouent pas encore de rôle dans la pratique clinique quotidienne.
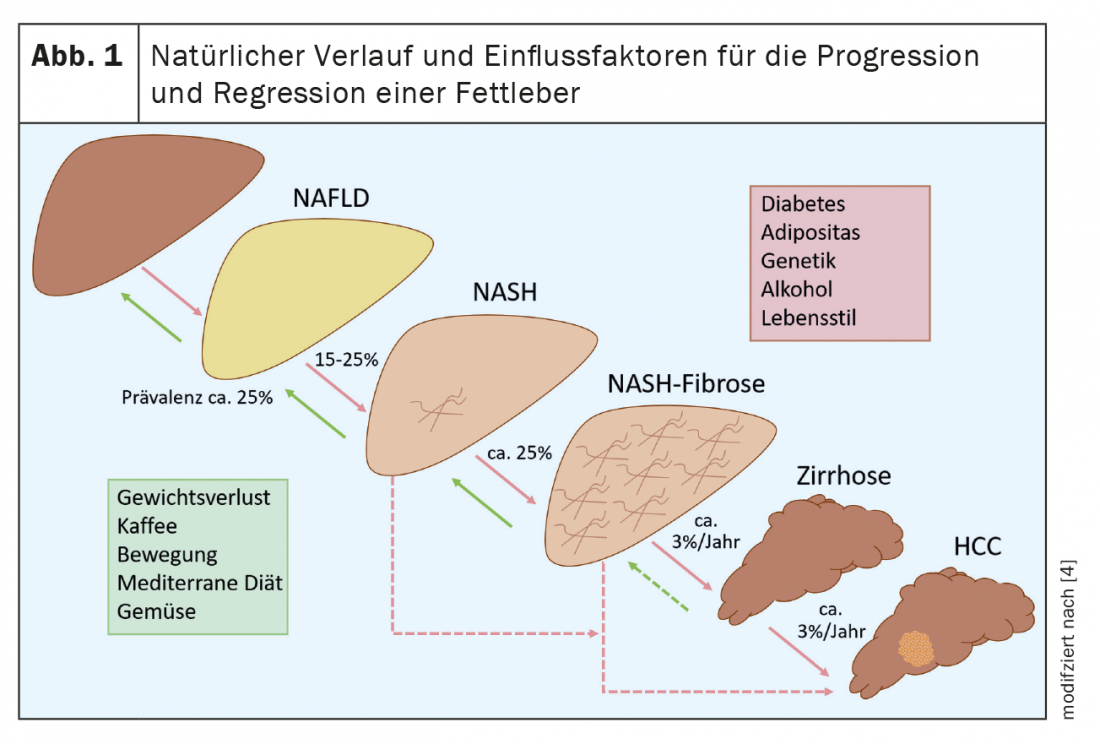
La grande majorité des patients atteints de NAFLD présentent une stéatose hépatique pure et environ 15 à 25% de ces cas peuvent évoluer vers une stéatohépatite non alcoolique (NASH) [4]. (Fig.1). Une partie de ces patients développent une fibrose hépatique importante et jusqu’à 12% des patients atteints de NASH développent par la suite une cirrhose du foie [2]. Celle-ci augmente le risque de décompensation hépatique et de carcinome hépatocellulaire (CHC), qui augmentent respectivement de manière significative la morbidité et la mortalité de la NAFLD. Il est donc important d’identifier les patients à risque d’évolution progressive ou présentant une fibrose avancée afin de les traiter rapidement et de les soumettre à un dépistage du CHC. Avec un traitement adéquat, il est possible de stabiliser, voire de faire régresser la maladie. Cela illustre une fois de plus l’importance de la pose du diagnostic. Cependant, des données récentes provenant d’une grande base de données de santé allemande montrent que la NAFLD est nettement sous-diagnostiquée [5].
La mortalité des patients atteints de NAFLD est essentiellement déterminée par les maladies cardiovasculaires, de sorte que le risque cardiovasculaire de ces patients devrait être évalué chaque année, par exemple au moyen du calculateur de risque AGLA de l’Association suisse pour la prévention de l’athérosclérose. La NAFLD constitue également un facteur de risque à part entière pour les maladies cardiovasculaires.
Dépistage, diagnostic et surveillance
Le diagnostic de NAFLD est suspecté après avoir exclu d’autres causes de maladie hépatique (notamment les hépatites virales chroniques, les maladies alcooliques ou auto-immunes du foie) et en présence d’un profil de risque métabolique avec des signes concomitants de stéatose à l’échographie. Les directives actuelles mentionnent une biopsie du foie pour la détection de la stéatose, mais en raison de son caractère invasif et du nombre élevé de patients, la procédure susmentionnée par échographie s’est imposée dans la pratique clinique quotidienne [6]. L’échographie ne permet de détecter une stéatose qu’à partir d’environ 20% d’obésité. L’étape suivante du diagnostic consiste à évaluer si une fibrose hépatique est déjà présente, car elle détermine le pronostic du patient. Indépendamment de la présence d’une activité inflammatoire (NASH), les patients présentant une fibrose hépatique ont une mortalité générale et hépatique à long terme nettement plus élevée que les patients sans fibrose [7].
La biopsie du foie est le gold standard pour le diagnostic de la fibrose. Histologiquement, on distingue 5 stades de fibrose : F0 = pas de fibrose à F4 = cirrhose. En outre, l’histologie est le seul moyen de distinguer la présence d’une NAFLD de celle d’une NASH. Dans la NAFLD, plus de 5% des hépatocytes sont touchés par la stéatose [6]. Dans la NASH, on trouve également des hépatocytes ballonnés et des infiltrats de cellules inflammatoires [8]. L’ampleur de ces changements est résumée dans ce que l’on appelle le score d’activité NAFLD (NAS). Si ce score est de 5 points ou plus, les critères de diagnostic de la NASH sont remplis. De telles modifications favorisent alors également la formation d’une fibrose pouvant aller jusqu’à la cirrhose. La biopsie du foie est généralement réalisée par un spécialiste en gastro-entérologie et en hépatologie lorsqu’une question spécifique est posée. Elle peut être effectuée en cas de suspicion de fibrose de haut grade dans le cadre d’un diagnostic non invasif de la fibrose (Fig. 2) ou pour établir un diagnostic différentiel en cas de présence éventuelle d’une autre cause de maladie hépatique, car cela est pertinent pour le traitement et la surveillance du patient.
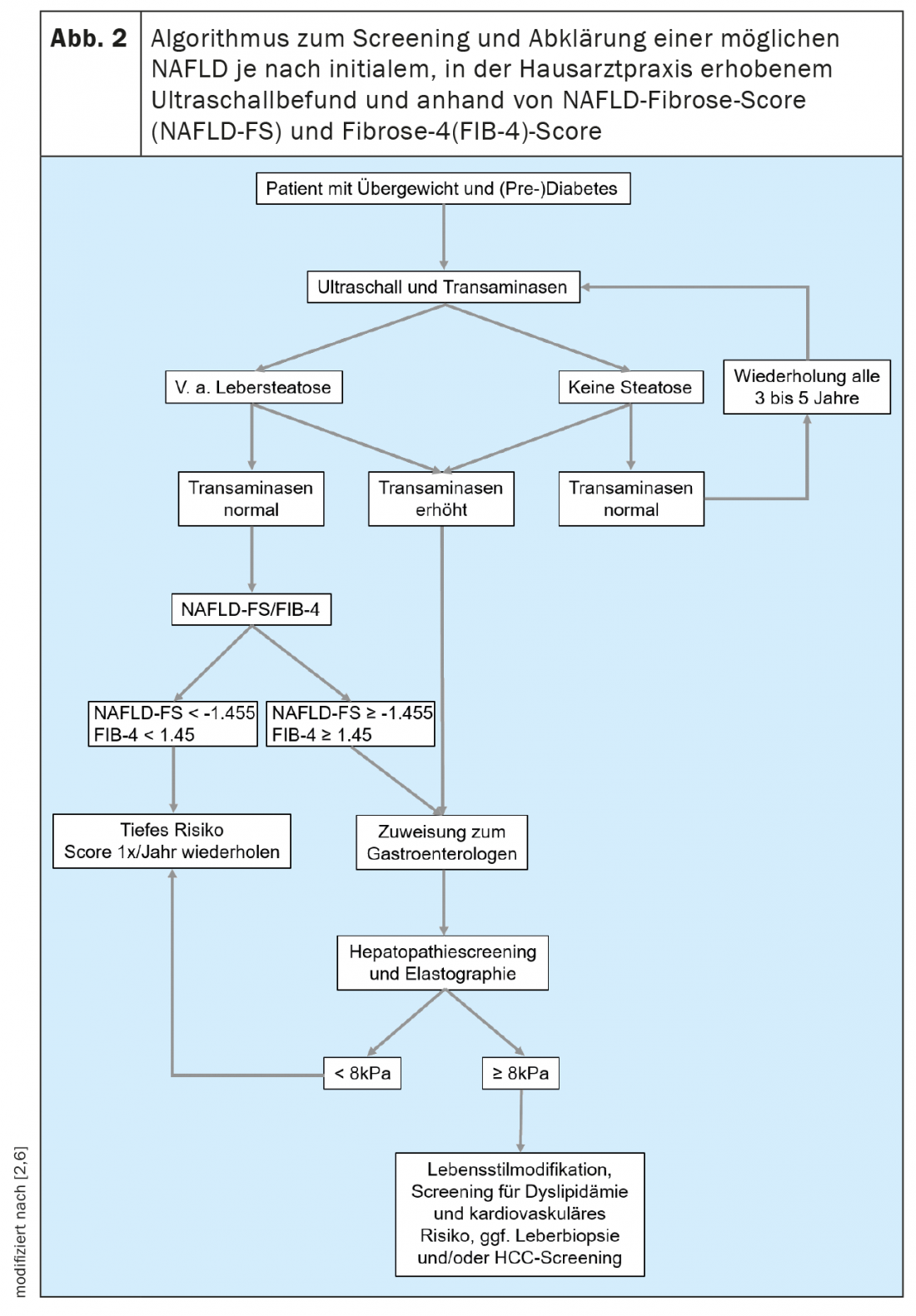
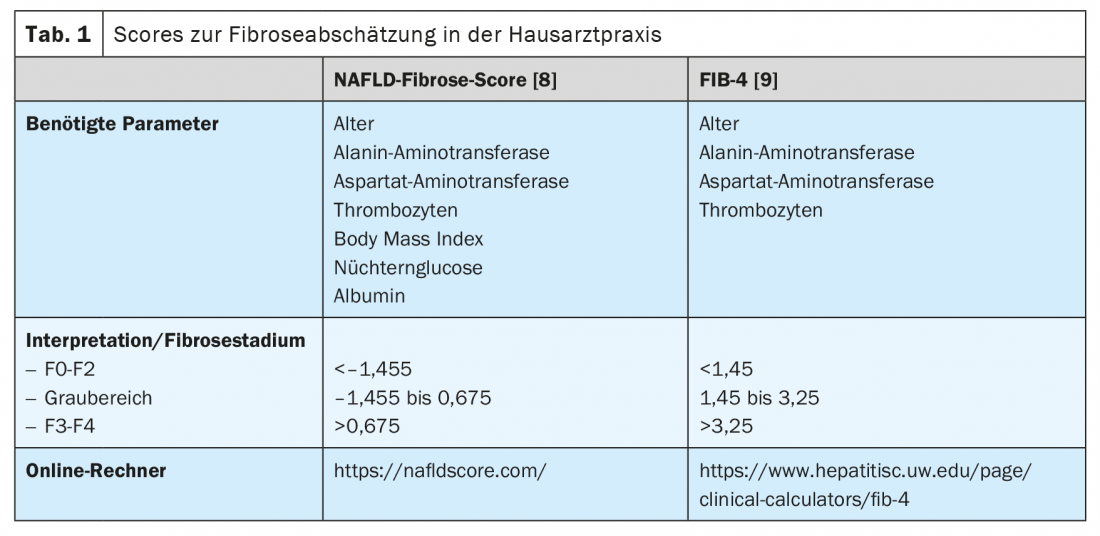
En outre, il existe des moyens non invasifs d’évaluer la présence et l’étendue de la fibrose hépatique. Cela permet aux collègues qui traitent fréquemment les patients des populations à risque de NAFLD, tels que les médecins généralistes, les endocrinologues et les cardiologues, d’effectuer un dépistage simple. Il est généralement recommandé d’initier le dépistage de la NAFLD par une échographie chez tous les patients appartenant à une population à risque. (Fig. 2). Si une stéatose hépatique est suspectée, le risque de maladie hépatique de haut niveau doit être évalué en mesurant les transaminases et d’autres paramètres cliniques tels que l’indice de masse corporelle, l’âge et l’hémogramme. Il existe de nombreux scores basés sur des valeurs cliniques ou sériques qui peuvent être utilisés en premier lieu pour exclure une maladie hépatique avancée. Parmi ceux-ci, le NAFLD Fibrose Score -(NAFLD-FS) et le Fibrose-4 (FIB-4) sont suffisamment validés pour être recommandés ici (tableau 1) [9,10]. Des valeurs de NAFLD-FS et de FIB-4 dans la fourchette de fibrose F0 à F2 excluent pratiquement une maladie hépatique grave. Si ces scores permettent de suspecter une fibrose hépatique de haut grade (scores dans la zone grise, ou dans la zone de fibrose F3 ou F4), il convient d’adresser le patient à un gastroentérologue pour un diagnostic plus poussé par élastographie transitoire (FibroScan®) ou une élastographie par ondes de cisaillement et une biopsie du foie si nécessaire. (Fig. 2). La vitesse de propagation d’une impulsion ultrasonore dans le foie permet d’évaluer de manière non invasive le degré de fibrose hépatique à l’aide de l’élastographie transitoire ou par ondes de cisaillement, et d’établir également un diagnostic d’évolution sous traitement. Les patients souffrant d’obésité, de diabète de type 2 ou de prédiabète et de transaminases élevées devraient généralement être adressés à un spécialiste en gastroentérologie et hépatologie pour une échographie abdominale avec élastographie, en raison de la prévalence élevée de la NAFLD dans cette population [11,6]. Dans le cadre de l’élastographie transitoire, un paramètre d’atténuation contrôlée (CAP) est également utilisé pour déterminer un substitut de la stéatose hépatique. Cette valeur CAP peut indiquer une stéatose si elle est supérieure à 275 dB/m, mais cette méthode n’est actuellement pas recommandée pour le seul diagnostic initial de stéatose hépatique en raison de l’insuffisance des données disponibles [12].
Les patients atteints de cirrhose ont un risque accru de développer un CHC et doivent donc faire l’objet d’un dépistage semestriel du CHC. En cas de bonne visibilité échographique, celle-ci est réalisée par échographie et l’alpha-foetoprotéine (AFP) doit être déterminée comme marqueur tumoral. Si la visibilité est difficile, par exemple en raison d’une obésité concomitante, une IRM du foie peut être effectuée (en alternance, le cas échéant). Chez une partie des patients, le CHC apparaît avant le développement de la cirrhose, mais un dépistage généralisé du CHC chez les patients NAFLD sans cirrhose n’est pas considéré comme rentable en raison du grand nombre de patients concernés. En général, le dépistage du CHC est recommandé à partir de la présence d’une fibrose F3 (“fibrose pontique”).
Options thérapeutiques
Le traitement de la NAFLD/NASH a pour objectif de prévenir la progression de la maladie ou d’obtenir une régression de la fibrose et de réduire en outre le risque cardiovasculaire des patients. De nombreux essais thérapeutiques médicamenteux, y compris des essais de phase 3, ont été menés ces dernières années, mais aucun traitement spécifique n’a encore été approuvé. Les substances étudiées comprennent des approches thérapeutiques métaboliques, anti-inflammatoires et antifibrotiques. La seule étude de phase 3 positive à ce jour (REGENERATE) a démontré une amélioration de la fibrose hépatique pour l’acide obéticholique, un agoniste des récepteurs farnésoïdes X (FXR) [13]. Cette substance est déjà sur le marché pour le traitement de la cholangite biliaire primaire (Ocaliva®), une autorisation de mise sur le marché avec l’indication NASH est en attente. Les études actuelles portent également sur la combinaison de différentes préparations. La prévention de la progression de la maladie semble plus facile à obtenir que la régression de la fibrose hépatique. Un traitement médicamenteux pourrait être utile, en particulier pour les patients dont la maladie est à un stade avancé, mais il n’existe pas encore de traitement pharmacologique curatif [6].
Le traitement de la NAFLD est donc centré sur une perte de poids accompagnée d’une modification des habitudes de vie. Des études ont montré des effets significatifs sur le degré de stéatose et d’inflammation du foie et, dans certains cas, une régression de la fibrose. Cette approche thérapeutique permet également d’obtenir un effet positif sur les co-morbidités pertinentes, telles que le diabète, le syndrome d’apnée du sommeil ou un risque cardiovasculaire accru. La Société allemande des maladies digestives et métaboliques et la Société européenne des maladies du foie recommandent une réduction de poids de 7 à 10%, qui devrait être atteinte par un changement d’alimentation (en évitant les aliments qui favorisent le développement de la NAFLD) et une augmentation de l’activité physique, voir également le tableau 2 [6,14]. L’entraînement d’endurance et l’entraînement musculaire sont tous deux efficaces, de sorte qu’ils peuvent être organisés en fonction des préférences du patient. Il existe donc un traitement efficace de la NAFLD, mais il est souvent difficile pour le patient d’appliquer les recommandations et d’obtenir une perte de poids durable au quotidien. Une approche multidisciplinaire, en particulier pour les patients à risque d’évolution progressive ou dont la maladie est déjà à un stade avancé, impliquant entre autres des conseils nutritionnels et l’endocrinologie avec une consultation d’obésité, est utile.

Dans ce sens, la chirurgie bariatrique est également mentionnée comme une option thérapeutique possible lorsqu’il existe une indication chirurgicale pour une obésité existante. Il a été démontré qu’après une chirurgie bariatrique, une majorité de patients ont une réduction significative de l’activité inflammatoire et qu’une régression de la fibrose est également possible [15].
S’il existe des co-morbidités, elles doivent être traitées conformément aux recommandations actuelles des sociétés savantes concernées. Il n’existe pas encore de recommandations pour l’utilisation d’hypolipémiants, de statines, de biguanides, d’inhibiteurs du SGLT2 ou d’agonistes du GLP1 chez les patients atteints de NAFLD sans co-morbidité correspondante, mais il existe des données montrant un bénéfice, c’est-à-dire une régression de la stéatose et de l’inflammation, chez les patients NAFLD [16,17]. Si l’administration de statines est indiquée sur la base du profil lipidique, elles peuvent également être utilisées chez les patients atteints de NAFLD sans risque accru, tant que la fonction hépatique est compensée. En cas de cirrhose Child-A préexistante, la biodisponibilité peut être nettement plus élevée selon la préparation, de sorte qu’une adaptation de la dose doit être évaluée et qu’un contrôle régulier de la créatine doit être effectué, car le risque de rhabdomyolyse est légèrement accru.
Les patients atteints de stéatose hépatique et de syndrome métabolique présentent souvent des taux élevés de ferritine sérique avec une saturation normale de la transferrine ou l’absence de mutation génétique compatible avec l’hémochromatose. Chez ces patients, l’utilité d’une phlébotomie pour dépléter les réserves de fer est controversée et ne peut pas être recommandée en raison de données limitées [6]. Chez ces patients, l’hyperferritinémie est l’expression de la stéatohépatite.
En cas de progression de la NASH vers une cirrhose décompensée, il est possible d’évaluer une transplantation hépatique. Aujourd’hui, la cirrhose NASH est déjà la première cause de transplantation hépatique aux États-Unis.
MAFLD– qu’est-ce que c’est ?
Il est souvent difficile de faire la distinction entre la stéatose hépatique alcoolique et la stéatose hépatique non alcoolique. Comme indiqué précédemment, la NAFLD est un diagnostic d’exclusion. Cependant, il est souvent impossible de distinguer le rôle de la consommation d’alcool ou d’une autre maladie hépatique concomitante de celui de la NAFLD, par exemple chez un patient souffrant d’obésité, de diabète et d’hépatite B chronique. C’est pour cette raison que l’on s’efforce d’utiliser le terme de stéatose hépatique métabolique (MAFLD) pour décrire la maladie. d’introduire une nouvelle terminologie en mettant l’accent sur l’étiologie. Cette définition prend en compte les maladies métaboliques concomitantes et la présence d’autres maladies du foie ne constitue pas une contre-indication au diagnostic [18]. La MAFLD peut être diagnostiquée en présence d’une stéatose hépatique (imagerie ou biopsie) avec en plus une surcharge pondérale (indice de masse corporelle
≥
25 kg/m²) ou un diabète de type 2. Chez les sujets de poids normal, il convient d’ajouter 2 facteurs du syndrome métabolique (tour de hanches >101 ou 87 cm chez les hommes ou les femmes). femmes, hypertension >130/85 mmHg, hypertriglycéridémie >1,7 mmol/l, HDL-cholestérol <1,0 et 1,3 mmol/l respectivement chez les hommes et les femmes, pré-diabète avec HbA1c de 5,7 à 6,4%, CRP >2 mg/l) sont présents. Cette définition est parfois utilisée, mais elle n’est pas encore établie dans les lignes directrices existantes des sociétés savantes et dans la pratique clinique quotidienne.
Messages Take-Home
- La prévalence de la NAFLD a considérablement augmenté au cours des dernières années.
- Les patients souffrant d’obésité et de syndrome métabolique ont un risque élevé de développer une NAFLD.
- Le dépistage de ces populations à risque par les médecins généralistes traitants pour la présence d’une NAFLD et l’estimation du stade de la maladie sont importants pour détecter précocement une maladie hépatique avancée et mettre en place un traitement.
- Le score de fibrose de la NAFLD et le FIB-4 sont des méthodes de dépistage pour l’évaluation de la fibrose et peuvent être réalisés sans équipement.
- Les patients atteints de NAFLD doivent faire l’objet d’un dépistage régulier des maladies cardiovasculaires.
- La base du traitement est un changement des habitudes de vie avec une augmentation de l’activité physique et une modification de l’alimentation dans le but de réduire le poids d’environ 7 à 10%.
- Les traitements médicamenteux font l’objet d’études, mais il n’existe pas encore de produit autorisé pour traiter la NAFLD.
Littérature :
- Arshad T, Golabi P, Henry L, Younossi ZM : Epidémiologie de la maladie du foie gras non alcoolique en Amérique du Nord. Curr Pharm Des 2020 ; 26 : 993-997.
- Vieira Barbosa J, Lai M : Nonalcoholic Fatty Liver Disease Screening in Type 2 Diabetes Mellitus Patients in the Primary Care Setting. Hepatol Commun 2021 ; 5 : 158-167.
- Eslam M, Valenti L, Romeo S : Génétique et épigénétique de la NAFLD et de la NASH : impact clinique. J Hepatol 2018 ; 68 : 268-279.
- Tacke F, Weiskirchen R : Non-alcoholic fatty liver disease (NAFLD)/non-alcoholic steatohepatitis (NASH)-related liver fibrosis : mechanisms, treatment and prevention. Ann Transl Med 2021 ; 9(8) : 729.
- Canbay A, Kachru N, Haas JS, et al : Patterns and predictors of mortality and disease progression among patients with non-alcoholic fatty liver disease. Aliment Pharmacol Ther 2020 ; 52 : 1185-1194.
- European Association for the Study of the L, European Association for the Study of D, and European Association for the Study of O. EASL-EASD-EASO Clinical Practice Guidelines for the management of non-alcoholic fatty liver disease. J Hepatol 2016 ; 64 : 1388-1402.
- Angulo P, Kleiner DE, Dam-Larsen S, et al : Liver Fibrosis, but No Other Histologic Features, Is Associated With Long-term Outcomes of Patients With Nonalcoholic Fatty Liver Disease. Gastroenterology 2015 ; 149 : 389-397.
- Kleiner DE, Brunt EM, Van Natta M, et al : Design and validation of a histological scoring system for nonalcoholic fatty liver disease. Hepatology 2005 ; 41 : 1313-1321.
- Angulo P, Hui JM, Marchesini G, et al : The NAFLD fibrosis score : a noninvasive system that identifies liver fibrosis in patients with NAFLD. Hepatology 2007 ; 45 : 846-854.
- Sterling RK, Lissen E, Clumeck N, et al : Development of a simple noninvasive index to predict significant fibrosis in patients with HIV/HCV coinfection. Hepatology 2006 ; 43 : 1317-1325.
- American Diabetes A. 4. Évaluation médicale complète et évaluation des comorbidités : normes de soins médicaux dans le diabète-2021. Diabetes Care 2021 ; 44 : 40-52.
- European Association for the Study of the L, List of panel m, Berzigotti A, Boursier J, Castera L, et al. : Easl Clinical Practice Guidelines (Cpgs) On Non-Invasive Tests For Evaluation Of Liver Disease Severity And Prognosis – 2020 Update. J Hepatol 2021.
- Younossi ZM, Ratziu V, Loomba R, et al : L’acide obéticholique pour le traitement de la stéatohépatite non alcoolique : analyse intermédiaire d’un essai de phase 3 multicentrique, randomisé et contrôlé par placebo. Lancet 2019 ; 394 : 2184-2196.
- Roeb E, Steffen HM, Bantel H, et al. : [S2k Guideline non-alcoholic fatty liver disease]. Z Gastroenterol 2015 ; 53 : 668-723.
- Lassailly G, Caiazzo R, Ntandja-Wandji LC, et al : La chirurgie bariatrique offre une résolution à long terme de la stéatohépatite non alcoolique et la régression de la fibrose. Gastroenterology 2020 ; 159 : 1290-1301.
- Lai LL, Vethakkan SR, Nik Mustapha NR, et al : Empagliflozin for the Treatment of Nonalcoholic Steatohepatitis in Patients with Type 2 Diabetes Mellitus. Dig Dis Sci 2020 ; 65 : 623-631.
- Newsome PN, Buchholtz K, Cusi K, et al : A Placebo-Controlled Trial of Subcutaneous Semaglutide in Nonalcoholic Steatohepatitis. N Engl J Med 2021 ; 384 : 1113-1124.
- Eslam M, Sanyal AJ, George J, International Consensus P : MAFLD : A Consensus-Driven Proposed Nomenclature for Metabolic Associated Fatty Liver Disease. Gastroenterology 2020 ; 158 : 1999-2014.
PRATIQUE DU MÉDECIN DE FAMILLE 2021 ; 16(10) : 4-8











