La cardiomiopatia ipertrofica (HCM) è la cardiomiopatia genetica più comune in tutto il mondo e colpisce circa 1 persona su 500. Gli attuali interventi terapeutici comprendono l’ottimizzazione dello stile di vita, i farmaci, le terapie di riduzione del setto e, raramente, il trapianto di cuore. I progressi nella comprensione delle varianti genetiche che causano la malattia nella CMI e i loro meccanismi molecolari hanno aperto il potenziale per terapie mirate e l’implementazione della medicina di precisione e personalizzata. I risultati della ricerca preclinica sono promettenti e sollevano la questione della possibilità di una cura per alcuni sottotipi di CMI in futuro.
La cardiomiopatia ipertrofica (HCM) è una malattia miocardica primaria caratterizzata da un’inspiegabile ipertrofia ventricolare sinistra che si verifica in assenza di condizioni di stress anomale, come l’ipertensione o la stenosi aortica. La presentazione clinica della CMI è molto variabile e va da individui asintomatici a quelli con sintomi gravi come insufficienza cardiaca, aritmie e morte cardiaca improvvisa (SCD). Anche la base genetica della CMI è eterogenea, con mutazioni in almeno otto geni del sarcomero identificati come patogeni e una percentuale significativa di casi associati a varianti genetiche di significato indeterminato (VUS).
L’attuale panorama terapeutico per la CMI
Misure relative allo stile di vita: L’ottimizzazione dello stile di vita è fondamentale per la gestione della CMI. Evitare l’ipertensione e l’obesità incontrollate è essenziale per prevenire l’esacerbazione del fenotipo della CMI. Studi recenti hanno anche sottolineato i benefici dell’esercizio fisico regolare, da leggero a moderato, per migliorare la qualità della vita e gli esiti cardiovascolari nei pazienti con HCM. In passato, i pazienti affetti da HCM venivano messi in guardia da un’attività fisica intensa, ma la ricerca recente suggerisce che l’esercizio fisico moderato può essere sicuro e benefico.
Terapia farmacologica: farmaci come i betabloccanti e i calcioantagonisti sono spesso utilizzati per alleviare i sintomi e ridurre il rischio di complicazioni della CMI. Questi farmaci agiscono abbassando la frequenza cardiaca e riducendo la contrattilità del cuore, il che aiuta a ridurre l’ostruzione del tratto di deflusso ventricolare sinistro. Terapie più recenti come il mavacamten, un inibitore della miosina, hanno mostrato risultati promettenti in studi recenti, migliorando i sintomi soggettivi e oggettivi nei pazienti con CMI ostruttiva. Il Mavacamten modifica direttamente le catene pesanti della β-miosina per ridurre l’affinità tra actina e miosina e quindi normalizzare la funzione cardiaca.
Terapie interventistiche: Le procedure interventistiche, tra cui la miectomia settale e l’ablazione settale alcolica, vengono eseguite per alleviare l’ostruzione del tratto di deflusso del ventricolo sinistro (LVOT). La miectomia settale è un intervento chirurgico in cui viene rimossa una parte del setto ispessito per migliorare il flusso sanguigno dal ventricolo sinistro. Questo metodo è tipicamente utilizzato nei pazienti più giovani. L’ablazione settale con alcol, un’alternativa meno invasiva, è più comunemente eseguita nei pazienti anziani. Consiste nell’iniettare alcol nelle arterie settali per provocare un infarto controllato e ridurre l’ipertrofia. Nonostante i tassi più elevati di aritmie e cicatrici rispetto alla miectomia settale, l’ablazione settale con alcol può ottenere risultati eccellenti nei centri più esperti.
Prevenzione della morte cardiaca improvvisa: i defibrillatori cardioverter impiantabili (ICD) sono raccomandati per le persone ad alto rischio di SCD. I progressi nella stratificazione del rischio e la disponibilità di ICD hanno ridotto in modo significativo la mortalità legata all’HCM. La valutazione del rischio viene eseguita utilizzando calcolatori di rischio basati su linee guida che tengono conto di fattori come lo spessore del setto, la presenza di tachicardia ventricolare non sostenuta e la storia familiare.
Trapianto di cuore: in casi rari, quando i pazienti non rispondono a tutti gli altri trattamenti e sviluppano un’insufficienza cardiaca avanzata, può essere necessario un trapianto di cuore. Questi pazienti rappresentano circa l’1,6% delle persone in attesa di trapianto di cuore negli Stati Uniti. Nonostante la rarità, il tasso di sopravvivenza dopo il trapianto di cuore nei pazienti con CMI è simile a quello dei pazienti con altre cardiomiopatie.
Terapia genica: la nuova frontiera?
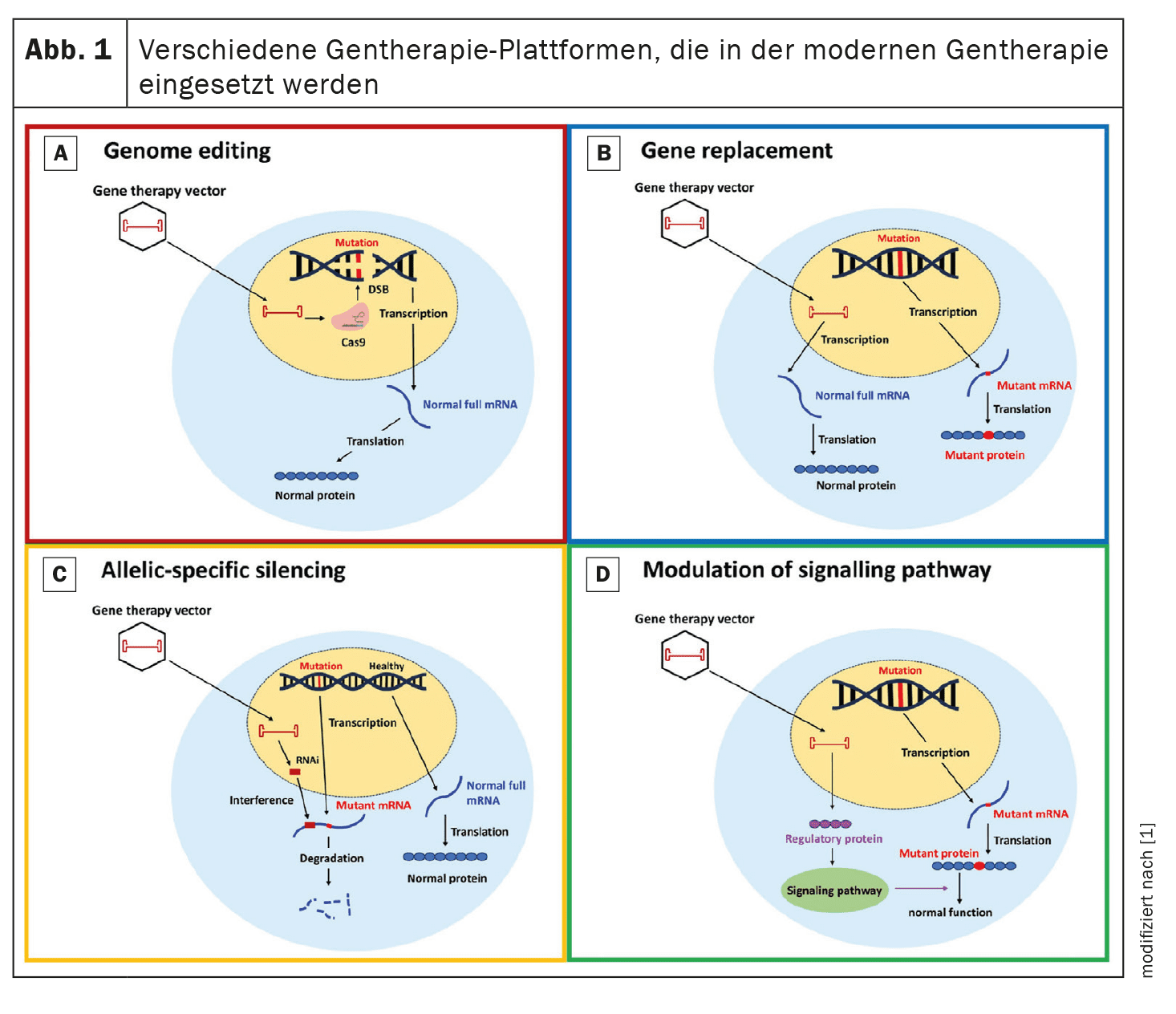
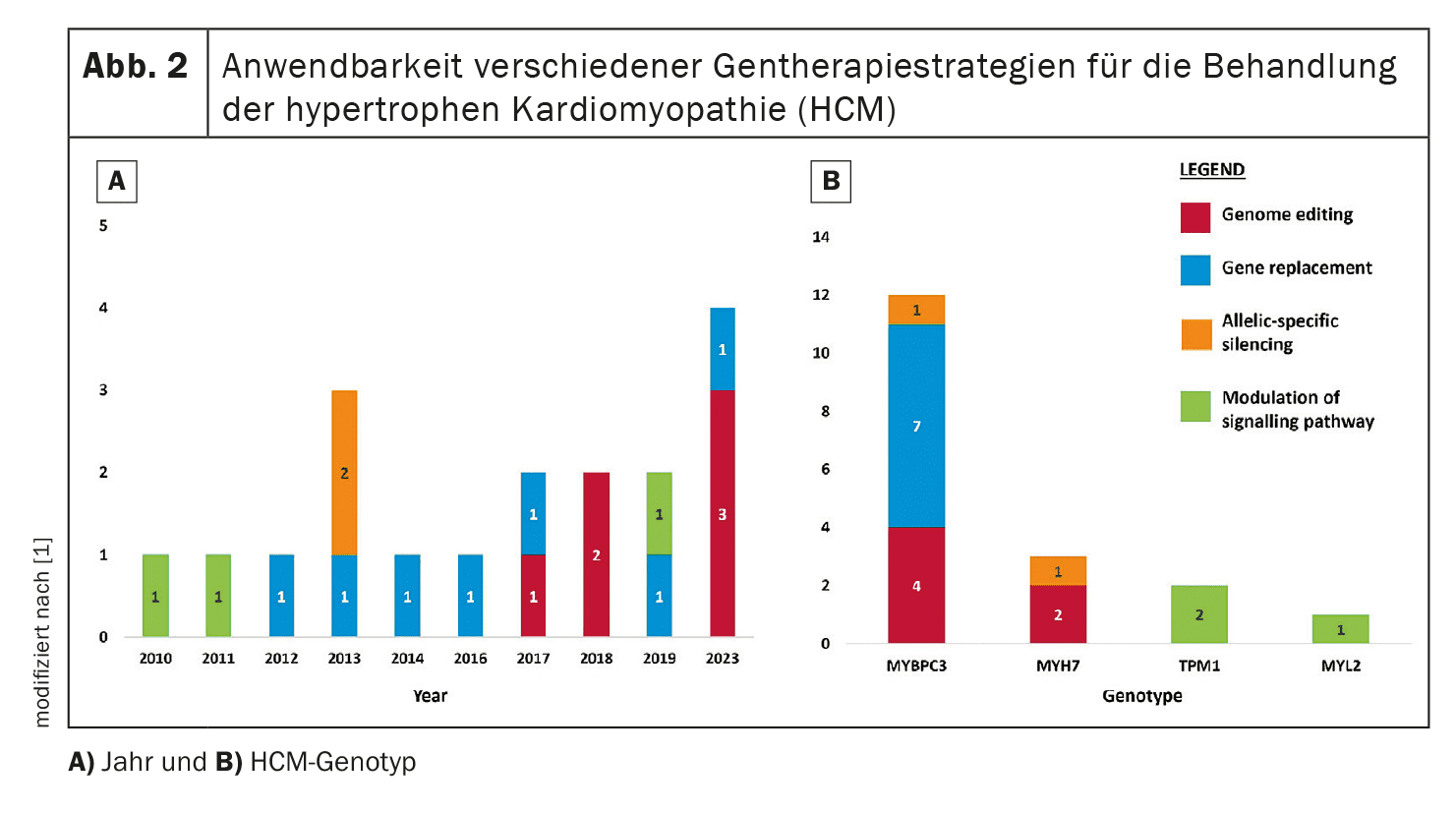
La terapia genica mira a correggere o attenuare le mutazioni genetiche responsabili della CMI. In questa rassegna vengono analizzati quattro approcci principali: editing del genoma, sostituzione del gene, silenziamento allele-specifico e modulazione del percorso.
Editing del genoma: l’editing del genoma con la tecnologia CRISPR/Cas9 ha mostrato il potenziale di correggere le mutazioni genetiche associate alla CMI in modelli preclinici.
CRISPR/Cas9 utilizza una nucleasi programmabile che genera rotture mirate del doppio filamento di DNA, che possono essere riparate dalla giunzione terminale non omologa (NHEJ) o dalla ricombinazione omologa (HDR).
Tuttavia, sfide come gli effetti fuori bersaglio e la necessità di metodi di somministrazione precisi rimangono ostacoli significativi.
La ricerca si concentra sul miglioramento della specificità e dell’efficienza di questa tecnologia, per ridurre al minimo le alterazioni genetiche indesiderate. Sostituzione genica: la terapia di sostituzione genica prevede l’introduzione di una copia funzionale del gene mutato.
Questo approccio è particolarmente importante per le mutazioni che portano all’aploinsufficienza.
Gli studi in corso, come l’uso di vettori di virus adeno-associati (AAV), mirano a valutare l’efficacia e la sicurezza di questa strategia nei pazienti con CMI.
Ad esempio, la sostituzione genica del gene MYBPC3, che è frequentemente mutato nella CMI, è attualmente oggetto di studi clinici.
Negli studi preclinici, la sostituzione del gene difettoso ha dimostrato di migliorare la funzione miocardica e di prevenire i fenotipi della CMI.
Silenziamento allele-specifico: il silenziamento allele-specifico mira a sopprimere l’allele mutante, preservando la funzione dell’allele normale. Questo approccio utilizza piccoli RNA interferenti (siRNA) per degradare selettivamente l’mRNA mutante e ridurre la produzione di proteine anomale. Questo metodo è particolarmente utile per le mutazioni dominanti, dove la proteina mutante ha un effetto deleterio. Gli studi preclinici hanno dimostrato che i siRNA possono ridurre efficacemente l’espressione dell’allele mutante, con conseguente miglioramento della funzione cardiaca e riduzione dell’ipertrofia.
Modulazione delle vie di segnalazione: La modulazione delle vie di segnalazione chiave coinvolte nella patogenesi della CMI offre un altro approccio terapeutico. Ad esempio, l’aumento dell’espressione di SERCA2a, una proteina coinvolta nell’equilibrio del calcio, ha mostrato un potenziale nei modelli preclinici per ridurre l’ipertrofia e migliorare la funzione cardiaca. Un altro approccio prevede la modulazione della fosforilazione della catena leggera regolatrice della miosina (myosin RLC) per migliorare la funzione contrattile cardiaca.
Sfide e direzioni future
Nonostante i progressi promettenti, ci sono diverse sfide che ostacolano la traduzione clinica delle terapie geniche per la CMI. Questi includono:
- Problemi di sicurezza: i rischi associati ai vettori AAV, come le risposte immunitarie e gli effetti fuori bersaglio, devono essere affrontati in modo approfondito. I recenti decessi associati alle terapie geniche basate su AAV ricordano i potenziali pericoli e la necessità di migliorare ulteriormente la sicurezza di queste tecnologie.
- Metodi di somministrazione: La somministrazione efficiente e mirata di terapie geniche al tessuto cardiaco rimane una sfida tecnica. Lo sviluppo di vettori con un tropismo cardiaco specifico e migliorato potrebbe aiutare a minimizzare le trasduzioni fuori bersaglio e a ridurre le dosi richieste.
- Eterogeneità genetica: la diversità genetica della CMI rende difficile lo sviluppo di approcci universali di terapia genica. Poiché la CMI è causata da un gran numero di mutazioni, lo sviluppo di gRNA specifici per ogni mutazione e la limitazione da parte delle sequenze PAM richiedono ulteriori ricerche e ottimizzazioni.
- Etica e accesso equo: garantire che le terapie geniche siano accessibili a tutti i pazienti, indipendentemente dallo status socio-economico, è fondamentale. La distribuzione equa di questi trattamenti avanzati deve essere prioritaria per evitare disuguaglianze nella salute.
Conclusione
I progressi nella terapia genica sono molto promettenti per il futuro trattamento della CMI. Sebbene la ricerca preclinica abbia mostrato un potenziale, la traduzione di queste terapie nella pratica clinica richiederà sfide scientifiche, tecniche ed etiche significative. Occorre garantire un accesso equo a questi trattamenti avanzati per realizzare il loro pieno potenziale di miglioramento dei risultati per i pazienti affetti da HCM. Ulteriori ricerche e lo sviluppo di terapie geniche sicure ed efficaci potrebbero rivoluzionare il modo in cui la CMI e altre cardiomiopatie genetiche vengono trattate.
Fonte:
- Paratz ED, Mundisugih J, Rowe SJ, et al.: Gene Therapy in Cardiology: Is a Cure for Hypertrophic Cardiomyopathy on the Horizon? Can J Cardiol 2024 May; 40(5): 777–788. doi: 10.1016/j.cjca.2023.11.024. Epub 2023 Nov 25. PMID: 38013066.
CARDIOVASC 2024; 23(2): 24–25