La miocardiopatía hipertrófica (MCH) es la miocardiopatía genética más común en todo el mundo y afecta aproximadamente a 1 de cada 500 personas. Las intervenciones terapéuticas actuales incluyen la optimización del estilo de vida, la medicación, las terapias de reducción septal y, en raras ocasiones, el trasplante de corazón. Los avances en la comprensión de las variantes genéticas causantes de la enfermedad en la MCH y sus mecanismos moleculares han abierto el potencial de las terapias dirigidas y la aplicación de la medicina de precisión y personalizada. Los resultados de la investigación preclínica son prometedores y plantean la cuestión de si en el futuro será posible la curación de algunos subtipos de MCH.
La miocardiopatía hipertrófica (MCH) es una enfermedad miocárdica primaria caracterizada por una hipertrofia ventricular izquierda inexplicable que se produce en ausencia de condiciones de estrés anormales como la hipertensión o la estenosis aórtica. La presentación clínica de la MCH es muy variable, desde individuos asintomáticos hasta aquellos con síntomas graves como insuficiencia cardiaca, arritmias y muerte súbita cardiaca (MSC). La base genética de la MCH también es heterogénea, con mutaciones en al menos ocho genes del sarcómero identificadas como patogénicas y una proporción significativa de casos asociados a variantes genéticas de significado indeterminado (VUS).
Panorama terapéutico actual de la MCH
Medidas relativas al estilo de vida: La optimización del estilo de vida es crucial para el tratamiento de la MCH. Evitar la hipertensión no controlada y la obesidad es esencial para prevenir la exacerbación del fenotipo de la MCH. Estudios recientes también han destacado los beneficios del ejercicio regular, de ligero a moderado, para mejorar la calidad de vida y los resultados cardiovasculares en pacientes con MCH. Anteriormente, a los pacientes con MCH se les desaconsejaba la actividad física intensa, pero investigaciones recientes sugieren que el ejercicio moderado puede ser seguro y beneficioso.
Terapia farmacológica: A menudo se utilizan fármacos como los betabloqueantes y los antagonistas del calcio para aliviar los síntomas y reducir el riesgo de complicaciones de la MCH. Estos fármacos actúan disminuyendo la frecuencia cardiaca y reduciendo la contractilidad del corazón, lo que ayuda a reducir la obstrucción del tracto de salida del ventrículo izquierdo. Terapias más recientes como el mavacamten, un inhibidor de la miosina, han mostrado resultados prometedores en estudios recientes, mejorando los síntomas subjetivos y objetivos en pacientes con MCH obstructiva. El mavacamten modifica directamente las cadenas pesadas de β-miosina para reducir la afinidad entre la actina y la miosina y normalizar así la función cardiaca.
Terapias de intervención: Los procedimientos intervencionistas, como la miectomía septal y la ablación septal con alcohol, se realizan para aliviar la obstrucción del tracto de salida del ventrículo izquierdo (TSVI). La miectomía septal es una intervención quirúrgica en la que se extirpa una porción del tabique engrosado para mejorar el flujo sanguíneo del ventrículo izquierdo. Este método suele utilizarse en pacientes jóvenes. La ablación septal con alcohol, una alternativa menos invasiva, se realiza con más frecuencia en pacientes de más edad. Consiste en inyectar alcohol en las arterias septales para provocar un infarto controlado y reducir la hipertrofia. A pesar de las mayores tasas de arritmias y cicatrices en comparación con la miectomía septal, la ablación septal con alcohol puede lograr excelentes resultados en centros experimentados.
Prevención de la muerte súbita cardiaca: Los desfibriladores cardioversores implantables (DAI) se recomiendan a las personas con alto riesgo de muerte súbita cardiaca . Los avances en la estratificación del riesgo y la disponibilidad de los DAI han reducido significativamente la mortalidad relacionada con la MCH. La evaluación del riesgo se realiza mediante calculadoras de riesgo basadas en directrices que tienen en cuenta factores como el grosor septal, la presencia de taquicardia ventricular no sostenida y los antecedentes familiares.
Trasplante de corazón: En raras ocasiones, cuando los pacientes no responden a todos los demás tratamientos y desarrollan una insuficiencia cardíaca avanzada, puede ser necesario un trasplante de corazón. Estos pacientes constituyen aproximadamente el 1,6% de los que esperan un trasplante de corazón en EE.UU.. A pesar de su rareza, la tasa de supervivencia tras un trasplante de corazón en pacientes con MCH es similar a la de los pacientes con otras miocardiopatías.
Terapia génica: ¿la nueva frontera?
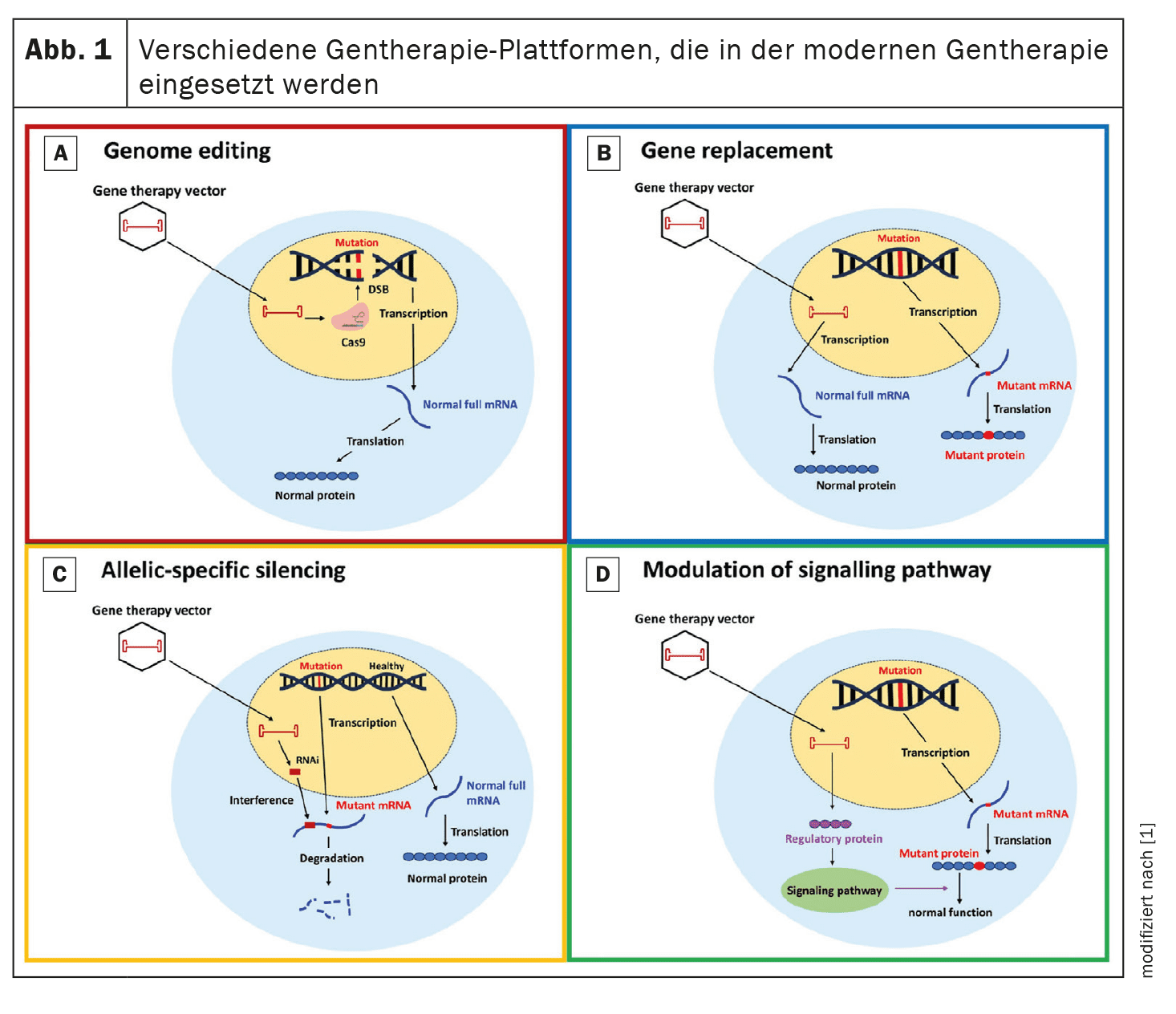
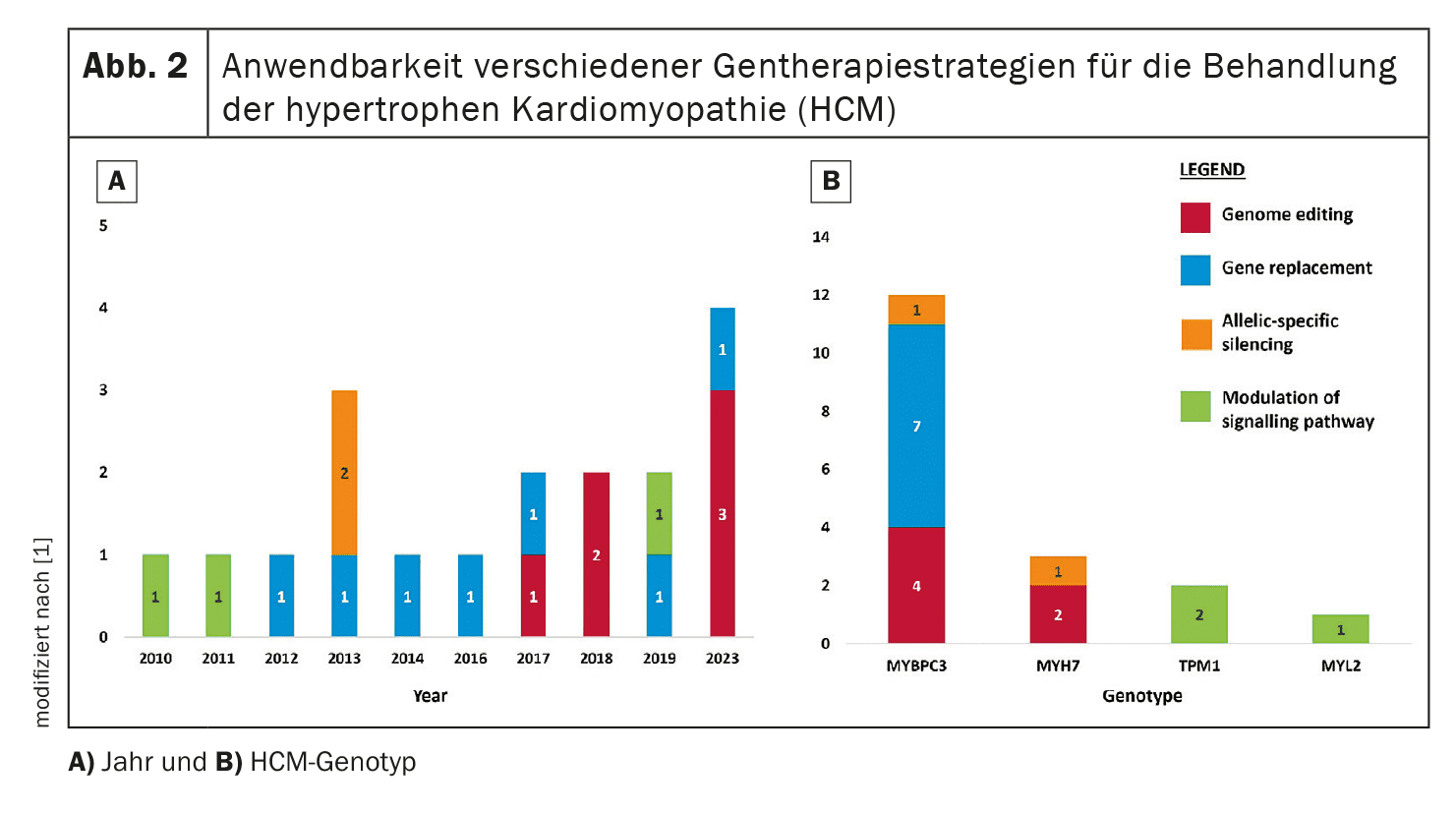
La terapia génica pretende corregir o atenuar las mutaciones genéticas responsables de la MCH. En esta revisión se analizan cuatro enfoques principales: La edición del genoma, la sustitución de genes, el silenciamiento alelo-específico y la modulación de vías.
Edición del genoma: La edición del genoma con la tecnología CRISPR/Cas9 ha demostrado su potencial para corregir las mutaciones genéticas asociadas a la MCH en modelos preclínicos.
CRISPR/Cas9 utiliza una nucleasa programable que genera roturas selectivas de la doble cadena del ADN que pueden repararse mediante la unión de extremos no homólogos (NHEJ) o la recombinación homóloga (HDR).
Sin embargo, retos como los efectos fuera del objetivo y la necesidad de métodos de administración precisos siguen siendo obstáculos importantes.
La investigación se centra en mejorar la especificidad y eficacia de esta tecnología para minimizar las alteraciones genéticas no intencionadas. Sustitución génica: La terapia de sustitución génica implica la introducción de una copia funcional del gen mutado.
Este enfoque es especialmente relevante para las mutaciones que conducen a la haploinsuficiencia.
Los estudios en curso, como el uso de vectores de virus adenoasociados (AAV), pretenden evaluar la eficacia y seguridad de esta estrategia en pacientes con MCH.
Por ejemplo, actualmente se está investigando en ensayos clínicos la sustitución génica del gen MYBPC3, frecuentemente mutado en la MCH.
En estudios preclínicos, se ha demostrado que la sustitución del gen defectuoso mejora la función miocárdica y previene los fenotipos de MCH.
Silenciamiento alelo-específico: El silenciamiento alelo-específico pretende suprimir el alelo mutante preservando la función del alelo normal. Este enfoque utiliza pequeños ARN de interferencia (siARN) para degradar selectivamente el ARNm mutante y reducir la producción de proteínas anormales. Este método es especialmente útil para las mutaciones dominantes en las que la proteína mutante tiene un efecto deletéreo. Los estudios preclínicos han demostrado que los ARNsi pueden reducir eficazmente la expresión del alelo mutante, lo que se traduce en una mejora de la función cardiaca y una reducción de la hipertrofia.
Modulación de las vías de señalización: La modulación de las vías de señalización clave implicadas en la patogénesis de la MCH ofrece otro enfoque terapéutico. Por ejemplo, el aumento de la expresión de SERCA2a, una proteína implicada en el equilibrio del calcio, ha mostrado potencial en modelos preclínicos para reducir la hipertrofia y mejorar la función cardiaca. Otro enfoque consiste en modular la fosforilación de la cadena ligera reguladora de la miosina (RLC de la miosina) para mejorar la función contráctil cardiaca.
Retos y orientaciones futuras
A pesar de los prometedores avances, existen varios retos que dificultan la traslación clínica de las terapias génicas para la MCH. Entre ellas se incluyen:
- Preocupaciones por la seguridad: Es necesario abordar a fondo los riesgos asociados a los vectores AAV, como las respuestas inmunitarias y los efectos fuera del objetivo. Las recientes muertes asociadas a las terapias génicas basadas en AAV son un recordatorio de los peligros potenciales y de la necesidad de seguir mejorando la seguridad de estas tecnologías.
- Métodos de administración : La administración eficaz y selectiva de terapias génicas en el tejido cardiaco sigue siendo un reto técnico. El desarrollo de vectores con tropismo cardíaco específico y mejorado podría ayudar a minimizar las transducciones fuera del objetivo y a reducir las dosis necesarias.
- Heterogeneidad genética: La diversidad genética de la MCH dificulta el desarrollo de enfoques universales de terapia génica. Dado que la MCH está causada por un gran número de mutaciones, el desarrollo de ARNg específicos para cada mutación y la limitación mediante secuencias PAM requiere más investigación y optimización.
- Ética y acceso equitativo: Garantizar que las terapias génicas sean accesibles a todos los pacientes, independientemente de su estatus socioeconómico, es crucial. Debe darse prioridad a la distribución equitativa de estos tratamientos avanzados para evitar las desigualdades sanitarias.
Conclusión
Los avances en terapia génica son muy prometedores para el futuro tratamiento de la MCH. Aunque la investigación preclínica ha demostrado su potencial, trasladar estas terapias a la práctica clínica requerirá importantes retos científicos, técnicos y éticos. Debe garantizarse un acceso equitativo a estos tratamientos avanzados para aprovechar todo su potencial de mejora de los resultados de los pacientes con MCH. Una mayor investigación y desarrollo de terapias génicas seguras y eficaces podría revolucionar la forma de tratar la MCH y otras miocardiopatías genéticas.
Fuente:
- Paratz ED, Mundisugih J, Rowe SJ, et al.: Gene Therapy in Cardiology: Is a Cure for Hypertrophic Cardiomyopathy on the Horizon? Can J Cardiol 2024 May; 40(5): 777–788. doi: 10.1016/j.cjca.2023.11.024. Epub 2023 Nov 25. PMID: 38013066.
CARDIOVASC 2024; 23(2): 24–25