Il mesotelioma pleurico maligno è un tumore aggressivo che ha origine nella pleura. I pazienti hanno una breve aspettativa di vita dopo la diagnosi, anche a causa delle limitate opzioni di trattamento. L’esposizione alle fibre di amianto è considerata il principale fattore di rischio per lo sviluppo del mesotelioma pleurico. Poiché la malattia progredisce in modo insidioso nel corso di decenni, spesso viene scoperta molto tardi.
Può sostenere il test ECM nella nostra piattaforma di apprendimento dopo aver esaminato i materiali consigliati. Clicchi sul seguente pulsante:
Il mesotelioma pleurico maligno è un tumore aggressivo che ha origine nella pleura. I pazienti hanno una breve aspettativa di vita dopo la diagnosi, anche a causa delle limitate opzioni di trattamento. L’esposizione alle fibre di amianto è considerata il principale fattore di rischio per lo sviluppo del mesotelioma pleurico. Poiché la malattia progredisce in modo insidioso nel corso di decenni, spesso viene scoperta molto tardi. Per questo motivo, ai pazienti viene spesso diagnosticato un mesotelioma pleurico inoperabile, che si trova già in uno stadio avanzato. Questo limita le misure terapeutiche e si riflette anche in una bassa aspettativa di vita di circa 12 mesi dopo la diagnosi.
Sviluppo del mesotelioma pleurico
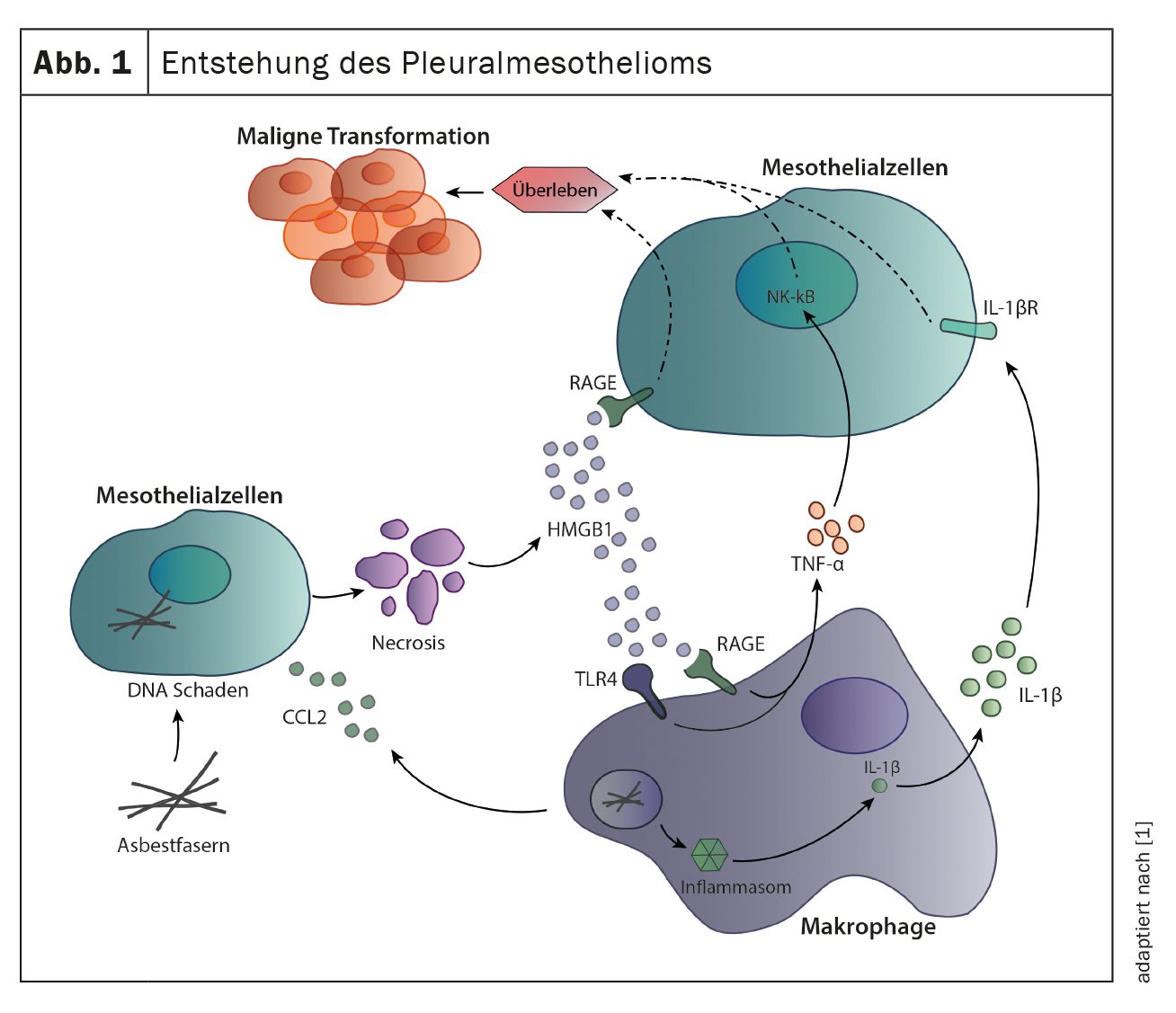
La causa più comune dello sviluppo del mesotelioma pleurico è l’esposizione alle fibre di amianto, di solito decenni prima della comparsa dei primi sintomi. L’inalazione delle fibre porta all’infiammazione cronica della pleura, che contribuisce alla trasformazione maligna delle cellule mesoteliali. Le fibre possono causare direttamente danni al DNA nelle cellule mesoteliali, portando alla morte cellulare e al rilascio di mediatori infiammatori come HMGB1 e CCL2. I mediatori infiammatori, in particolare CCL2, reclutano i macrofagi e agiscono direttamente sulle cellule mesoteliali legandosi ai recettori RAGE sulle cellule mesoteliali e inducendo la loro divisione cellulare e la migrazione. I macrofagi reclutati contribuiscono anche all’infiammazione locale e alla proliferazione delle cellule mesoteliali. L’assorbimento delle fibre di amianto da parte dei macrofagi stimola il sensore immunitario inflammasoma, che porta alla secrezione di IL-1β. Oltre all’IL-1β, i macrofagi secernono anche TNF-α; entrambe le citochine contribuiscono alla sopravvivenza delle cellule mesoteliali e alla loro ulteriore trasformazione maligna (Fig. 1) [1].
Firme geniche
Circa l’80% dei tumori ha un’esposizione all’amianto avvenuta decenni prima. Una predisposizione genetica familiare dovuta a mutazioni germinali nel gene BAP1può aumentare la probabilità di sviluppare il mesotelioma pleurico. A differenza di altre malattie tumorali, in cui sono spesso presenti mutazioni attivanti negli oncogeni, il mesotelioma pleurico è caratterizzato principalmente dall’alterazione e dalla perdita di intere parti di cromosomi e da mutazioni nei geni soppressori tumorali. Per molto tempo, è stata prestata poca attenzione ai cambiamenti genetici nel mesotelioma pleurico, a causa del basso tasso di mutazioni di questo tipo di cancro e dei pochi casi in cui sarebbe possibile una terapia mirata. Le mutazioni e le delezioni più frequenti riguardano i geni BAP1, CDKN2A e NF2. BAP1 è un gene soppressore del tumore coinvolto nella riparazione del danno al DNA e nel controllo del ciclo cellulare. BAP1 è alterato in circa il 45% di tutti i mesoteliomi pleurici, anche se questo dato può variare tra le diverse istologie.
Anche CDKN2A è un gene soppressore del tumore che viene frequentemente cancellato nel mesotelioma pleurico. Le alterazioni di questo gene si trovano in circa il 47% di tutti i tumori. CDKN2A svolge un ruolo importante nella regolazione del ciclo cellulare, codificando per l’inibitore della chinasi ciclina-dipendente 4 e 6. La perdita di questo gene porta quindi alla segnalazione pro-mitotica e alla sopravvivenza cellulare.
L‘NF2 è anche coinvolto nella regolazione del ciclo cellulare ed è alterato in circa il 32% di tutti i mesoteliomi pleurici. La NF2 regola la via di segnalazione Hippo attraverso le proteine YAP e TAZ. L’inattivazione di NF2 porta all’iperattivazione di YAP e alla divisione cellulare incontrollata.
Solo pochi mesoteliomi pleurici presentano mutazioni nei geni che possono essere bersagliati da inibitori di piccole molecole. In uno studio abbiamo potuto dimostrare che in circa il 5% di tutti i mesoteliomi pleurici sono mutati i geni ALK, KRAS EGFR, PDGFRA/B, ERBB2 o FGFR3, che potrebbero essere trattati con terapie mirate [2]. Ulteriori studi devono ancora dimostrare l’efficacia di questo trattamento nel mesotelioma pleurico.
Ambiente tumorale
L’interazione di diversi tipi di cellule, come le cellule immunitarie, le cellule stromali, le cellule tumorali e le cellule endoteliali dei vasi sanguigni nel tumore, è molto complessa e non ancora completamente esplorata nel mesotelioma pleurico. A seconda del tipo di tumore e del paziente, l’eterogeneità dei tipi di cellule e delle funzioni è grande. Per questo motivo, è difficile sviluppare terapie che agiscano direttamente sull’ambiente tumorale. Inoltre, le cellule immunitarie hanno spesso un fenotipo inibitorio e regolatorio, rappresentato principalmente da cellule T regolatorie, macrofagi di tipo 2 e cellule soppressorie mieloidi.
I macrofagi sono le cellule immunitarie più comuni nel mesotelioma pleurico e vengono reclutati dal sangue sotto forma di monociti da CCL2, che viene secreto dalle cellule mesoteliali. I macrofagi associati al tumore esprimono un fenotipo immunosoppressivo di tipo 2 e supportano la proliferazione delle cellule mesoteliali maligne e la crescita tumorale, correlando anche una prognosi sfavorevole. Le seconde cellule immunitarie più abbondanti nel mesotelioma pleurico sono i linfociti T, con tutti i sottotipi presenti, come le cellule T helper CD4+, le cellule T citotossiche CD8+ e le cellule T regolatorie FoxP3+. Le cellule T citotossiche spesso esprimono marcatori come Lag-3, Tim-3, PD-1, che definiscono un fenotipo non reattivo. Queste cellule T non sono più in grado di svolgere funzioni effettrici, il che offre alle cellule tumorali un vantaggio di sopravvivenza. La presenza di cellule T nel tumore è associata positivamente alla sopravvivenza nel mesotelioma pleurico, a seconda dello studio, ma ciò può variare a seconda dell’istologia e del fenotipo specifico delle cellule T. Pertanto, le cellule T regolatorie nel tumore sono associate a una sopravvivenza più breve. Altre cellule immunitarie soppressive nel tumore sono le cellule soppressorie mieloidi, che possono rappresentare fino al 10% di tutte le cellule immunitarie infiltranti. Hanno un effetto negativo sulle cellule T e possono inibire la loro divisione cellulare.
Patologia
Il mesotelioma pleurico si divide in tre sottotipi istologici, epitelioide (circa l’80% dei casi), bifasico e sarcomatoide. Il sottotipo bifasico è caratterizzato da una combinazione di strutture epitelioidi e sarcomatoidi.
I sottotipi istologici differiscono principalmente per l’aspettativa di vita. I pazienti con mesotelioma pleurico epitelioide hanno un’aspettativa di vita più lunga rispetto ai pazienti con mesotelioma pleurico bifasico o sarcomatoide. Inoltre, i pazienti con un sottotipo epitelioide di solito traggono beneficio dalla resezione, mentre gli altri sottotipi non beneficiano della chirurgia. A volte la diagnosi di mesotelioma pleurico è difficile a causa della morfologia cellulare, perché da un lato la pleura è spesso alterata da cambiamenti infiammatori o sono presenti metastasi di un’altra malattia maligna. Pertanto, è necessaria un’ulteriore analisi di una biopsia pleurica mediante l’immunoistochimica (IHC) di due marcatori del mesotelioma, come la calretina, la podoplanina, il tumore di Wilms-1 (WT-1) o la citocheratina 5/6. Inoltre, altri carcinomi possono essere esclusi mediante la colorazione con CEA, Ber-EP4, pancitoceratina o claudina-4. Il mesotelioma pleurico con un cambiamento simile alle cellule squamose può essere distinto dal carcinoma a cellule squamose mediante la colorazione dei marcatori p40 e p63. Inoltre, spesso si verificano alterazioni genetiche nei geni BAP1 e CDKN2A, con conseguente perdita di espressione di queste proteine nel tumore. Per questo motivo, l’analisi immunoistochimica dell’espressione di BAP1 e MTAP (MTAP viene analizzato come proxy di CDKN2A, poiché questi geni si trovano direttamente adiacenti l’uno all’altro sul segmento cromosomico 9p21 e spesso è presente una co-delezione) può essere utile per fare una diagnosi definitiva.
Sintomi, diagnosi e stadiazione
I pazienti spesso si presentano con sintomi inspiegabili di dispnea, dolore toracico e perdita di peso. I pazienti spesso presentano un versamento pleurico unilaterale. La diagnosi di mesotelioma pleurico viene fatta attraverso diversi esami: i) Esami radiologici, compresa la TAC del torace, ii) biopsia pleurica mediante toracoscopia per confermare ulteriormente la diagnosi di mesotelioma pleurico e determinare l’istologia. Una biopsia pleurica deve quindi sempre estendersi al grasso subpleurico ed essere prelevata da tre o più localizzazioni diverse. Per evitare il rischio di impianto di cellule tumorali nella parete toracica, devono essere utilizzati solo 1-2 siti di ingresso toracoscopici [3]. Preferibilmente, questi vengono posizionati nello stesso spazio intercostale della resezione macroscopicamente completa pianificata nel corso successivo.
La stadiazione viene eseguita mediante tomografia a emissione di positroni (PET-CT) ed è integrata dalla mediastinoscopia o dall’ecografia endobronchiale (EBUS) se si sospetta un coinvolgimento linfonodale mediastinico, dalla toracoscopia controlaterale se si sospetta un coinvolgimento pleurico controlaterale o dalla laparoscopia se si sospetta un coinvolgimento peritoneale. La risonanza magnetica (RM) del torace può anche fornire informazioni preziose ai fini della stadiazione sull’infiltrazione nel diaframma, nella parete toracica, nel pericardio o nel mediastino.
Interventi chirurgici
Il trattamento deve essere discusso in un tubmorboard interdisciplinare con rappresentanti specializzati di chirurgia toracica, oncologia, radiooncologia, patologia e radiologia. Se lo stadio del tumore e le condizioni generali del paziente lo qualificano per un concetto di trattamento multimodale, la chemioterapia neoadiuvante con citostatici contenenti platino e antagonisti dell’acido folico è seguita da una nuova stadiazione mediante PET-CT per rivalutare l’operabilità. A causa della situazione anatomica con la vicinanza alle strutture mediastiniche, non è possibile mantenere distanze di sicurezza sufficienti durante la resezione del MPM. Per resezione radicale si intende quindi una resezione macroscopicamente completa con l’obiettivo della massima citoriduzione, ma con il rischio di un tumore microscopico residuo [4]. Una resezione macroscopicamente completa può essere ottenuta mediante una pneumonectomia extrapleurica (EPP) o una pleurectomia estesa e decorticazione (EPD) con conservazione del parenchima polmonare [4]. Mentre l’EPP comporta una resezione in blocco del polmone colpito con la pleura viscerale e parietale, oltre al diaframma e al pericardio, nell’EPD solo la pleura parietale e viscerale viene staccata e rimossa insieme al diaframma e al pericardio colpiti, lasciando il polmone intatto [4]. In assenza di segni di coinvolgimento pericardico o diaframmatico, si può optare per la pleurectomia isolata e la decorticazione (PD). In tutte le resezioni chirurgiche, deve essere eseguita anche una linfoadenectomia mediastinica sistematica. Negli ultimi anni, c’è stato un crescente passaggio dall’EPP all’EPD, in quanto il parenchima polmonare e le riserve funzionali vengono preservate, permettendo al paziente di avere una migliore qualità di vita. L’EPP è anche associata a una maggiore morbilità e mortalità perioperatoria. La PPE deve essere presa in considerazione solo in casi selezionati, con infiltrazione estesa del parenchima polmonare e riserve cardiopolmonari sufficienti, e deve essere eseguita solo in centri esperti.
Nei pazienti in cui la citoriduzione massima mediante resezione completa macroscopica non è un’opzione, la recidiva del versamento pleurico sintomatico può essere prevenuta con un approccio palliativo. Nel caso di polmoni estesi, ciò avviene mediante pleurodesi toracoscopica con talco, nel caso di polmoni cronicamente intrappolati mediante un sistema di cateteri tunnellizzati sottocute, che possono essere utilizzati anche per il drenaggio regolare dell’effusione in ambiente domestico.
La VATS-PP palliativa è raccomandata per controllare i versamenti pleurici ricorrenti nei pazienti sufficientemente idonei al trattamento chirurgico e che non possono trarre beneficio dalla pleurodesi chimica (o dopo una pleurodesi non riuscita) o dai cateteri indwelling [5].
Terapia di sistema
Dal 2004, i pazienti sono stati trattati con una terapia combinata sistemica di pemetrexed e chemioterapia a base di platino. L’introduzione del bevacizumab, un inibitore dell’angiogenesi, in combinazione con cisplatino/pemetrexed è stata in grado di aumentare l’aspettativa di vita di circa 2,5 mesi. Visto il successo degli inibitori del checkpoint immunitario in vari tumori solidi, è stata testata la terapia combinata di ipilimumab (anticorpo anti-CTLA-4) e nivolumab (anticorpo anti-PD-1). Questa terapia ha mostrato un miglioramento significativo della sopravvivenza nel mesotelioma pleurico sarcomatoide ed epitelioide con PD-L1>1% [6]. Pertanto, questo trattamento è stato approvato dalla FDA e dall’EMA come terapia di prima linea nel 2020. Tuttavia, nelle linee di trattamento successive, il mesotelioma pleurico rimane ancora una malattia senza trattamenti standardizzati e i pazienti vengono spesso arruolati in studi clinici.
Messaggi da portare a casa
- In pazienti selezionati con MPM in fase iniziale e riserve cardiopolmonari sufficienti, si raccomanda la massima citoriduzione chirurgica mediante resezione completa macroscopica.
- Una resezione macroscopicamente completa dovrebbe sempre essere effettuata come parte di un concetto di terapia multimodale in combinazione con la chemioterapia.
- Le raccomandazioni e le decisioni sul trattamento devono sempre essere prese in un comitato interdisciplinare di oncologia toracica, alla presenza di oncologi, radioterapisti, pneumologi e chirurghi toracici.
- La terapia di prima linea nei pazienti non operabili si basa su nivolumab e ipilimumab per i pazienti con mesotelioma pleurico epitelioide con espressione di PD-L1 >1% e per tutti gli altri sottotipi istologici. Altrimenti, il trattamento con platino-pemetrexed e bevacizumab è l’altra opzione.
Letteratura:
- Hiltbrunner S, Mannarino L, Kirschner MB, et al.: Tumor Immune Microenvironment and Genetic Alterations in Mesothelioma, Frontiers in oncology 11 (2021) 660039.
- Hiltbrunner S, Fleischmann Z, Sokol E, Curioni-Fontecedro A: 1734P Genomic landscape of pleural and peritoneal mesothelioma tumors, Annals of Oncology 32 (2021) S1200.
- Kindler HL, Ismaila N, Armato SG, et al.: Treatment of Malignant Pleural Mesothelioma: American Society of Clinical Oncology Clinical Practice Guideline, J Clin Oncol 36(13) (2018): 1343–1373.
- Rice D, Rusch V, Pass H, et al.: Recommendations for uniform definitions of surgical techniques for malignant pleural mesothelioma: a consensus report of the international association for the study of lung cancer international staging committee and the international mesothelioma interest group, J Thorac Oncol 6(8) (2011): 1304–1312.
- Opitz I, Scherpereel A, Berghmans T, et al.: ERS/ESTS/EACTS/ESTRO guidelines for the management of malignant pleural mesothelioma, Eur J Cardiothorac Surg 58(1) (2020): 1–24.
- Baas P, Scherpereel A, Nowak AK, et al.: First-line nivolumab plus ipilimumab in unresectable malignant pleural mesothelioma (CheckMate 743): a multicentre, randomised, open-label, phase 3 trial, Lancet 397(10272) (2021) 375–386.
InFo ONKOLOGIE & HÄMATOLOGIE 2024; 12(6): 6–9