La diagnosi in una fase precoce della malattia è un prerequisito per poter utilizzare la finestra temporale per una terapia modificante la malattia (DMARD) ottimale. Questo non solo consente di ridurre il dolore e l’infiammazione, ma può anche arrestare la progressiva distruzione dell’articolazione e le limitazioni funzionali associate. L’attività della malattia può essere oggettivata utilizzando il punteggio DAS28.
I tassi di incidenza dell’artrite reumatoide (RA) sono più alti nelle fasce di età tra i 55 e i 75 anni [1,2]. Le caratteristiche di questa malattia reumatica infiammatoria sono l’interessamento simmetrico delle articolazioni metacarpo-falangee e interfalangee periferiche, con le articolazioni metatarso-falangee interessate anche in una fase iniziale. L’infiammazione delle articolazioni alla base della RA non solo provoca dolore, gonfiore e limitazioni funzionali, ma può anche portare alla progressiva distruzione dell’articolazione se non viene trattata adeguatamente [3]. L’infiammazione è un fattore determinante nel decorso della malattia, sia in termini di conservazione delle funzioni fisiche, sia in termini di comorbidità e mortalità [4].
“Non si lasci sfuggire le ‘Finestre di opportunità'”.
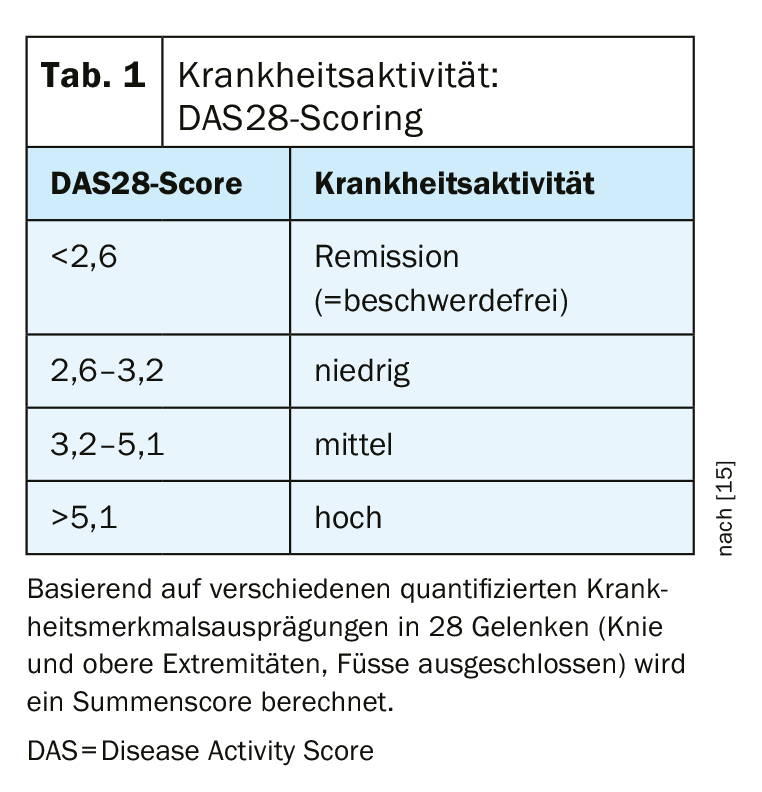
Si ritiene empiricamente provato che il rapido controllo dell’attività della malattia attraverso l’inizio precoce della terapia con sostanze modificanti la malattia sia fondamentale per l’ulteriore prognosi [3]. Le linee guida S3 aggiornate nel 2019 suggeriscono quindi di iniziare la terapia modificante la malattia (DMARD) entro tre mesi dalla comparsa dei sintomi, se è presente l’AR. L’assistenza interdisciplinare coordinata è un prerequisito per la diagnosi nella fase più precoce possibile, assicurando che venga valutata l’indicazione alla terapia modificante la malattia e che le persone colpite vengano indirizzate tempestivamente a un reumatologo [4]. I criteri di classificazione ACR/EULAR hanno lo scopo di promuovere l’inizio più precoce possibile della terapia modificante la malattia e la prevenzione delle sequele irreversibili della malattia [5,6,14] . Viene calcolato un punteggio complessivo in base a determinati criteri (tab. 1). Con un punteggio di 6 o più, si può fare la diagnosi di artrite reumatoide. Le manifestazioni cliniche comuni dell’AR sono la rigidità mattutina, la crepitazione dei tendini e l’atrofia interossea [7]. Le indicazioni diagnostiche di laboratorio includono la positività del fattore reumatoide e i risultati dell’ACPA. L’attuale linea guida S3 propone un algoritmo diagnostico per facilitare la diagnosi di RA. “Tipico dell’artrite è un gonfiore palpabile, morbido ed ‘elastico’ di un’articolazione, causato da un versamento e/o da un ispessimento infiammatorio della mucosa articolare (sinovite, sinovialite), accompagnato da dolore e rigidità articolare”, si legge in un suggerimento diagnostico per la diagnosi differenziale secondo la linea guida S3 [3,4].
“Trattare a bersaglio” mediante DMARDs
Per oggettivare il successo della terapia, esiste il sistema di punteggio DAS28 (DAS=Disease Activity), che serve a valutare l’attività della malattia in base a determinati parametri clinici e biologici [15]. In base alle caratteristiche della malattia quantificate in 28 articolazioni (ginocchio e arti superiori, esclusi i piedi), viene calcolato un punteggio complessivo, per cui un valore <2,6 è considerato un criterio di remissione (Tab. 1) . È stato ripetutamente dimostrato che le limitazioni in termini di salute fisica e mentale sono correlate positivamente con un’elevata attività della malattia [6,14]. Ha anche mostrato che il rischio di intervento di sostituzione dell’articolazione era associato all’entità dell’attività della malattia. Inoltre, è emerso chiaramente che nel decorso a lungo termine, il rischio di intervento di sostituzione dell’articolazione è correlato positivamente con l’entità dell’attività della malattia. I farmaci antireumatici modificanti la malattia (DMARD) possono rallentare la progressione dell’artrite reumatoide intervenendo nel processo della malattia. Oltre ai biologici e ai biosimilari (bDMARDs) e alle sostanze sintetiche convenzionali (csDMARDs), i farmaci antireumatici modificanti la malattia comprendono anche gli agenti sintetici mirati (tsDMARDS), che includono gli inibitori della Janus chinasi. A differenza dei biologici, che inibiscono alcune sostanze messaggere extracellulari del sistema immunitario, come il TNF o le interleuchine, il principio d’azione degli inibitori della Janus chinasi (inibitori JAK) si basa sull’interruzione della trasduzione del segnale intracellulare della Janus chinasi. Questo ha un effetto antinfiammatorio. Nel gennaio 2020, upadacitinib (Rinvoq®) è stato approvato per la prima volta in Svizzera come inibitore JAK per il trattamento dell’artrite reumatoide [12,13].
Letteratura:
- Zink A, Albrecht K: Zeitschrift fur Rheumatologie 2016;75: 346-353.
- Hense S, et al.: Zeitschrift fur Rheumatologie 2016;75: 819-827.
- Schneider M, et al: Linee guida interdisciplinari per la gestione dell’artrite reumatoide precoce. AWMF 060/002, S3, quarta edizione rivista e ampliata, 2019.
- Combe B, et al: Annals of the rheumatic diseases 2017; 76: 948-959.
- Aletaha D, et al: Annals of the rheumatic diseases 2010;69: 1580-1588.
- Radner H, et al: Remissione nell’artrite reumatoide: vantaggio rispetto alla bassa attività di malattia nei risultati e nei costi riferiti dal paziente. Arthritis Research & Therapy 2014; 16: Numero articolo: R56.
- Erni S: DD di Reumatologia, Dr. med. Stephan Erni, RehaClinic AG, Bad Zurzach, presentazione di diapositive, FOMF Basilea, 30.01.2020
- Lindqvist E, et al: Annali delle malattie reumatiche 2002; 61: 1055-1059.
- van Zeben D, et al: The Journal of rheumatology 1994; 21: 1620-1625.
- Wiles NJ, et al. Artrite e reumatismo 2001; 44: 1033-1042.
- Fleischmann RM, et al: Annals Rheum Dis 2019; 78: 1454-1462.
- Alten R, et al: Patient Prefer Adherence 2016; 10: 2217-2228.
- Informazioni tecniche attuali RINVOQ® (upadacitinib). www.swissmedicinfo.ch
- Radner H, et al: Annali delle malattie reumatiche 2014; 73: 114-123.
- Wells G, et al: Ann Rheum Dis 2009; 68(6): 954-960.
PRATICA GP 2020, 15(9): 28