O tratamento do carcinoma brônquico é muito alterado pela imunoterapia. Os desenvolvimentos actuais levarão a um ajustamento dos nossos algoritmos terapêuticos nos próximos meses.
O sistema imunitário pode ser pensado como uma escala, com mecanismos estimulantes de um lado e mecanismos de bloqueio do outro, que estão finamente sintonizados uns com os outros e assim permitem a protecção contra estruturas patogénicas (vírus, bactérias e substâncias estranhas) evitando ao mesmo tempo a auto-imunidade. Desde os anos 2000, cada vez mais destes mecanismos têm sido identificados em ambos os lados da escala. Em particular, as moléculas do grupo dos chamados “pontos de controlo imunitários regulamentares” parecem desempenhar um papel importante no equilíbrio do sistema imunitário. Os anticorpos que permitem a activação do sistema imunitário através do bloqueio de moléculas inibitórias “ponto de controlo imunitário regulatório” estão actualmente a causar uma sensação. Estes anticorpos estão disponíveis, por exemplo, no tratamento do cancro do pulmão metastásico e tornaram-se uma parte integrante do repertório terapêutico. A sua aplicação baseia-se na premissa de que o tumor pode ser reconhecido pelo sistema imunitário e que esta resposta imunitária está pelo menos parcialmente bloqueada pelos “pontos de controlo imunitários regulamentares” PD-1/PDL-1.
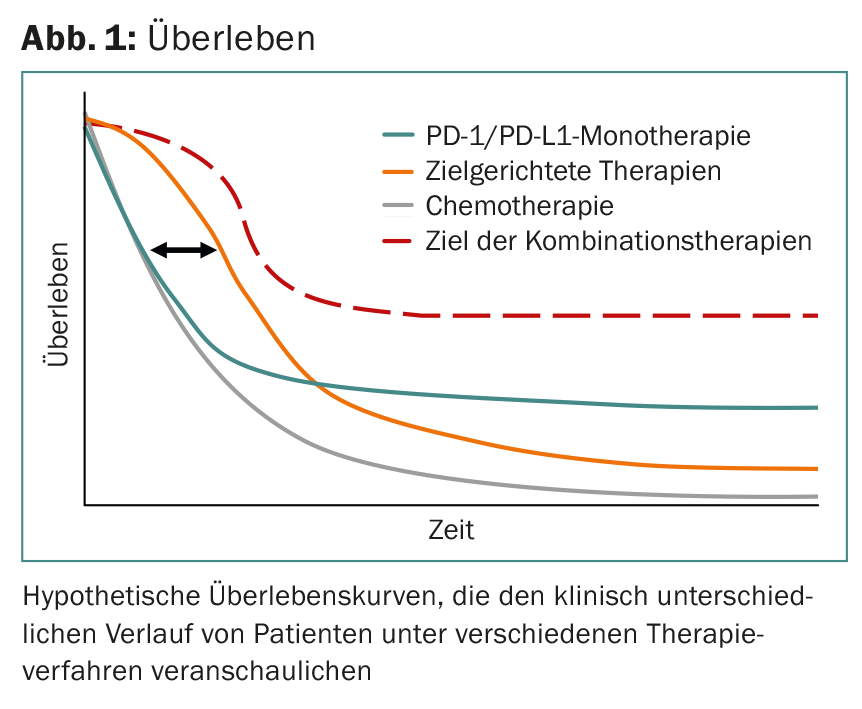
Com base nos dados disponíveis, pode-se assumir que este cenário fisiopatológico está presente numa estimativa de 15-25% de todos os pacientes (nestes pacientes, ocorre o controlo a longo prazo da doença metastática). Isto é interpretado como uma indicação indirecta de controlo pelo sistema imunitário e, inversamente, significa também que em aproximadamente 80% dos doentes, outros mecanismos imunossupressores estão activos ou o sistema imunitário não reconhece estes tumores em princípio e, portanto, nenhuma resposta imunitária pode ser “desbloqueada” (Fig. 1).
Neste momento, não existem métodos de teste satisfatórios que prevejam a resposta ao bloqueio PD-1/PD-L1.
Cancro do pulmão metástático
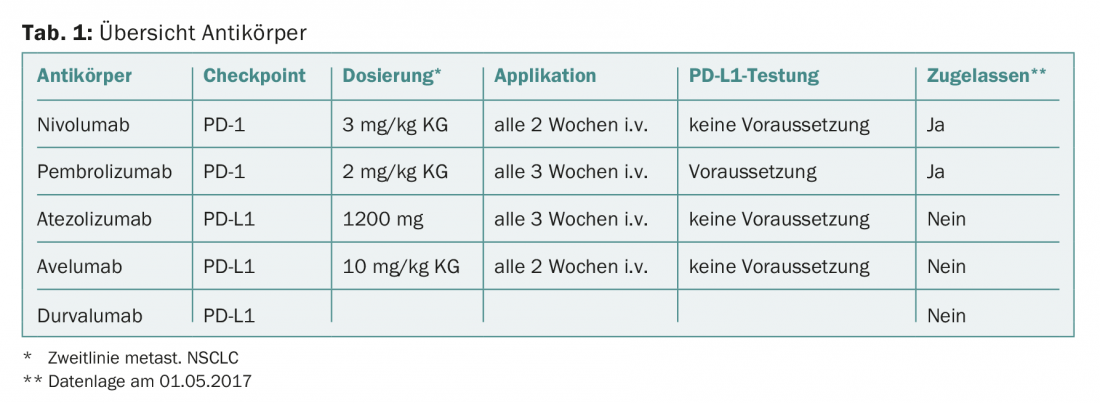
Os anticorpos já estão aprovados para o cancro do pulmão metastásico (Tab. 1), o que pode impedir a activação dos pontos de controlo PD-1/PDL-1 e assim libertar as células T do bloqueio do tumor maligno. Os anticorpos monoclonais podem ser divididos em dois grupos: dirigidos contra a PD-1 ou contra a PD-L1.
Primeiro, o nivolumab (anti-PD-1) recebeu aprovação de segunda linha em carcinoma bronquial metastático, independentemente da expressão PD-L1 (Checkmate 057 e Checkmate 017). Em comparação com a quimioterapia com docetaxel, a sobrevivência global de 2 anos melhorou cerca de 15% (mediana da sobrevivência global, “não-químico”: 9,5 vs. 12,2 meses; “escamoso”: 6,0 vs. 9,2 meses). O ensaio Checkmate 057 também demonstrou que, na ausência da expressão PD-L1, ainda é possível melhorar a sobrevivência global de 2 anos em comparação com o docetaxel (<1% das células tumorais: 25% vs. 18%). Por conseguinte, a aprovação foi concedida independentemente do estatuto de expressão PD-L1. Isto demonstra claramente as limitações da expressão de PD-L1 como biomarcador no carcinoma brônquico, uma vez que os pacientes sem expressão de PD-L1 no tumor também derivam um benefício clínico da terapia de segunda linha com nivolumab.
O desenvolvimento do pembrolizumab (anti-PD-1) baseia-se no pressuposto de que, embora o PD-L1 não seja um biomarcador perfeito, a expressão do PD-L1 no tecido tumoral é biologicamente importante o suficiente para que a sua determinação seja necessária para justificar a inibição do ponto de controlo. Assim, apenas os pacientes em que a expressão PD-L1 pôde ser detectada (>1% das células tumorais) foram incluídos nos estudos de registo. No estudo Keynote 010, houve um benefício de sobrevivência significativo em comparação com a quimioterapia com docetaxel (mediana de sobrevivência global, “não-químico”: 8,5 vs. 10,4 meses).
Os resultados do estudo do nivolumab e pembrolizumab mostram que com o aumento da expressão PD-L1, a sobrevivência global é melhorada quando se utiliza a inibição do ponto de controlo (monoterapia) com um anticorpo anti-PD-1. Ambos os anticorpos monoclonais sublinham assim o importante papel biológico do ponto de controlo PD-1/PDL-1, mas os resultados não permitem que este seja utilizado como único biomarcador, uma vez que os doentes sem expressão de PD-L1 no tumor também beneficiam.
Atezolizumab, durvalumab e avelumab são dirigidos contra PD-L1 e teoricamente têm um perfil imunológico ligeiramente diferente. Os anticorpos anti-PD-L1 apenas bloqueiam a interacção entre PD-L1 e PD-1 e não entre PD-L1/-L2 e PD-1 como faz um anticorpo anti-PD-1. Esta diferença poderia levar a um perfil de efeito secundário mais favorável. Além disso, estão teoricamente disponíveis mais receptores estimuladores para as células T utilizarem através da interacção de B7.1 e PD-L1. No entanto, uma vez que até agora não foram realizados estudos comparativos entre os anticorpos anti-PD-1 e anti-PD-L1, a vantagem clínica postulada em termos de um melhor efeito e menos efeitos secundários indesejáveis não está provada. O Atezolizumab conseguiu demonstrar uma vantagem significativa de sobrevivência em comparação com o docetaxel num estudo de fase III (estudo OAK) (mediana de sobrevivência global, “não-quamoso”: 11,2 vs. 15,6 meses; “escamoso”: 7,7 vs. 8,9 meses). Dados de um estudo de fase II (estudo ATLÂNTICO) estão disponíveis para durvalumab como monoterapia. Este estudo consiste em três coortes para doentes após falha da terapia de segunda linha, cuja sobrevivência global foi analisada de acordo com o nível de expressão PD-L1 (mediana de sobrevivência global, <25% de células tumorais: 9,3 meses; >25% de células tumorais: 10,9 meses; >90% de células tumorais: não atingido aos 12 meses). A Avelumab mostrou uma taxa de resposta global de 11,6 semanas para PD-L1 positivo (>25% das células tumorais) e 6,0 semanas para PD-L1 negativo (<25% das células tumorais) tumores num estudo de fase IB (JAVELIN Tumor Sólido) em terapia de segunda linha.
Todos os inibidores PD-1/PD-L1 têm um perfil de efeito secundário semelhante. Os eventos adversos de grau 3-4 ocorreram em 2-5% de todos os pacientes em todos os estudos e incluíram pneumonite, aumento das transaminases e disfunções da tiróide.
Resumo
No final, o tratamento oncologista será estragado por escolha, uma vez que vários inibidores de pontos de controlo estão rapidamente a ficar disponíveis a partir da segunda linha no carcinoma bronquial metastásico. Todos os anticorpos mostram um espectro semelhante de efeitos e efeitos secundários. As principais diferenças clínicas entre os anticorpos são as dosagens e a frequência de aplicação (tab. 1).
A utilização de inibidores de pontos de controlo PD-1/PD-L1 também irá mudar significativamente nas próximas semanas, uma vez que o pembrolizumab está agora também aprovado na Suíça na primeira linha para carcinomas brônquicos, expressando >50% PD-L1. Assim, na segunda linha, a quimioterapia deveria ter novamente um estatuto mais importante e os testes PD-L1 deveriam tornar-se um diagnóstico central antes da terapia de primeira linha com grande relevância terapêutica.
Além disso, pode-se assumir que as terapias combinadas podem ser utilizadas num futuro previsível – seja como inibição de pontos de controlo com quimioterapia ou dois inibidores de pontos de controlo em combinação. Como resultado, a monoterapia de bloqueio PD-1/PD-L1 de segunda linha também se tornará menos importante no carcinoma bronquial metastásico.
Mensagens Take-Home
- O tratamento do carcinoma brônquico sem uma mutação detectável do condutor está actualmente a ser muito alterado pela imunoterapia.
- Os desenvolvimentos actuais levarão a um ajustamento dos nossos algoritmos terapêuticos nos próximos meses.
InFo ONCOLOGy & HEMATOLOGy 2017; 5(3): 14-16