El tratamiento del carcinoma bronquial ha cambiado mucho gracias a la inmunoterapia. La evolución actual conducirá a un ajuste de nuestros algoritmos terapéuticos en los próximos meses.
Se puede pensar en el sistema inmunitario como en una balanza que tiene mecanismos de estimulación en un lado y mecanismos de bloqueo en el otro, que están finamente sintonizados entre sí y permiten así la protección contra las estructuras patógenas (virus, bacterias y sustancias extrañas) evitando al mismo tiempo la autoinmunidad. Desde la década de 2000, se han identificado cada vez más mecanismos de este tipo a ambos lados de la balanza. En particular, las moléculas del grupo de los llamados “puntos de control reguladores inmunitarios” parecen desempeñar un papel importante en el equilibrio del sistema inmunitario. Los anticuerpos que permiten la activación del sistema inmunitario mediante el bloqueo de las moléculas inhibidoras de los “puntos de control reguladores inmunitarios” están causando sensación en la actualidad. Estos anticuerpos están disponibles, por ejemplo, en el tratamiento del cáncer de pulmón metastásico y se han convertido en parte integrante del repertorio terapéutico. Su aplicación se basa en la premisa de que el tumor puede ser reconocido por el sistema inmunitario y que esta respuesta inmunitaria está bloqueada, al menos parcialmente, por los “puntos de control reguladores inmunitarios” PD-1/PDL-1.
Basándose en los datos disponibles, puede suponerse que este escenario fisiopatológico está presente en un 15-25% estimado de todos los pacientes (en estos pacientes se produce un control a más largo plazo de la enfermedad metastásica). Esto se interpreta como una indicación indirecta de control por parte del sistema inmunitario y, a la inversa, también significa que en aproximadamente el 80% de los pacientes están activos otros mecanismos inmunosupresores o que el sistema inmunitario no reconoce en principio estos tumores y, por tanto, no se puede “desbloquear” ninguna respuesta inmunitaria (Fig. 1).
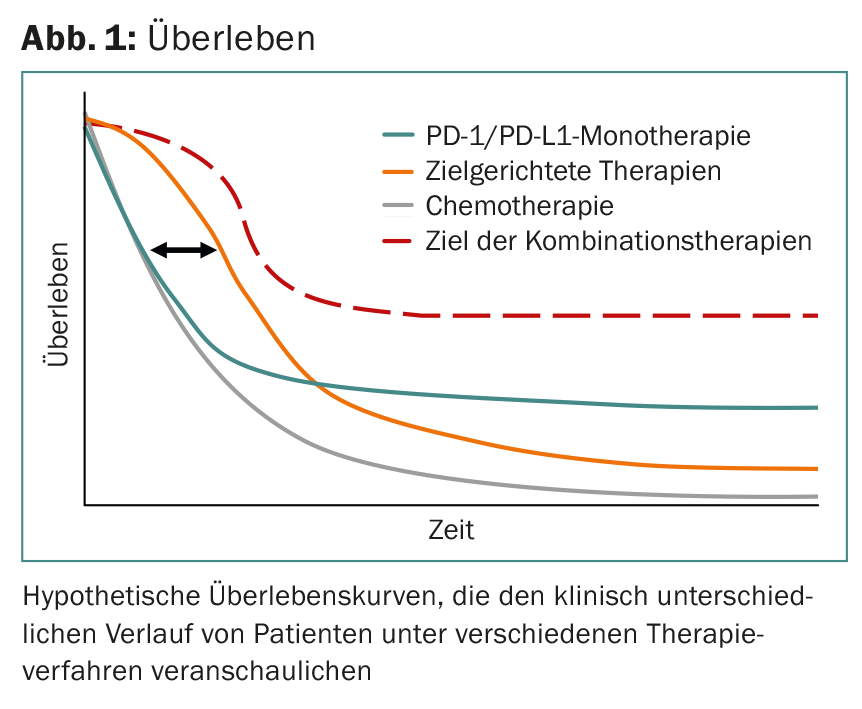
Por el momento, no existen métodos de prueba satisfactorios que predigan la respuesta al bloqueo PD-1/PD-L1.
Cáncer de pulmón metastásico
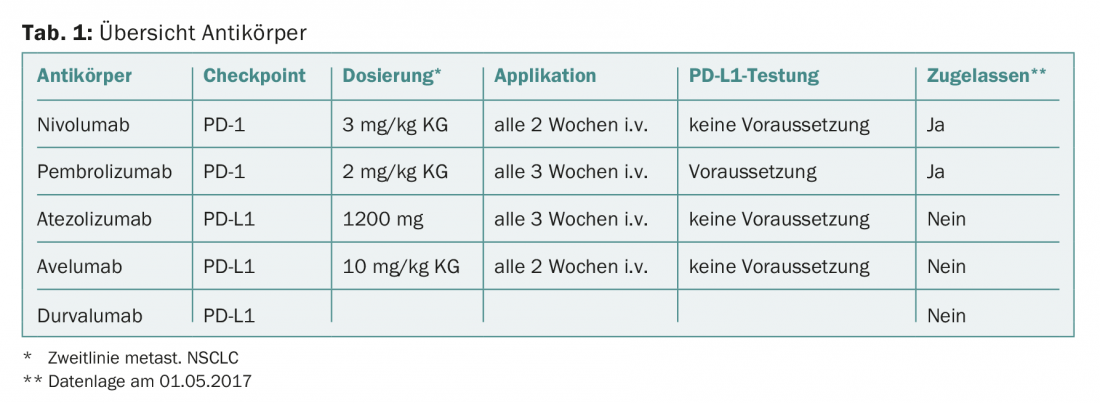
Ya hay anticuerpos aprobados para el cáncer de pulmón metastásico (Tab. 1), que pueden impedir la activación de los puntos de control PD-1/PDL-1 y liberar así a las células T del bloqueo del tumor maligno. Los anticuerpos monoclonales pueden dividirse en dos grupos: dirigidos contra PD-1 o contra PD-L1.
En primer lugar, el nivolumab (anti-PD-1) recibió la aprobación de segunda línea en el carcinoma bronquial metastásico independientemente de la expresión de PD-L1 (Checkmate 057 y Checkmate 017). En comparación con la quimioterapia con docetaxel, la supervivencia global a 2 años mejoró aproximadamente un 15% (mediana de supervivencia global, “no escamosas”: 9,5 frente a 12,2 meses; “escamosas”: 6,0 frente a 9,2 meses). El ensayo Checkmate 057 también demostró que, en ausencia de expresión de PD-L1, aún puede lograrse una mejor supervivencia global a los 2 años en comparación con el docetaxel (<1% de células tumorales: 25% frente a 18%). Por lo tanto, se concedió la aprobación independientemente del estado de expresión de PD-L1. Esto demuestra claramente las limitaciones de la expresión de PD-L1 como biomarcador en el carcinoma bronquial, ya que los pacientes sin expresión de PD-L1 en el tumor también obtienen un beneficio clínico de la terapia de segunda línea con nivolumab.
El desarrollo de pembrolizumab (anti-PD-1) se basa en el supuesto de que, aunque PD-L1 no es un biomarcador perfecto, la expresión de PD-L1 en el tejido tumoral es lo suficientemente importante desde el punto de vista biológico como para que su determinación sea necesaria para justificar la inhibición de los puntos de control. Así, sólo se incluyeron en los estudios de registro los pacientes en los que se pudo detectar la expresión de PD-L1 (>1% de las células tumorales). En el estudio Keynote 010, se observó un beneficio de supervivencia significativo en comparación con la quimioterapia con docetaxel (mediana de supervivencia global, “no escamosa”: 8,5 frente a 10,4 meses).
Los resultados del estudio de nivolumab y pembrolizumab demuestran que, al aumentar la expresión de PD-L1, mejora la supervivencia global cuando se utiliza la inhibición del punto de control (monoterapia) con un anticuerpo anti-PD-1. Ambos anticuerpos monoclonales subrayan así el importante papel biológico del punto de control PD-1/PDL-1, pero los resultados no permiten utilizarlo como único biomarcador, ya que los pacientes sin expresión de PD-L1 en el tumor también se benefician.
El atezolizumab, el durvalumab y el avelumab están dirigidos contra PD-L1 y teóricamente tienen un perfil inmunológico ligeramente diferente. Los anticuerpos anti-PD-L1 sólo bloquean la interacción entre PD-L1 y PD-1 y no entre PD-L1/-L2 y PD-1 como hace un anticuerpo anti-PD-1. Esta diferencia podría dar lugar a un perfil de efectos secundarios más favorable. Además, teóricamente hay más receptores estimuladores disponibles para que las células T los utilicen a través de la interacción de B7.1 y PD-L1. Sin embargo, dado que hasta ahora no se han realizado estudios comparativos entre los anticuerpos anti-PD-1 y anti-PD-L1, la ventaja clínica postulada en términos de un mejor efecto y menos efectos secundarios indeseables no está demostrada. El atezolizumab pudo demostrar una ventaja significativa en la supervivencia en comparación con el docetaxel en un estudio de fase III (estudio OAK) (mediana de supervivencia global, “no escamosas”: 11,2 frente a 15,6 meses; “escamosas”: 7,7 frente a 8,9 meses). Se dispone de datos de un estudio de fase II (estudio ATLANTIC) para durvalumab como monoterapia. Este estudio consta de tres cohortes de pacientes tras el fracaso de la terapia de segunda línea, cuya supervivencia global se analizó en función del nivel de expresión de PD-L1 (mediana de supervivencia global, <25% de las células tumorales: 9,3 meses; >25% de las células tumorales: 10,9 meses; >90% de las células tumorales: no se alcanzó a los 12 meses). El avelumab mostró una tasa de respuesta global de 11,6 semanas en los tumores PD-L1 positivos (>25% de las células tumorales) y de 6,0 semanas en los PD-L1 negativos (<25% de las células tumorales) en un estudio de fase IB (JAVELIN Tumores Sólidos) en terapia de segunda línea.
Todos los inhibidores del punto de control PD-1/PD-L1 tienen un perfil de efectos secundarios similar. Los acontecimientos adversos de grado 3-4 se produjeron en el 2-5% de todos los pacientes en todos los estudios e incluyeron neumonitis, aumento de las transaminasas y disfunción tiroidea.
Resumen
Al final, los oncólogos tratantes tendrán mucho donde elegir, ya que varios inhibidores de los puntos de control están empezando a estar disponibles rápidamente a partir de la segunda línea en el carcinoma bronquial metastásico. Todos los anticuerpos muestran un espectro similar de efectos y efectos secundarios. Las principales diferencias clínicas entre los anticuerpos son las dosis y la frecuencia de aplicación (tab. 1).
El uso de los inhibidores del punto de control PD-1/PD-L1 también volverá a cambiar significativamente en las próximas semanas, ya que el pembrolizumab también está ahora aprobado en Suiza en primera línea para los carcinomas bronquiales que expresen >50% PD-L1. Así, en la segunda línea, la quimioterapia debería volver a tener un estatus más importante y las pruebas de PD-L1 deberían convertirse en un diagnóstico central previo a la terapia de primera línea con gran relevancia terapéutica.
Además, cabe suponer que en un futuro próximo podrán utilizarse terapias combinadas, ya sea como inhibición de puntos de control con quimioterapia o dos inhibidores de puntos de control en combinación. Como resultado, la monoterapia de segunda línea con bloqueo PD-1/PD-L1 también perderá importancia en el carcinoma bronquial metastásico.
Mensajes para llevarse a casa
- El tratamiento del carcinoma bronquial sin una mutación conductora detectable está experimentando actualmente grandes cambios gracias a la inmunoterapia.
- La evolución actual conducirá a un ajuste de nuestros algoritmos terapéuticos en los próximos meses.
InFo ONCOLOGÍA Y HEMATOLOGÍA 2017; 5(3): 14-16












