El cáncer de ovario no suele diagnosticarse hasta una fase avanzada y tiene un pronóstico desfavorable. La cirugía citorreductora máxima posible está en primer lugar desde el punto de vista terapéutico y pronóstico, seguida de quimioterapia con platino. En los estadios III-IV sin reoperación planificada, la adición de bevacizumab a la primera quimioterapia y como terapia de mantenimiento está aprobada desde hace varios meses. Lo mismo se aplica a la terapia de las recidivas sensibles al platino. La última indicación aprobada es el bevacizumab para el cáncer de ovario resistente al platino tras un máximo de dos terapias previas con monoquimioterapia. Las mujeres con cáncer de ovario inducido genéticamente reciben el mismo tratamiento que las pacientes con tumores esporádicos, pero ahora tienen la opción de una terapia de mantenimiento con olaparib en la situación de recaída.
El carcinoma de ovario es el segundo carcinoma más frecuente en el ámbito ginecológico y es la causa más frecuente de muerte entre estos cánceres. En Suiza, afecta a unas 600 mujeres al año (el 3% de todos los cánceres). La edad media en el momento del diagnóstico es de 63 años, el 14% de las mujeres son menores de 50 años. El 90% de los carcinomas ováricos son tumores de origen epitelial, los demás son tumores de las células germinales, del estroma o sarcomatosos o neoplasias de células pequeñas. La OMS divide los carcinomas epiteliales en seis clases histológicas. Los carcinomas serosos son los más comunes (aprox. 80%), pueden ser de poco a muy agresivos.
Diagnóstico y factores de riesgo
Los síntomas que suelen preceder al diagnóstico son inespecíficos: dolor abdominal, opresión abdominal, problemas de micción y, con el tiempo, un aumento del perímetro abdominal o irregularidades menstruales. Los factores de riesgo son el número de ovulaciones (cuantas más ovulaciones, mayor riesgo), la endometriosis, los ovarios poliquísticos y un gen BRCA 1 ó 2. Por el contrario, los partos, la lactancia, los anticonceptivos orales, la ligadura de trompas y la histerectomía reducen el riesgo.
El diagnóstico suele producirse en un estadio avanzado (FIGO III y IV), lo que significa que sólo alrededor del 15% de los carcinomas ováricos se limitan a un solo ovario. Los factores relevantes para el pronóstico son el estadio, la histología y una operación lo más completa posible. Por desgracia, el pronóstico del cáncer de ovario como grupo sigue siendo malo: sólo alrededor del 40% de las pacientes con estadio FIGO III (metástasis fuera de la pelvis pero intraabdominal) y sólo alrededor del 19% con estadio FIGO IV (metástasis a distancia) sobreviven cinco años, y estos datos son anteriores a las opciones de tratamiento modernas (bevacizumab +/- terapia de mantenimiento, olaparib, HIPEC).
Aclaración y terapia quirúrgica
Sin una estadificación quirúrgica o una intervención quirúrgica, no se puede determinar con fiabilidad el alcance exacto de la enfermedad. Las mujeres suelen consultar primero a su ginecólogo, que utiliza la ecografía vaginal para hacer un diagnóstico (Fig. 1) .
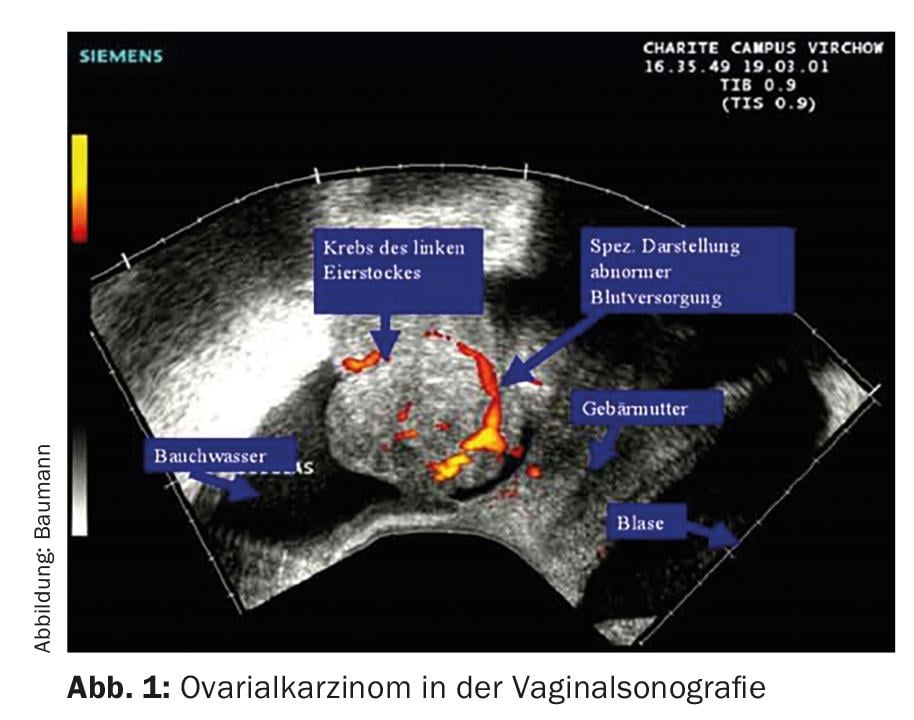
Si se sospecha un carcinoma, se realizará a continuación una tomografía computerizada o un PET-TAC (Fig. 2) . La determinación del marcador tumoral Ca 125 también puede ser útil.
La operación incluye una histerectomía, una anexectomía bilateral, una linfadenectomía retroperitoneal y, en función de la extensión del tumor, también una omentectomía infracólica e infragástrica, así como biopsias peritoneales múltiples y selectivas. La experiencia del cirujano (número de intervenciones realizadas anualmente) es importante, ya que el pronóstico está influido por el resultado quirúrgico conseguido (citorreducción óptima). Siempre que sea posible, deben extirparse todos los tumores visibles macroscópicamente, es decir, la cirugía requiere ginecólogos cualificados y posiblemente también cirujanos viscerales que puedan realizar los procedimientos abdominales, a veces más grandes, como extirpaciones parciales del intestino, peritonectomías, etc. La terapia del carcinoma ovárico avanzado debe discutirse ya en el preoperatorio de forma interdisciplinar, así como las posibles intervenciones o tratamientos. Sus consecuencias/morbilidades deben discutirse previamente con los pacientes. La estadificación postoperatoria se realiza según FIGO o TNM [1].
Terapia de los estadios iniciales (FIGO I-IIA)
Nada ha cambiado en el tratamiento de las fases iniciales en los últimos años. Los pacientes en estos estadios (aprox. 20%) tienen un mejor pronóstico (supervivencia a 5 años del 60-90%). Factores como la graduación, la rotura capsular, la afectación unilateral o bilateral y la edad de la paciente, si la tiene, son importantes para decidir si debe administrarse terapia adyuvante. No se recomienda quimioterapia para pacientes en estadio FIGO IA, G1. En el estadio IB, los factores adicionales y una estadificación quirúrgica óptima son importantes; aquí también puede omitirse a menudo la quimioterapia.
Todas las demás pacientes en estadio precoz (todos los estadios FIGO II y/o todos los grados histológicos superiores a 1) se benefician de la quimioterapia adyuvante con platino. No quiero entrar en la discusión de si el carboplatino solo es suficiente (seis ciclos) o si es preferible la combinación de carboplatino y paclitaxel (tres ciclos pueden ser suficientes, pero normalmente se administran seis) [2,3].
Terapia de estadios avanzados (FIGO IIB-IV)
En las fases avanzadas, es especialmente importante que la cirugía sea lo más completa posible. Los pacientes en los que no se aprecia ningún tumor macroscópicamente tienen el mejor pronóstico. Si el tumor debe permanecer, las mujeres con restos tumorales de menos de 1 cm de tamaño tienen más posibilidades que las mujeres con restos tumorales de más de 1 cm. En pacientes con una operación principalmente subóptima (por ejemplo, sin equipo interdisciplinar, aunque necesario), puede ser útil la denominada citorreducción a intervalos. En este contexto, se administran primero tres ciclos de quimioterapia estándar con carboplatino y paclitaxel, seguidos de una segunda cirugía y tres ciclos más de quimioterapia si hay respuesta.
Todas las pacientes en estadios avanzados han sido tratadas hasta ahora con seis ciclos de quimioterapia combinada con platino (principalmente con paclitaxel). Añadir más fármacos citostáticos o realizar más de seis ciclos no ha demostrado ningún beneficio.
En 2009, un grupo japonés publicó un trabajo con “dosis densas de paclitaxel/carboplatino”, que mostró una mejor supervivencia global del 72% al cabo de tres años en comparación con el 65% del grupo de pacientes con terapia estándar [4]. “Dosis densa” significa que el paclitaxel se administra semanalmente sin interrupción, mientras que el carboplatino se sigue administrando cada tres semanas. Los efectos secundarios (principalmente hematológicos) se produjeron con algo más de frecuencia en el grupo de pacientes tratados de esta forma. Sin embargo, también existen esquemas para la aplicación semanal de ambas sustancias [5].
Terapia con bevacizumab
Una opción terapéutica más reciente es la adición de bevacizumab a la quimioterapia. El bevacizumab inhibe todas las isoformas del receptor VEGF-A. En la actualidad existen cuatro grandes ensayos que demuestran la eficacia de la inhibición de la angiogénesis en el cáncer de ovario (GOG 0218 e ICON7 en primera línea, OCEANS y AURELIA para el recurrente). Todos los estudios tienen en común una mejora de entre 3,5 y 4 meses en la supervivencia libre de progresión (SLP) y la tasa de respuesta, pero no en la supervivencia global. Los estudios difieren no sólo en la indicación y el diseño, sino también en la dosis de bevacizumab y la duración de la terapia. La inhibición de la angiogénesis se utiliza en estos estudios no sólo en paralelo con la quimioterapia, sino especialmente como terapia de mantenimiento. El bevacizumab es la primera terapia de mantenimiento que muestra un beneficio.
El bevacizumab está aprobado en Suiza para pacientes con cáncer de ovario avanzado (FIGO III-IV) junto con carboplatino/paclitaxel en la terapia inicial, si no se realiza una segunda operación o tratamiento. se prevé una citorreducción a intervalos. Los pacientes reciben bevacizumab 7,5 mg/kgKG cada tres semanas en paralelo con seis ciclos de quimioterapia; a partir de entonces, el bevacizumab se administra como terapia de mantenimiento cada tres semanas hasta la progresión o la muerte. durante un máximo de 15 meses. El espectro de efectos secundarios del bevacizumab es conocido de otras terapias tumorales: hipertensión arterial, proteinuria, rara vez tromboembolismo y, sobre todo, una tasa algo mayor de perforación intestinal, además del aumento significativo de los costes de la terapia.
Quimioterapia intraperitoneal
Ya en los años setenta se intentó aumentar las posibilidades de supervivencia de los pacientes preoperados de forma óptima con altas dosis locales de quimioterapia (intraperitoneal). Este proceso, muy complejo y que requiere mucho tiempo, se ha ido mejorando continuamente a lo largo de los años. La quimioterapia intraperitoneal se administra siempre en paralelo con la quimioterapia intravenosa. Las sustancias de la parte de terapia intravenosa se han intercambiado parcialmente y la quimioterapia intraperitoneal con cisplatino y paclitaxel se realiza calentada (quimioterapia intraperitoneal hipertérmica, HIPEC). Como antes, la toxicidad y las complicaciones son considerables, por lo que esta terapia no es un estándar a pesar de la ventaja de supervivencia demostrada en estudios individuales, pero cada vez se utiliza más en centros más grandes [6]. Recientemente se ha publicado una revisión del uso y los beneficios de la quimioterapia intraperitoneal en seis grandes centros de EE.UU. [7]. Con el paso del tiempo (2007-2012), el HIPEC se ha ido utilizando cada vez más, pero según los autores, este procedimiento sigue empleándose en menos del 50% de los pacientes elegibles. La supervivencia global a los tres años fue del 81% en el brazo de HIPEC y del 71% en el brazo estándar.
Terapias recurrentes
Dado que la mayoría de las pacientes con cáncer de ovario avanzado sufren una recaída, se plantea la cuestión de cuál es la terapia de recidiva más óptima. Para los pacientes con un intervalo sin terapia prolongado, en buen estado general y con una recidiva que pueda eliminarse macroscópicamente in toto, una segunda operación es una opción, aunque la situación del estudio en este caso no es muy buena. En casos excepcionales, el HIPEC también se evalúa en esta situación.
La decisión principal es si el carcinoma es sensible al platino (recaída sólo después de seis, preferiblemente doce meses) o -resistente. Para los carcinomas sensibles, puede volver a utilizarse el doblete carboplatino (mejor tolerado, igual de eficaz que el cisplatino) y paclitaxel o, alternativamente, carboplatino/doxorrubicina liposomal egilada o carboplatino/gemcitabina. En este caso, la terapia combinada también es más eficaz que la monoterapia [4]. Para la enfermedad refractaria al platino (recaída antes de seis meses), deben utilizarse fármacos no resistentes al platino: Gemcitabina, etopósido oral, vinorelbina o incluso docetaxel y oxaliplatino. También hay datos sobre la trabectedina junto con Caelyx® [8].
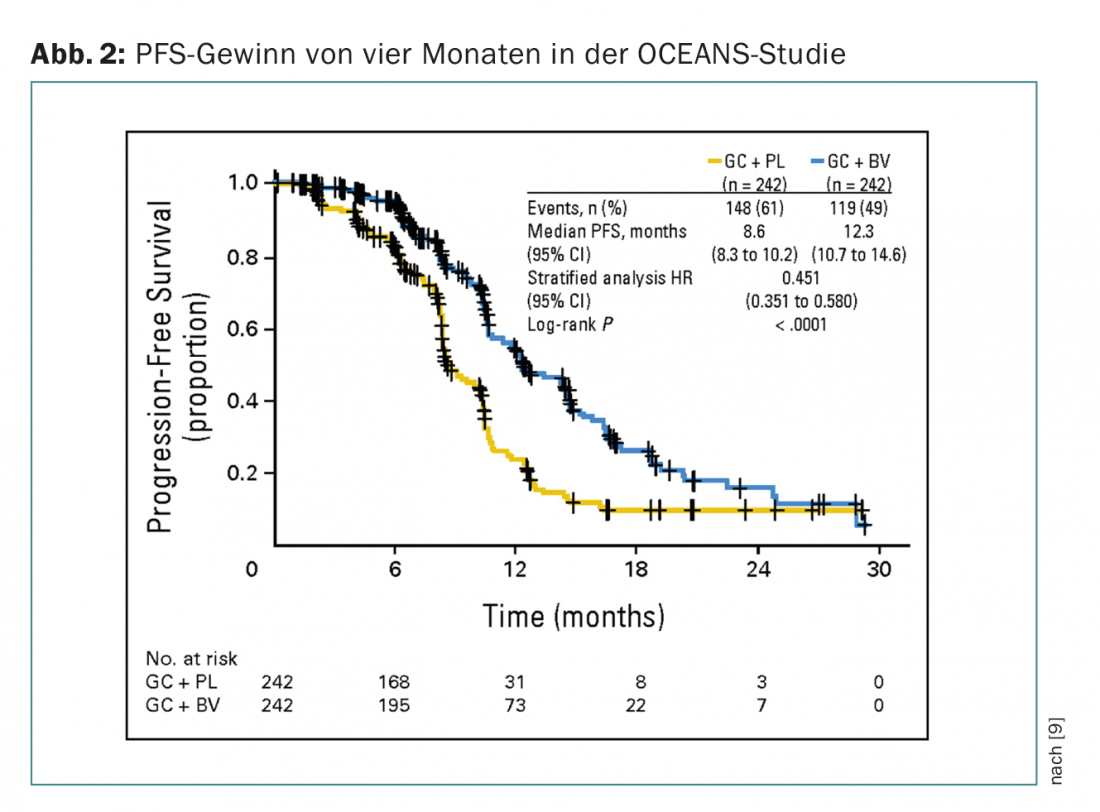
En situaciones de recaída, la adición de bevacizumab (también como terapia de mantenimiento) también ha mostrado un beneficio de la SLP en una medida similar. Las pacientes con cáncer de ovario sensible al platino se incluyeron en el estudio OCEANS (fase III, SSA de cuatro meses) (Fig. 2) [9]. La quimioterapia en ambos brazos consistió en carboplatino/gemcitabina. En el brazo experimental se utilizó bevacizumab a 15 mg/kgKG cada tres semanas hasta la progresión. No se permitió que los pacientes recibieran un tratamiento previo (excepto adyuvante) ni una terapia anti-VEGF previa. En Suiza, el bevacizumab también está aprobado en esta situación, pero debe obtenerse una aprobación de costes (que se aplica a todas las indicaciones del bevacizumab).
La indicación más reciente del bevacizumab en el cáncer de ovario es el carcinoma resistente al platino (AURELIA) con no más de dos terapias previas sin inhibidores de la angiogénesis previos. El tratamiento se administra junto con topotecán, paclitaxel o Caelyx®. La dosis es de 10 mg/kgKG cada 14 días hasta la progresión de la enfermedad. La ganancia de SLP aquí también es de 3,5 meses, lo que puede considerarse significativo en esta situación, en la que los pacientes sobreviven de otro modo menos de 12 meses. AURELIA ha demostrado además una mejora de la calidad de vida. Sin embargo, hay algunas advertencias que mencionar con este estudio, especialmente el diseño abierto con posibilidad de cruzamiento.
Hace tiempo que se sabe que la inhibición de la angiogénesis desempeña un papel en el cáncer de ovario (también en la génesis de la ascitis). Ahora también podemos utilizar este principio terapéutico. Sin embargo, el momento más óptimo aún no está claro (¿posiblemente varias veces?), y los costes tampoco pueden despreciarse en la situación actual [10].
Terapia para portadoras de los genes BRCA 1 y 2
Aproximadamente el 10-15% de los cánceres de ovario son familiares, siendo los dos genes BRCA los más importantes. El riesgo de cáncer de ovario a lo largo de la vida para una portadora del BRCA 1 es del 25-55%, para una portadora del BRCA 2 del 10-25%. Una vez finalizada la planificación familiar, debe hablarse con estas pacientes de la anexectomía bilateral profiláctica (además de otras opciones preventivas).
La terapia de estos carcinomas ováricos aún no difiere de la de los carcinomas esporádicos, ni el pronóstico es peor [11]. La terapia de mantenimiento con olaparib debe mencionarse aquí como una innovación.
En hasta el 50% de los carcinomas serosos de alto grado, existe un defecto en la recombinación homóloga (en la línea germinal como en los portadores de BRCA o somáticamente en las células tumorales), una vía importante para corregir los daños en el ADN. Las enzimas PARP (polimerasas) se encargan de reparar las roturas de una sola hebra del ADN. En las células sanas, éstas se recombinan de forma homóloga. Sin embargo, esto no es posible sin un gen BRCA en funcionamiento. Los inhibidores de PARP provocan inestabilidad celular y muerte celular (“letalidad sintética”). Las células tumorales son especialmente susceptibles a este mecanismo.
Un ensayo de fase II demostró que la terapia de mantenimiento con el inhibidor oral de PARP olaparib proporciona un beneficio en la SLP en mujeres con cáncer de ovario seroso de alto grado, pretratado (al menos dos terapias, sensible al platino, que responde a la última terapia) [12]. La ganancia de SLP se demostró principalmente en pacientes con enfermedad BRCA-positiva (línea germinal o tumoral) y siguió siendo de siete meses en este grupo (HR 0,35). Aún no se ha demostrado un beneficio para la OS. El olaparib aún no está aprobado oficialmente en Suiza, pero las pacientes BRCA positivas pueden inscribirse en un programa especial a través de la empresa. Los efectos secundarios son aceptables (principalmente fatiga, gastrointestinales, hematológicos) y raramente de grado 3 y 4.
En el congreso ASCO de este año también se presentaron los primeros datos clínicos sobre los inhibidores de los puntos de control inmunitarios con anticuerpos anti-PD-1 y anti-PDL-1. Estas “inmunoterapias” -por decirlo de forma sencilla- liberan los frenos del propio sistema inmunitario del organismo contra las células tumorales, y ya se están utilizando con buen éxito para el melanoma y el carcinoma bronquial. Los inhibidores de los puntos de control inmunitarios también parecen tener efecto en el cáncer de ovario, sobre todo en los tumores inducidos por mutaciones BRCA.
Es de esperar que el pronóstico de las pacientes con cáncer de ovario avanzado mejore pronto con las nuevas opciones terapéuticas.
Literatura:
- Manual de estadificación del cáncer, AJCC staging Manual7ª edición 2010.
- Sandercock J, et al: Tratamiento de primera línea para el cáncer de ovario avanzado: paclitaxel, platino y la evidencia. British Journal of Cancer 2002; 87: 815-824.
- Grupo Internacional de Colaboración sobre Neoplasias de Ovario: Paclitaxel más carboplatino frente a quimioterapia estándar con carboplatino como agente único o ciclofosfamida, doxorrubicina y cisplatino en mujeres con cáncer de ovario: el ensayo aleatorizado ICON3. Lancet 2002; 360: 505-515.
- Katsumata N, et al: Dosis densa de paclitaxel una vez a la semana en combinación con carboplatino cada 3 semanas para el cáncer de ovario avanzado: un ensayo de fase 3, abierto, aleatorizado y controlado. Lancet 2009; 374: 1331-1338.
- Sehouli J, et al: Paclitaxel y carboplatino semanales para pacientes con cáncer de ovario avanzado: resultados de un estudio multicéntrico de fase II del NOGGO. Quimioterapéutica del Cáncer 2008; 61: 243-250.
- Armstrong DK, et al: Cisplatino y paclitaxel intraperitoneales en el cáncer de ovario. N Engl J Med 2006; 354: 34-43.
- Wright AA, et al: Uso y eficacia de la quimioterapia intraperitoneal para el tratamiento del cáncer de ovario. J Clin Oncol 2015; 33: 2841-2847.
- Poveda A, et al: Trabectedin plus pegylated liposomal doxorubicin in relapsed ovarian cancer: outcomes in the partially platinum-sensitive (platinum-free interval 6-12 months) subpopulation of OVA-301 phase III randomized trial. Ann Oncol 2011; 22(1): 39-48. doi.1093/annonc/mdq352.
- Aghajanian C, et al: OCEANS: ensayo de fase III aleatorizado, doble ciego y controlado con placebo de quimioterapia con o sin bevacizumab en pacientes con cáncer epitelial de ovario, peritoneal primario o de trompa de Falopio recidivante sensible al platino. J Clin Oncol 2012; 30(17): 2039-2045.
- Liu JF, et al: Papel emergente del bevacizumab en combinación con quimioterapia para pacientes con cáncer de ovario resistente al platino. J Clin Oncol 2014; 32: 1287-1289.
- Rubin SC, et al: Características clínicas y patológicas del cáncer de ovario en mujeres con mutaciones germinales de BRCA1. N Engl J Med 1996; 335: 1413-1416.
- Ledermann J, et al: Terapia de mantenimiento con olaparib en el cáncer de ovario recidivante sensible al platino. N Engl J Med 2012; 366: 1382-1392.
InFo ONCOLOGÍA Y HEMATOLOGÍA 2016; 4(2): 25-28











