Los tumores T1-T2 N0 se operan principalmente. El carcinoma esofágico proximal es una indicación para la radioquimioterapia sola (RCT). Por el contrario, los carcinomas T3-T4 y N+ se tratan trimodalmente si es posible. La ECA neoadyuvante aumenta la tasa de resección y mejora la supervivencia global y sin enfermedad. En caso de inoperabilidad, un ECA definitivo puede incluso alcanzar una supervivencia a cinco años de hasta el 30%. La terapia trimodal del carcinoma esofágico debe llevarse a cabo en un centro experimentado. La quimioterapia perioperatoria sola mejora los resultados de la cirugía del cáncer gástrico. En una situación N+, debe considerarse una ECA adyuvante combinada.
Charles Moertel informó por primera vez sobre la radioquimioterapia (RCT) simultánea para tumores gastrointestinales no resecables en 1969 en la revista The Lancet [1]. Hoy en día, la combinación de las dos modalidades terapéuticas, junto con la cirugía, es estándar para muchos tumores desde el esófago hasta el canal anal. El desarrollo de la endoscopia con fibra óptica, el perfeccionamiento de las técnicas de imagen y la estandarización de la estadificación han permitido evaluar mejor el riesgo tumoral específico de cada paciente. Los avances técnicos en radioterapia han perfeccionado la optimización de la aplicación de la dosis al tumor preservando al máximo los órganos sanos circundantes en riesgo.
A pesar de la introducción de nuevas sustancias en diversas combinaciones, del desarrollo de diferentes anticuerpos contra el EGFR y del descubrimiento de biomarcadores importantes como KRAS, NRAS y BRAF, el 5-fluouracilo, que se ha utilizado durante décadas, sigue siendo un componente importante de la poliquimioterapia actual. En general, esto se ha traducido en un ligero aumento de las tasas de supervivencia a cinco años tanto para el cáncer de esófago como para el gástrico en los últimos 30 años.
Cinco ensayos aleatorios sobre el uso de radioterapia preoperatoria sola no han mostrado ninguna ventaja en términos de supervivencia. Asimismo, tres ensayos aleatorizados mostraron una mejora del control local pero ningún beneficio para la supervivencia con la radioterapia postoperatoria sola.
Características biológicas del carcinoma esofágico
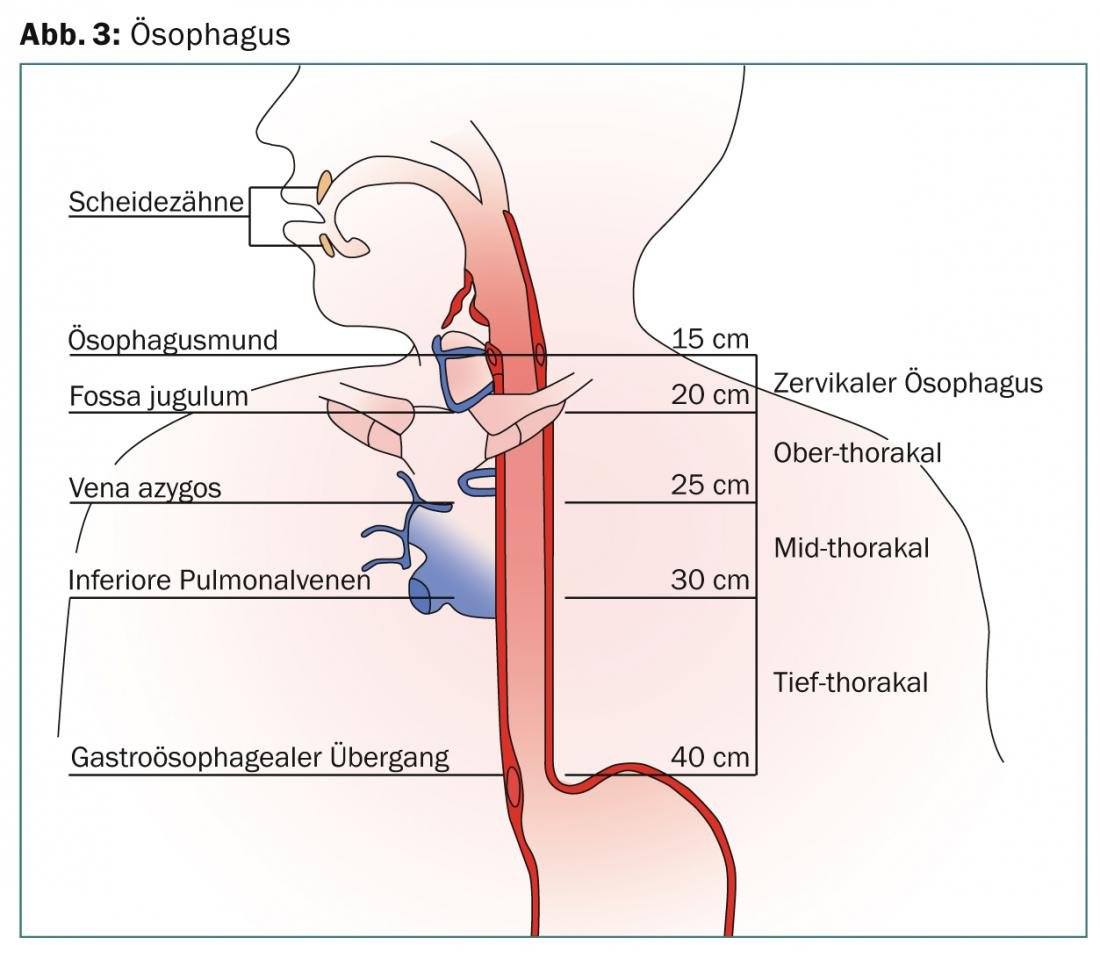
El esófago se extiende más de 25 cm desde el músculo cricofaríngeo cranealmente hasta la unión esofagogástrica caudalmente. La línea Z visible endoscópicamente define la transición de la célula pavimentosa al epitelio cilíndrico. En el esófago de Barrett, el epitelio pavimentoso es sustituido por un epitelio cilíndrico altamente estratificado. Según el último informe de la AJCC, el órgano se divide en las regiones cervical, torácica superior, torácica media y torácica profunda (Fig. 1 ).

La longitud se calcula endoscópicamente desde los incisivos hasta la entrada del estómago en centímetros. La estructura de múltiples capas de la pared del órgano está atravesada por una abundante red de vasos linfáticos. Las metástasis ganglionares en el tronco celíaco, anteriormente clasificadas como M1, se definen como M0 según la clasificación AJCC más reciente (2010), ya que se incluyen por defecto en el volumen de radiación. La metástasis linfogénica se correlaciona con el estadio T, la longitud del tumor y el grado de diferenciación y puede llegar a ser del 38-60% para una lesión T2, con afectación microscópica presente en >60% de los casos, que no puede detectarse con las técnicas de imagen actuales. La afectación de los ganglios linfáticos depende de la localización del tumor primario (Fig. 2).
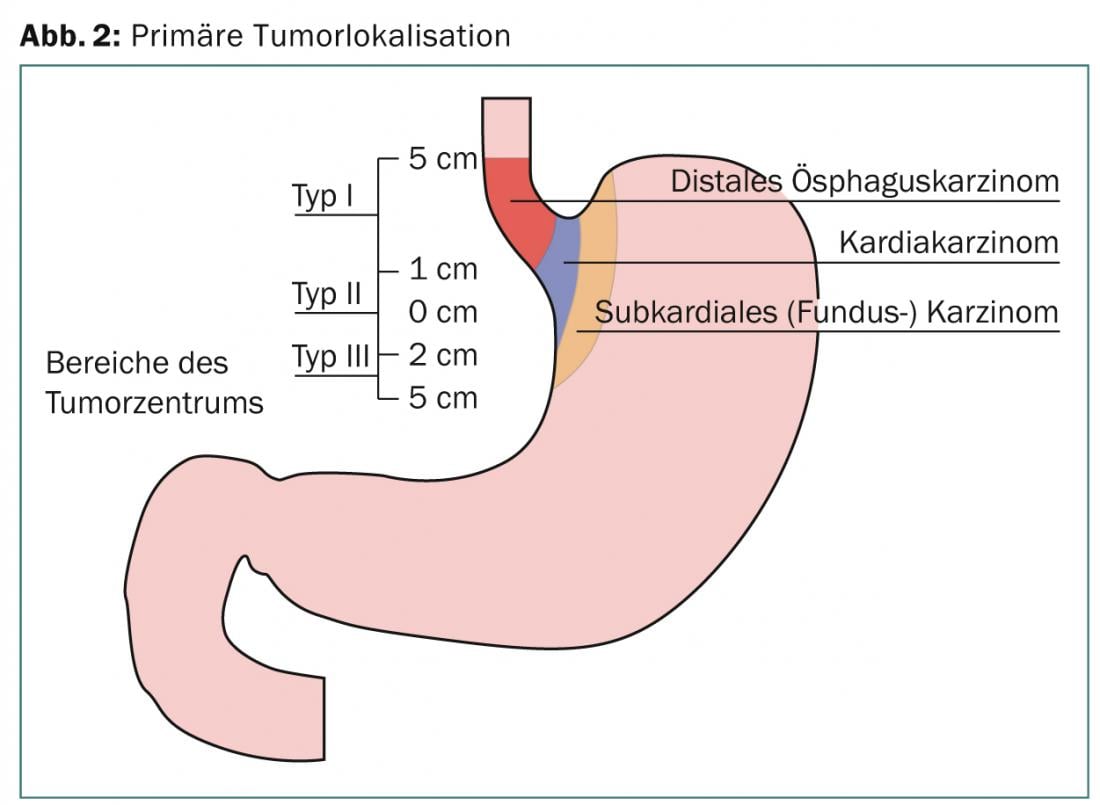
En el momento del diagnóstico, aproximadamente la mitad de los tumores esofágicos son en principio no resecables o presentan ya metástasis a distancia. Salvo raras excepciones, suelen ser adenocarcinomas o carcinomas de células pavimentosas, predominando el primer tipo, cuya incidencia ha aumentado claramente en los últimos años. Se trata de dos entidades tumorales diferentes con una etiología, epidemiología y pronóstico distintos [2]. Esto también se tiene en cuenta en la 7ª edición del AJCC Staging-Manuel [3]. También se define aquí la localización del tumor en la unión gastroesofágica. Entre ellos se incluyen los tumores del esófago distal que se extienden hasta 5 cm en el estómago (Sievert III) (Fig. 3). En la mayoría de los estudios prospectivos, las diferentes entidades tumorales no siempre se distinguen por separado. Para una gran proporción de localizaciones tumorales distales, se incluyen los tumores de la unión gastroesofágica.
Puesta en escena
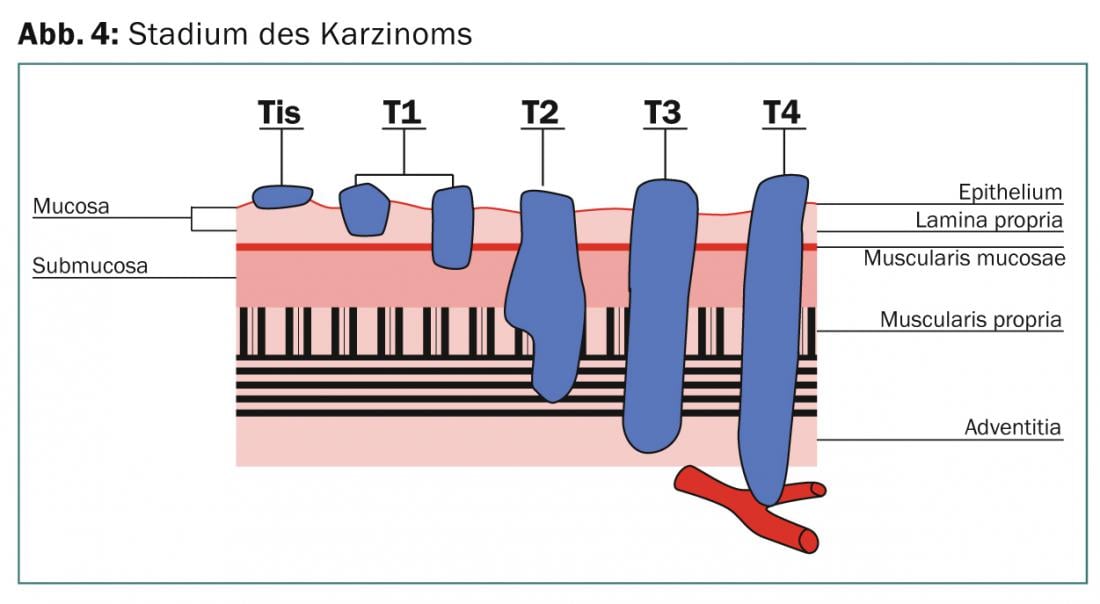
El diagnóstico se realiza mediante endoscopia y biopsia. Se realiza un TAC de tórax y abdomen en todos los pacientes y una ecografía endoluminal decide el estadio T y N. Antes de decidir el tratamiento definitivo con RCT o trimodal, se realiza una PET-TC como procedimiento estándar, ya que durante este examen de aclaración se encuentran metástasis a distancia en hasta el 22% de los casos [4]. Si el tumor está situado por encima de la carina, debe excluirse una fístula esofagobronquial mediante broncoscopia si existe sospecha clínica (fig. 4).
Si el tumor se localiza distalmente, debe realizarse una laparoscopia antes de la terapia trimodal para excluir una metástasis peritoneal.
El ECA neoadyuvante antes de la cirugía programada
El tratamiento del carcinoma esofágico con intención curativa se ofrece hoy en día en un hospital de centro con un equipo interdisciplinar experimentado. En primer lugar se realiza la planificación de la radiación tridimensional guiada por TC, utilizando una técnica altamente especializada que incluye la aplicación de dosis de intensidad modulada y una secuencia de radiación guiada por imágenes (RT guiada por imágenes).
En la situación neoadyuvante, suelen administrarse 45 grays (Gy) a lo largo de cinco semanas. En los años 90, se administraba a los pacientes de forma estándar quimioterapia simultánea según el denominado régimen Herskovic (combinación de cisplatino y 5-fluouracilo) [5]. El estudio RTOG-8501 ha demostrado por primera vez que la radio/quimioterapia simultánea es significativamente superior a la radioterapia sola [6].
La ECA neoadyuvante mejora la supervivencia y es ahora estándar para los tumores >T2 y/o N+. Conseguir una resección R0 es uno de los objetivos más importantes para garantizar una supervivencia libre de tumor a largo plazo.
Si la ingesta de alimentos es imposible, debe crearse una yeyunostomía en lugar de una PEG si se planea la cirugía para no perjudicar la formación posterior de un “neoesófago” tras la resección.
Los carcinomas esofágicos proximales suelen tratarse con una ECA definitiva.
El resultado de la PET-TAC es relevante para la planificación de la terapia; la parte ácida de la PET se correlaciona muy bien con el resultado endoscópico de la extensión del tumor [7]. Los estudios histológicos tras esofagectomía han demostrado que el marcaje de 3 cm proximal y distal al tumor puede cubrir el 94-100% de la afectación microscópica subclínica [8]. Por regla general, hoy en día se definen como márgenes de seguridad 3-5 cm craneocaudales y 2 cm laterales al VTG (volumen tumoral macroscópico). Si el tumor se localiza proximalmente, se incluyen las estaciones ganglionares supraclaviculares, y si se localiza distalmente, se incluyen las estaciones ganglionares celíacas [8]. Los tumores distales de la GEJ pueden requerir la inclusión de los ganglios linfáticos celíacos, así como los de la curvatura pequeña y grande del estómago.
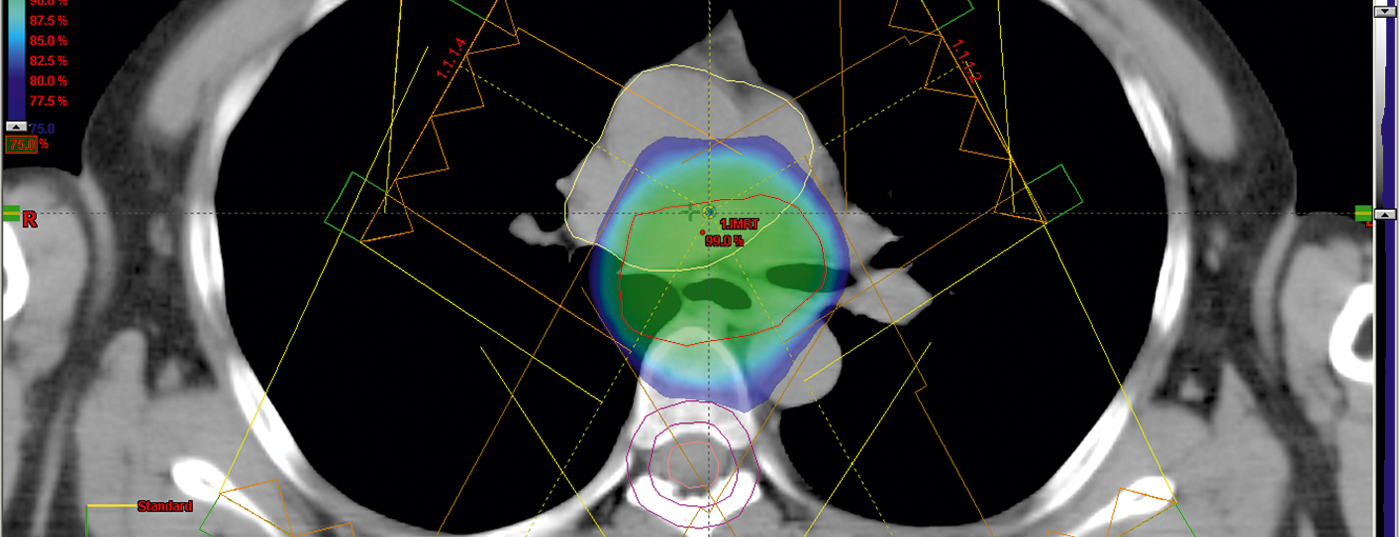
Una irradiación óptima en múltiples campos permite respetar las dosis admisibles para los órganos sanos (pulmones, corazón, hígado) o las limitaciones (Fig. 5).
La cirugía suele realizarse entre seis y ocho semanas después de completar la ECA simultánea.
Walsh [9] demostró una ventaja significativa a favor de la terapia bimodal en 110 pacientes con adenocarcinomas en combinación con 40 Gy y cisplatino/5-FU en comparación con la cirugía sola. Sin embargo, el trabajo fue criticado por sus pobres resultados quirúrgicos. Tres ensayos aleatorios [10–12] mostraron un beneficio en la supervivencia a favor de la terapia combinada y una tendencia hacia resultados significativamente mejores cuando se lograba la remisión completa del tumor. Sin embargo, el número de pacientes en los ensayos fue modesto. El mayor estudio en cuanto a cifras, el llamado Cross Trial, fue publicado por van Hagen en el New England Journal of Medicine en 2012. En el ensayo, que comparaba la RCT neoadyuvante con taclitaxel y cisplatino con 41,4 Gy en 23 fracciones frente a la cirugía sola, se asignaron al azar 366 pacientes a cada uno de los dos brazos, el 75% tenía adenocarcinoma y el 23% carcinoma de células pavimentosas. La resección R0 fue del 92% en el grupo combinado frente al 69% con cirugía sola. Se logró una remisión patológica completa del 29%. Los resultados a tres años mostraron una mejora significativa de la supervivencia del 58 frente al 44% con la cirugía sola. Desde entonces, este régimen se ha aceptado como el estándar para los tumores esofágicos y gastroesofágicos resecables. Un metaanálisis en la revista Lancet Oncology de 2011 [13] confirma la ventaja de la terapia neoadyuvante, resultando una ventaja no significativa a favor de la ECA frente a la quimioterapia. El beneficio absoluto de supervivencia a los dos años fue del 8,7%, independientemente de la histología. En el caso de los tumores de la unión gastroesofágica Siewert I + II, en la primera conferencia GI-EORTC celebrada hace dos años se dio preferencia al ECA neoadyuvante [14].
Quimioterapia neoadyuvante para el cáncer de esófago
El grupo del Consejo de Investigación Médica (MRC) aleatorizó a 800 pacientes con adenocarcinoma de células parcheadas y adenocarcinoma de esófago a un grupo de dos ciclos de cisplatino/5-FU y radioterapia sola. Incluso después de seis años, los pacientes muestran una ventaja de supervivencia significativa del 23 frente al 17% independientemente de la histología [15].
El llamado Ensayo Mágico con el uso de quimioterapia perioperatoria con epirrubicina, cisplatino y 5-FU (ECF) en comparación con la cirugía sola muestra una supervivencia a cinco años del 36 frente al 23% y ahora se prefiere como terapia neoadyuvante para los carcinomas gástricos resecables. En cada grupo se aleatorizó a 250 pacientes con cáncer de la JAG o gástrico.
ECA definitivo en cáncer de esófago
No existen estudios aleatorizados que comparen directamente la cirugía y la radiación. La radioterapia sola conduce a una supervivencia media de 6-12 meses y a una supervivencia a cinco años de <10%. Por lo tanto, la radioterapia sola, percutánea o con braquiterapia intraluminal, sólo se utiliza en la situación paliativa.
Los datos a largo plazo del ensayo RTOG 85-01 [16] muestran una supervivencia a cinco años del 26% a favor de la ECA. En general, muestran una mejora significativa del control local, la mediana y la supervivencia global. Estos datos son bastante comparables a los de la cirugía sola en el ensayo del MRC, con una supervivencia a cinco años de aproximadamente el 20%. En general, el valor de la intervención quirúrgica posterior no parece ser significativamente decisivo para la supervivencia global, a pesar de la mejora del control local. Un estudio aleatorizado del francés Bedenne [17] con 445 pacientes llega a la conclusión de que con una buena tasa de respuesta tras una ECA simultánea, la cirugía posterior no mejora la supervivencia. En un estudio de diseño similar realizado por Stahl [18], aunque el control local del tumor mejoró con la cirugía posterior, la supervivencia a tres años no fue significativamente diferente. Tras la quimioterapia de inducción con 5-FU, leucovorina, etopósido y cisplatino, seguida de 40 Gy de radioterapia, los pacientes fueron distribuidos aleatoriamente en un grupo con cirugía directa y otro con continuación de la ECA hasta 60 Gy. Los pacientes que respondieron a la quimioterapia de inducción se beneficiaron de la cirugía posterior en términos de supervivencia a los tres años, pero la mortalidad fue significativamente mayor en el grupo operado. Los autores descubrieron que la tasa de cirugía mejoraba el control local pero no la supervivencia global. Otros estudios deberán decidir si se puede prescindir de la cirugía tras la ECA y en qué pacientes.
Dado que ambas modalidades de tratamiento, incluida la cirugía, presentan una elevada tasa de recidiva locorregional, se están llevando a cabo diversos estudios en los que se prueban nuevas sustancias como los taxanos, la gemzitabina o los inhibidores del receptor EGFR.
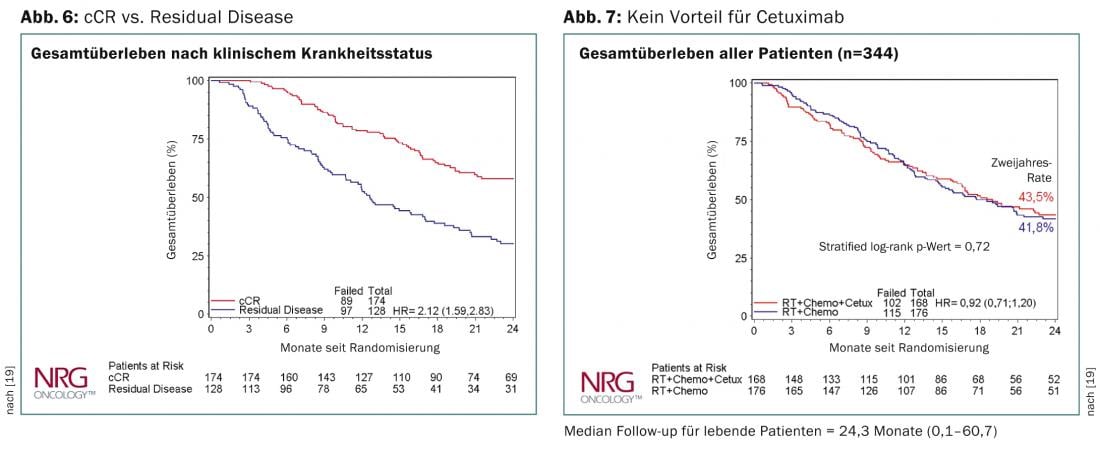
En la reunión de la ASCO de este año en Chicago, se presentaron los datos del ensayo RTOG-436 [19]. Se trata de un ensayo aleatorizado de fase 3 para evaluar el efecto de añadir cetuximab al ECA definitivo con paclitaxel y cisplatino. Se aleatorizaron 344 pacientes en total, la tasa de remisión clínicamente completa fue del 70%. La proporción de tumores T3/T4 fue del 80%, la de N+ del 66% y dos tercios de las pacientes presentaban adenocarcinoma. A pesar de la adición de cetuximab, la supervivencia global no fue significativamente diferente entre los dos brazos. Tampoco hubo diferencias en el resultado respecto a la histología. Los pacientes con una remisión clínica completa tuvieron una supervivencia global significativamente mejor al cabo de dos años (Fig. 6 y 7). El estudio SCOPE [20] llega a la misma conclusión y no puede recomendar la adición de cetuximab en el ECA definitivo.
En el SAKK-75-02, se probó con éxito la viabilidad de la quimioterapia de inducción con docetaxel y cisplatino seguida de una ECA combinada con 45 Gy y las mismas sustancias. Esto demostró una mayor tasa de respuesta de los carcinomas de células pavimentosas. En el posterior SAKK75-06, la adición de Erbitux mostró una tasa de respuesta prometedora. El siguiente ensayo prospectivo aleatorizado de fase III (SAKK 75-08) está probando el valor de la terapia multimodal con o sin cetuximab. El estudio se cerró recientemente tras la inscripción de >300 pacientes.
ECA preoperatoria frente a quimioterapia preoperatoria
En un estudio alemán [21] se realizó una comparación directa de la ECA preoperatoria con la quimioterapia neoadyuvante sola. Debido a una mala acumulación, lamentablemente tuvo que cerrarse antes de tiempo. Los autores del estudio constatan una mejor remisión patológica completa del 2 frente al 16%, así como un mejor control local del 59 frente al 76% y una mejor supervivencia a tres años del 28 frente al 47% a favor de la modalidad combinada.
ECA adyuvante en cáncer gástrico
En el estudio de 2001 publicado por Macdonald en el Journal Clinical Oncology, se indica que el 20% de los pacientes tienen una GEJ. En ellos, el ECA adyuvante proporcionó un beneficio significativo para la mediana de supervivencia de 36 frente a 27 meses con cirugía sola [22]. El seguimiento a largo plazo muestra un beneficio adicional para los tumores de la GEJ en términos de supervivencia global y de ausencia de tumor [23].
El estudio ARTIST se presentó en la reunión de la ASCO de 2014 en Chicago. Se trata de un ensayo aleatorizado de fase 3 que compara la quimioterapia adyuvante con capecitabina/cisplatino (XB) sola frente a XB más radioterapia simultánea con capecitabina [24]. Se trata de un trabajo de Corea del Sur con una resección D-2 de carcinoma gástrico. Se aleatorizó a un total de 448 pacientes. No se encontraron diferencias en ambos brazos con respecto a la ausencia de enfermedad y la supervivencia global.
En cambio, los pacientes con metástasis ganglionares positivas mostraron una mejora estadísticamente significativa de la supervivencia libre de enfermedad al cabo de tres años del 76 frente al 72% a favor de la radioterapia.
Dr. Norbert Lombriser
Literatura:
- Moertel CG, et al: The Lancet 1969 Oct 25; 2(7626): 865-867.
- Siewert A: Surg 2001; 234-360.
- Rice TW, Blackstone EH, Rusch VW: Rice Anales de Oncología Quirúrgica 2010; 17(7): 1721-1724.
- Flammen P, et al: JCO 2000; 18: 3202.
- Al-Sarraf M, et al: JCO 1997; 15(1): 277-284.
- Herskovic A, et al: NEJM 1992; 326(24): 1593-1598.
- Konski A, et al. Int J Radiat Oncol Biol Phys 2005; 61: 1123-1128.
- Hazard L, et al: J Natl Compr Canc Netw 2008; 6: 870-878.
- Walsh TN, et al: N Engl J Med 1996; 335: 462-467.
- Urba SG, et al. J Clin Oncol 2001; 19: 305-313.
- Bosset JF, et al: N Engl J Med 1997; 337: 161-167.
- Burmeister BH, et al: Lancet Oncol 2005; 6: 659-668.
- Sjoquist KM, et al: Lancet Oncology julio de 2011; 12(7): 681-692.
- Lutz MP: European Journal of Cancer 2012; 48: 2941-2953.
- Allum WH, et al: J Clin Oncol 2009; 27: 5062-5067.
- Cooper JS, et al: Grupo de Oncología Radioterápica. JAMA 1999; 281: 1623-1627.
- Bedenne L, et al: J Clin Oncol 2007; 25: 1160-1168.
- Stahl M, et al: J Clin Oncol 2005; 23: 2310-2317.
- ASCO Reunión 2014 Resumen 4007.
- Crosby T, Hurt CN: Lancet Oncology 2013; 14(7): 627-637.
- Stahl M, et al: J Clin Oncol 2009; 27: 851-856.
- Macdonald JS, et al: N Engl J Med 2001; 345: 725-730.
- Smalley SR, et al: J Clin Oncol 2012; 30(19): 2327-2333.
- ASCO Meeting 2014 Resumen 4008.
- Cunningham D, et al: N Engl J Med 2006; 355: 11-20.
- van Hagen P, et al: N Engl J Med 2012; 366: 2074-2084.
- Ruhstaller T: Anales de Oncología 2009; 20: 1522-1528.
InFo Oncología y Hematología 2014; 2(6): 6-10