La sarcoidosis puede aparecer a cualquier edad y suele afectar a los pulmones, pero también pueden verse implicados otros órganos. El diagnóstico consta de varios pasos, no existen análisis de sangre específicos que confirmen o excluyan la sarcoidosis. Histológicamente, la sarcoidosis se caracteriza por granulomas celulares epitelioides, no necrotizantes. Una vez identificada la sarcoidosis pulmonar, es importante buscar una afectación extratorácica relevante; las manifestaciones en órganos cardíacos en particular pueden poner en peligro la vida.
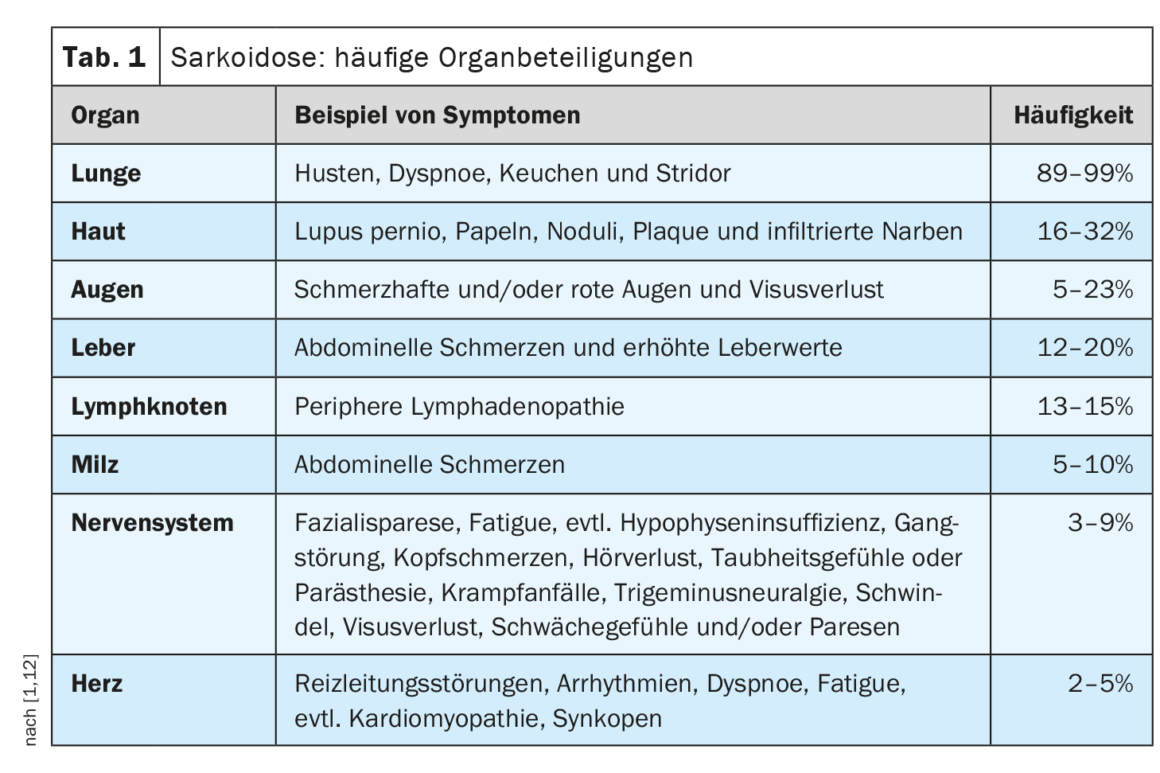
El curso clínico y el pronóstico de la sarcoidosis son muy heterogéneos y dependen de la afectación de cada órgano, explica el Prof. Dr. med. Jörg D. Seebach, médico jefe del Servicio de Inmunología y Alergología de los Hospitales Universitarios de Ginebra [1]. Los pulmones, los ganglios linfáticos, la piel y los ojos son los más comúnmente afectados, mientras que las manifestaciones cardiacas, renales y neurológicas son menos frecuentes pero se asocian a una mayor morbilidad [2]. La tabla 1 ofrece una visión general de las manifestaciones orgánicas más comunes. [1,3]El diagnóstico de la sarcoidosis se basa principalmente en las características clínicas y radiológicas, la identificación de granulomas no necrotizantes en una o más muestras de tejido y la exclusión de otras causas de enfermedad granulomatosa . En ocasiones, la sarcoidosis es autolimitada: aproximadamente la mitad de los pacientes con sarcoidosis experimentan una remisión espontánea en un plazo de dos años y muchos otros en los cinco años siguientes a la aparición de los síntomas [4]. Sin embargo, también existen formas graves de progresión. Las causas más comunes de muerte en pacientes con sarcoidosis son la insuficiencia respiratoria en la fibrosis pulmonar avanzada y la afectación cardiaca o neurológica grave [3]. La tabla 2 resume las recomendaciones sobre la anamnesis y las medidas de cribado y la tabla 3 las aclaraciones en caso de sospecha de afectación orgánica.
Los procedimientos broncoscópicos son mínimamente invasivos
Si se sospecha de sarcoidosis basándose en los síntomas clínicos y los hallazgos radiográficos, el ponente recomienda solicitar una biopsia [1]. En principio, las muestras histológicas deben tomarse del lugar que ofrezca la exposición menos invasiva y las mejores posibilidades de diagnóstico. Dado que los pulmones se ven afectados en la mayoría de los casos, la broncoscopia es un procedimiento seguro y mínimamente invasivo [2]. Existen varios procedimientos broncoscópicos de diagnóstico, como la biopsia endobronquial (de la mucosa), la biopsia pulmonar transbronquial (BTP) o la aspiración transbronquial con aguja (TBNA) de los ganglios linfáticos hiliares/mediastínicos y el lavado broncoalveolar (BAL). Las bioespecímenes extrapulmonares, por ejemplo de la piel, las glándulas parótidas o lagrimales, los ganglios linfáticos palpables o las lesiones conjuntivales, también son posibles pero menos específicas. En cualquier caso, la histología debe ir acompañada de manifestaciones clínicas y radiológicas compatibles y de la exclusión de otras enfermedades. Si hay confirmación histológica en lugares extrapulmonares y afectación pulmonar concurrente con sospecha de infección, como enfermedad pulmonar cavitaria, puede ser necesaria una broncoscopia para excluir causas infecciosas como micobacterias y hongos [2].
La manifestación pulmonar es la afectación orgánica más frecuente
La afectación de los pulmones y/o los ganglios linfáticos mediastínicos/hiliares es la afectación orgánica más común, y se produce en aproximadamente el 80-90% de los pacientes con sarcoidosis. La manifestación pulmonar está asociada a la afectación parenquimatosa y a granulomas perivasculares. Los síntomas más comunes son una sensación de presión en el pecho, tos seca y disnea. En el curso posterior, puede desarrollarse fibrosis con insuficiencia respiratoria [5]. Dado que la sarcoidosis pulmonar puede presentarse con patrones obstructivos, restrictivos, mixtos o normales, los hallazgos de las pruebas de función pulmonar son muy inespecíficos pero importantes para evaluar la gravedad, la indicación del tratamiento y la respuesta al mismo. La enfermedad pulmonar intersticial (EPI) es un hallazgo típico en los estadios 2, 3 y 4, que va desde las manifestaciones subclínicas hasta la fibrosis pulmonar terminal (estadio 4). Esta última constituye un daño orgánico irreversible, mientras que la EPI de leve a moderada relacionada con la sarcoidosis es un síntoma tratable.
La manifestación cardiaca es menos frecuente pero de pronóstico desfavorable
Mientras que alrededor del 90% de todos los pacientes con sarcoidosis tienen afectación pulmonar, la aparición de sarcoidosis cardiaca es bastante rara, con una prevalencia del 2-7% [6]. Sin embargo, en pacientes con sarcoidosis extracardiaca confirmada, se recomienda buscar la afectación cardiaca mediante un ECG [7]. Esto se debe a que la sarcoidosis cardiaca es una manifestación potencialmente mortal [2]. Las técnicas modernas de diagnóstico por imagen pueden ser útiles para una detección precoz. Entre ellas se incluyen una resonancia magnética cardiaca con técnica de realce tardío de gadolinio (LGE) y FDG-PET [8]. La afectación cardiaca puede manifestarse por arritmias ventriculares, bloqueo cardiaco de alto grado o insuficiencia cardiaca crónica debido a la infiltración granulomatosa miocárdica y/o, en fases avanzadas de la enfermedad, fibrosis [2]. Los posibles síntomas incluyen dolor torácico, palpitaciones, mareos y síncope. La muerte súbita cardiaca se produce hasta en un 25%. [2,9]En resumen, el diagnóstico y el tratamiento precoces de la afectación cardiaca son esenciales . [13]Las manifestaciones típicas de la sarcoidosis cardiaca son trastornos de la conducción, arritmias ventriculares e insuficiencia cardiaca . En aproximadamente una cuarta parte de los casos, la sarcoidosis cardiaca se produce de forma aislada y sin afectación pulmonar, según el Prof. Seebach [1]. Esto suele asociarse a un peor pronóstico en comparación con la sarcoidosis sistémica con afectación cardiaca. Los diagnósticos diferenciales importantes son: la miocarditis linfocítica, algunas miocardiopatías genéticas, el aumento fisiológico de la captación de FDG en la insuficiencia cardiaca [1].
Diagnóstico diferencial: ¿qué hay que tener en cuenta?
“Los diagnósticos diferenciales son muy importantes”, subrayó el ponente [1]. Los hallazgos histopatológicos son de gran importancia en este contexto. La sarcoidosis se caracteriza por granulomas compactos, no necrotizantes, con una distribución perilinfática a lo largo de los haces broncovasculares, paraseptal y pleural [2]. En las biopsias pulmonares a cielo abierto, la sarcoidosis suele asociarse a una vasculitis granulomatosa sin destrucción de las paredes vasculares. En el curso de la progresión de la enfermedad, predomina la fibrosis hialinizada con restos de granulomas. La beriliosis crónica es un diagnóstico diferencial esencial de la sarcoidosis, especialmente en pacientes con exposición a metales. También debe tenerse en cuenta la enfermedad granulomatosa inducida por el infliximab. Estas entidades pueden diferenciarse bien histológicamente de la sarcoidosis. Otros diagnósticos diferenciales incluyen neoplasias malignas (linfomas, carcinomas), colagenosis vasculares (lupus eritematoso sistémico, síndrome de Sjögren, cirrosis biliar primaria, artritis granulomatosa familiar), infecciones (VIH, [2,10,11] tuberculosis), vasculitis (granulomatosis con poliangeítis, arteritis de Takayasu, arteritis de células gigantes), neumonitis por hipersensibilidad, neumoconiosis, enfermedad relacionada con la IgG4 y diversas enfermedades por inmunodeficiencia) . La morfología y el patrón de distribución de los granulomas relacionados difieren de la sarcoidosis.
Las enfermedades infecciosas como la tuberculosis, el myobacterium avium, la histoplasmosis, la coccidiomicosis y la enfermedad de Whipple) muestran una distribución peribronquial o aleatoria de los granulomas y suelen ir asociadas a necrosis. El uso de tinciones especiales (tinciones de Ziehl-Neelsen, de auramina y de plata) o las pruebas PCR para el complejo Mycobacterium tuberculosis y las miobacterias atípicas pueden ser informativas para la detección de patógenos. A diferencia de la sarcoidosis, la neumonitis por hipersensibilidad se caracteriza por acumulaciones sueltas de histiocitos cerca de los bronquiolos. La granulomatosis con poliangeítis (antes también llamada granulomatosis de Wegener) se caracteriza por una necrosis basófila rodeada de un infiltrado celular que contiene células gigantes. La granulomatosis sarcoide nodular se considera a veces una variante de la sarcoidosis y se caracteriza también por una necrosis extensa que, a diferencia de la granulomatosis con poliangeítis, es eosinofílica y está delimitada por numerosos granulomas compactos acompañados de vasculitis granulomatosa sin destrucción de las paredes de los vasos.
Los diagnósticos diferenciales en caso de manifestaciones neurológicas deben basarse en los hallazgos de la IRM (especialmente lesiones periventriculares, focales frente a lesiones parenquimatosas o lesiones meníngeas). Las nuevas técnicas de IRM han optimizado la sensibilidad, pero debido a la falta de especificidad, la contención del diagnóstico sigue siendo un reto. [2]. El espectro de diagnósticos diferenciales abarca desde enfermedades autoinmunológicas, inflamatorias o idiopáticas (por ejemplo, EM, enfermedad del espectro de la neuromielitis óptica, LES, síndrome de Sjögren, enfermedad de Behcet, vasculitis primaria del SNC) hasta entidades infecciosas (por ejemplo, tuberculosis, enfermedad de Lyme, neurosífilis, taxoplasmosis) y neoplasias (neoplasias primarias del SNC, linfomas y otras) [2].
Literatura:
- «Sarcoidosis: Beyond the Lungs and Lymph Nodes», Prof. Dr. med. Jörg D. Seebach, Allergy and Immunology Update, Grindelwald, 27.–29.1.2023.
- Franzen DP, et al: Sarcoidosis: una enfermedad multisistémica. Swiss Med Wkly. 2022;152: w 30049.
- Graf L, Geiser T: Das Chamäleon unter den Systemerkrankungen: «Die Sarkoidose». Swiss Med Forum 2018; 18(35): 695–701.
- Valeyre D, et al.: Sarcoidosis. Lancet (London, England) 2014; 383(9923): 1155–1167.
- Lichtenberger N: Diagnostik und Therapie der Kardialen und pulmonalen Sarkoidose. https://opus.bibliothek.uni-wuerzburg.de, (letzter Abruf 23.02.2023)
- Costabel U, et al. [Cardiac sarcoidosis: diagnostic and therapeutic algorithms]. Pneumologie (Stuttgart, Germany) 2014; 68(2): 124–132.
- Birnie DH, et al.: HRS expert consensus statement on the diagnosis and management of arrhythmias associated with cardiac sarcoidosis. Heart rhythm 2014; 11(7): 1305–1323.
- Giblin GT, et al.: Cardiac Sarcoidosis: When and How to Treat Inflammation. Card Fail Rev 2021;7:e17. doi: 10.15420/cfr.2021.16.
- Hamzeh N, et al.: Pathophysiology and clinical management of cardiac sarcoidosis. Nat Rev Cardiol 2015; 12(5): 278–288.
- Valeyre D, et al.: Clinical presentation of sarcoidosis and diagnostic work-up. Semin Respir Crit Care Med 2014; 35(3): 336–351.
- Spagnolo P, et al.: Pulmonary sarcoidosis. Lancet Respir Med 2018; 6(5): 389–402.
- Grunewald J, et al.: Sarcoidosis. Nat Rev Dis Primers 2019; 5(1): 45.
- Birnie D, et al.: Cardiac Sarcoidosis. Clinics in chest medicine 2015; 36(4): 657–668.
HAUSARZT PRAXIS 2023; 18(5): 40–42
Foto de portada: Hellerhoff, wikimedia