Los tumores de cabeza y cuello fueron el séptimo cáncer más frecuente en todo el mundo en 2018. Los factores de riesgo más importantes son el consumo de nicotina y alcohol. El pronóstico y las opciones de tratamiento multimodal de los pacientes con tumores de cabeza y cuello varían en función de los factores epidemiológicos, la localización anatómica y el estadio tumoral. Una visión general.
Los tumores de cabeza y cuello fueron el séptimo cáncer más frecuente en todo el mundo en 2018 (890.000 nuevos casos) [1]. En EE.UU., los tumores de cabeza y cuello fueron responsables del 3% de todos los cánceres (51.540 nuevos casos) y de algo más del 1,5% de todas las muertes por cáncer (10.030 fallecimientos) [2]. Estas neoplasias se asocian sobre todo al consumo de nicotina y alcohol como factores de riesgo más importantes. En las últimas décadas, se ha observado un descenso general de la incidencia, en particular debido a la disminución del consumo de nicotina [3,4]. Por el contrario, se ha detectado un aumento de los carcinomas orofaríngeos en personas más jóvenes en Norteamérica y el norte de Europa, lo que se debe principalmente a una mayor incidencia de tumores asociados a subtipos de alto riesgo del virus del papiloma humano (VPH) (especialmente el VPH tipo 16) [4,5].
El pronóstico y las opciones de tratamiento multimodal de los pacientes con tumores de cabeza y cuello varían en función de los factores epidemiológicos, la localización anatómica y el estadio tumoral. Los tumores de cabeza y cuello representan un grupo heterogéneo de enfermedades. Este artículo de revisión se centra en las opciones de tratamiento de los carcinomas de células escamosas recidivantes y metastásicos, así como localmente avanzados, originados en las mucosas (predominantemente cavidad oral, faringe y laringe). No se tratará aquí el tratamiento en las fases iniciales de estos tumores, ya que no se han producido cambios relevantes en la terapia en los últimos años.
El tratamiento de los pacientes con tumores de cabeza y cuello es complejo e incluye no sólo el tratamiento médico del tumor y los efectos agudos de la cirugía, la quimioterapia y la radioterapia, sino también la orientación y el asesoramiento para hacer frente a los impedimentos permanentes y las consecuencias psicosociales resultantes. Afortunadamente, los descubrimientos recientes han dado lugar a mejoras significativas en los resultados del tratamiento. Los avances en cirugía y radioterapia han mejorado la conservación funcional de los órganos correspondientes y han reducido la morbilidad y la mortalidad en general. Por ejemplo, las nuevas técnicas de cirugía asistida por robot para el carcinoma orofaríngeo [6] y las de microcirugía láser mínimamente invasiva para el carcinoma laríngeo e hipofaríngeo [7] pueden aumentar de forma relevante la probabilidad de preservar la función. Los avances en radioterapia conformada, como la radioterapia de intensidad modulada (IMRT) y la radioterapia guiada por imagen, también pueden reducir la morbilidad [8]. En particular, la introducción de los inhibidores de puntos de control inmunitarios para el tratamiento del cáncer de cabeza y cuello recurrente o metastásico ha mejorado significativamente el pronóstico de muchos pacientes, lo que se comentará en primer lugar a continuación.
Tumores de cabeza y cuello recidivantes y/o con metástasis
Los tumores de cabeza y cuello recidivantes y/o metastásicos se asocian a un mal pronóstico. La mayoría de los pacientes con recidiva primaria localizada -al igual que los pacientes con tumores metastásicos de cabeza y cuello- reciben terapia sistémica paliativa, ya que sólo los pacientes seleccionados con recidiva locorregional pueden ser tratados con cirugía o radioterapia renovada [9]. En consecuencia, siempre es necesaria una evaluación interdisciplinar de la situación de la enfermedad, de los posibles tratamientos anteriores y de la situación individual para la elección individual de la mejor estrategia terapéutica. Durante muchos años, la terapia estándar para los tumores recidivantes y/o metastásicos fue el denominado “régimen EXTREME”, que incluye quimioterapia a base de platino (cisplatino o carboplatino) en combinación con fluorouracilo (5-FU) y cetuximab, un anticuerpo contra el receptor del factor de crecimiento epidérmico (EGFR), seguido de terapia de mantenimiento con cetuximab [10]. El tratamiento con el régimen EXTREME mostró una mediana de supervivencia global de unos diez meses en el estudio pivotal. Para las pacientes que no cumplían los requisitos para el régimen EXTREME, los taxanos y el metotrexato eran algunas de las pocas opciones de tratamiento disponibles. Con estas sustancias, la mediana de supervivencia global desciende a seis meses [11]. Estos datos demuestran que se necesitan urgentemente nuevas opciones de tratamiento para los pacientes con tumores de cabeza y cuello recidivantes/metastásicos.
Las terapias con inhibidores de puntos de control se han establecido como un nuevo estándar en muchas entidades tumorales en los últimos años. Los tumores de cabeza y cuello se asocian a déficits inmunitarios, como la alteración de la función de las células asesinas naturales y el deterioro de los linfocitos T infiltrantes de tumores, lo que constituye el fundamento para investigar los inhibidores de puntos de control inmunitarios en estos tumores [11]. El nivolumab y el pembrolizumab, ambos anticuerpos monoclonales IgG4 anti-PD-1, se estudiaron en ensayos de fase III en pacientes con carcinoma de células escamosas de cabeza y cuello (cavidad oral, orofaringe, laringe o hipofaringe) tras el fracaso de la quimioterapia basada en platino y se compararon con el anticuerpo o la quimioterapia a elección del médico responsable del estudio (docetaxel, cetuximab o metotrexato). “Fracaso del platino” se definió como la progresión de la enfermedad en los seis meses siguientes a la quimioterapia con platino que se había utilizado con intención curativa (combinación con radioterapia) o paliativa. El estudio CheckMate-141 es el primer estudio de fase III que demuestra la eficacia del nivolumab en comparación con la quimioterapia (cociente de riesgos [HR] para la muerte 0,70; p=0,01). Además, nivolumab demostró ser mejor tolerado (efectos secundarios G3/4 13,1% frente a 35,1% para nivolumab y quimioterapia, respectivamente) y condujo a una mejora de la calidad de vida [12,13]. El nivolumab fue la primera opción de tratamiento que mejoró significativamente la supervivencia global en pacientes con cáncer de cabeza y cuello recidivante/metastásico en los que había fracasado la quimioterapia basada en platino [12]. En el estudio KEYNOTE-040, que se diseñó de forma similar al estudio CheckMate 141, el pembrolizumab también aumentó la supervivencia global en comparación con la quimioterapia [14]. Merece la pena mencionar que en ambos estudios no se exigió la evidencia de la expresión de PD-L1 como criterio de inclusión y el criterio de valoración primario no dependió del estado de PD-L1. Ninguno de los estudios mostró una diferencia significativa en la supervivencia libre de progresión. Así pues, al igual que en otros tumores sólidos, el aumento de la supervivencia global se debió principalmente a que la inmunoterapia permitió controlar la enfermedad a largo plazo en algunos pacientes. Por ejemplo, aunque sólo el 13% de los pacientes mostraron una respuesta radiológica al nivolumab, la duración media de la respuesta fue de 9,7 meses, el doble que con la quimioterapia [15]. Los anticuerpos contra PD-L1 se investigaron como monoterapia y en combinación con anticuerpos contra CTLA-4 tras el fracaso de la terapia basada en platino. Tras los estudios iniciales de fase II con durvalumab (anticuerpo anti-PD-L1) en pacientes con alta expresión de PD-L1 (≥25%) en el estudio HAWK [16] y durvalumab, durvalumab más tremelimumab (anticuerpo anti-CTLA-4) o tremelimumab solo en pacientes con baja expresión de PD-L1 (<25%) en el estudio CONDOR [17], se inició el estudio de fase III EAGLE [18]. En este ensayo, los pacientes con cáncer de cabeza y cuello recidivante/metastásico en los que había fracasado la terapia basada en platino fueron aleatorizados entre durvalumab más tremelimumab, monoterapia con durvalumab o quimioterapia estándar a elección del médico del ensayo. El estudio no mostró ningún beneficio para la supervivencia con durvalumab (HR 0,88; p=0,20) o durvalumab más tremelimumab (HR 1,04; p=0,76) en comparación con la quimioterapia. Teniendo en cuenta la limitada potencia de las comparaciones entre estudios, cabe destacar que la mediana de supervivencia global en el brazo de durvalumab fue similar a la de nivolumab en el ensayo CheckMate-141 (7,6 y 7,5 meses, respectivamente), pero la mediana de supervivencia global en el brazo de control fue numéricamente más larga en el ensayo EAGLE en comparación con CheckMate-141 (8,3 meses y 5,1 meses, respectivamente). Un análisis exploratorio del estudio EAGLE sugiere que esta supervivencia global superior a la esperada en el grupo de control puede deberse a características desequilibradas en el momento de la inclusión en el estudio (mayor porcentaje de pacientes con ECOG PS 0 y metástasis a distancia sin recidiva local/regional en el grupo de control), al mayor uso de paclitaxel en el grupo de control y al posterior tratamiento con anticuerpos anti-PD-1 [18]. Actualmente no está claro hasta qué punto la diferencia entre los anticuerpos PD-1 y PD-L1 tiene relevancia clínica.
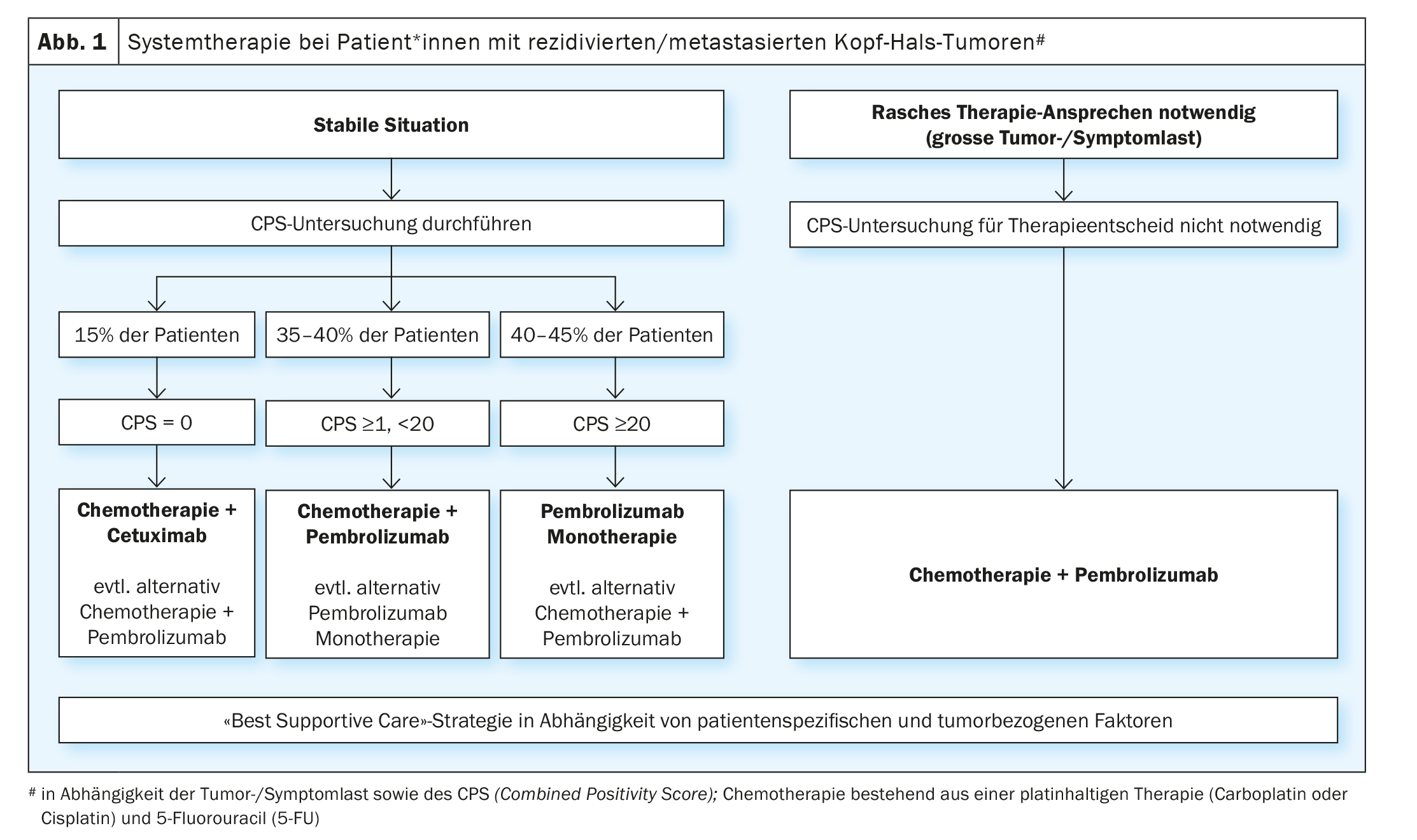
El beneficio demostrado de la terapia con inhibidores de puntos de control inmunitarios en pacientes con cáncer de cabeza y cuello recidivante/metastásico tras el fracaso de la terapia basada en platino condujo a la evaluación de estas sustancias en la terapia paliativa de primera línea. El ensayo aleatorizado de fase III KEYNOTE-048 comparó la monoterapia con pembrolizumab y un tratamiento combinado con platino/5-FU y pembrolizumab con el régimen EXTREME (platino/5-FU/ cetuximab) [19]. Se realizaron análisis estadísticos para la supervivencia global en la población total y en subgrupos definidos en función de la expresión de PD-L1. La expresión de PD-L1 se categorizó según la denominada “puntuación de positividad combinada ” (CPS) (CPS ≥1 y ≥20). El SPC se define como el número de células PD-L1-positivas (células tumorales, linfocitos, macrófagos) dividido por el número total de células tumorales y multiplicado por un factor 100. La monoterapia con pembrolizumab mejoró significativamente la supervivencia global en pacientes con SPI ≥1 y ≥20. Aunque la tasa de respuesta fue menor que con la quimioterapia (19-21% frente a 36%), la duración media de la respuesta se multiplicó por cinco con la monoterapia con pembrolizumab (20,9 frente a 4,5 meses). La quimioterapia más pembrolizumab mejoró significativamente la supervivencia global en las tres poblaciones. No hubo diferencias significativas en la tasa de respuesta y el tiempo libre de progresión entre el tratamiento combinado de quimioterapia más pembrolizumab y el régimen EXTREME. Como era de esperar, la monoterapia con pembrolizumab se asoció a una menor toxicidad, mientras que platino/5-FU más pembrolizumab tuvo una tasa de acontecimientos adversos similar a la del régimen EXTREME. El ensayo de fase III KESTREL aleatorizó a los pacientes 2:1:1 a durvalumab solo, durvalumab más tremelimumab o al régimen EXTREME (NCT02551159). El criterio de valoración primario es la supervivencia global con durvalumab en monoterapia en comparación con EXTREME en pacientes con alta expresión de PD-L1 (definida como una expresión de >50% en las células tumorales o > 25% en los linfocitos infiltrantes del tumor). El criterio de valoración secundario es la supervivencia global con durvalumab más tremelimumab en comparación con EXTREME para todos los pacientes. Aún no se ha publicado ningún dato. Sin embargo, se anunció a través de un comunicado de prensa que el estudio no cumplía sus criterios de valoración.
Para la terapia de primera línea, puede resumirse que el estudio KEYNOTE-048 es el primer estudio positivo desde la publicación del estudio EXTREME en 2009 y ha cambiado el estándar de atención. Sin embargo, aún quedan algunas cuestiones abiertas relativas a la práctica diaria. Una de ellas es si los pacientes con un SPC ≥20, que representaron el 44% de los pacientes con expresión probada de PD-L1 en el estudio KEYNOTE-048, fueron la razón del beneficio de la monoterapia con pembrolizumab en el grupo de SPC ≥ 1. La pregunta de si la monoterapia con pembrolizumab es suficiente para los pacientes con SPC 1-19 no puede responderse de forma inequívoca. Un análisis de subgrupos del ensayo KEYNOTE-048 mostró que el pembrolizumab seguía aportando un beneficio en comparación con el EXTREME en el SPC 1-19 (HR 0,86), aunque menor que en los pacientes* con SPC ≥20 (HR 0,58) [20]. En la práctica clínica, la decisión a favor de la monoterapia con pembrolizumab frente a la terapia combinada con platino/5-FU más pembrolizumab para pacientes con SPC 1-19 depende principalmente de la carga tumoral y sintomática. Además, también deben tenerse en cuenta las comorbilidades y el estado general de los afectados. En pacientes con CPS 1-19 y una carga tumoral elevada y/o síntomas significativos relacionados con el tumor, suele preferirse la quimioinmunoterapia combinada para maximizar la respuesta potencial. Otra cuestión es la secuencia de tratamiento de los pacientes PD-L1-negativos, que constituyen alrededor del 15% de los afectados. Un análisis de subgrupos para pacientes PD-L1 negativos en el estudio KEYNOTE 048 mostró un beneficio para el régimen EXTREME en comparación con el tratamiento combinado con pembrolizumab (HR 1,22) [20]. Sin embargo, dado el pequeño número de pacientes de esta cohorte y el hecho de que se trataba de un análisis de subgrupos no planificado, no se puede concluir que los pacientes PD-L1 negativos no deban ser tratados con la combinación de platino/5-FU y pembrolizumab. En resumen, la monoterapia con pembrolizumab en pacientes con alta expresión de PD-L1 (CPS ≥20) y la terapia combinada de platino/5-FU y pembrolizumab, independientemente de la expresión de PD-L1, pero especialmente en tumores PD-L1 positivos, representan un nuevo estándar terapéutico. (Fig. 1). Para los pacientes que muestren progresión tumoral bajo o después de esta terapia de primera línea, las quimioterapias mencionadas (docetaxel, metotrexato) o el tratamiento con cetuximab son opciones terapéuticas disponibles. Actualmente se están investigando nuevos enfoques inmunoterapéuticos en numerosos estudios. Por ejemplo, el estudio INTERLINK-1 está abierto al reclutamiento en varios centros de Suiza. Este ensayo aleatorizado compara el cetuximab con la combinación de cetuximab y el inhibidor del punto de control inmunitario monalizumab dirigido contra NKG2A (NCT04590963).
Además de la expresión de PD-L1, el estado del VPH también podría servir como biomarcador clínico para predecir la respuesta a la terapia con inhibidores de puntos de control inmunitarios. La infección por VPH conduce a la producción de proteínas relacionadas con el virus que pueden desencadenar una respuesta de células T de novo y una mayor infiltración del tumor con células T CD8+ [21]. En el ensayo de fase II KEYNOTE-055, la tasa de respuesta al pembrolizumab fue del 22% en pacientes con tumores p16 positivos y del 16% en tumores p16 negativos [22]. Un metaanálisis también mostró que el estado del VPH parece correlacionarse con la tasa de respuesta al tratamiento anti-PD-1 independientemente de la expresión de PD-L1 y de la carga de mutaciones tumorales [23]. Otro metaanálisis concluyó que las pacientes con tumores VPH positivos presentaban resultados significativamente mejores cuando eran tratadas con inhibidores de los puntos de control inmunitarios [24]. Todavía no se puede evaluar definitivamente si estos resultados son relevantes en la práctica clínica diaria. Las directrices actuales sobre inmunoterapia para los tumores de cabeza y cuello aún no recomiendan utilizar el estado del VPH para tomar decisiones sobre el tratamiento [25].
Tumores de cabeza y cuello localmente avanzados
Más del 60% de los pacientes con carcinoma de células escamosas de cabeza y cuello presentan un estadio III o IV, que se caracteriza por tumores de gran tamaño con una marcada invasión local, evidencia de metástasis en los ganglios linfáticos regionales, o ambas cosas. La enfermedad localmente avanzada conlleva un alto riesgo de recidiva local (del 15% al 40%) y de metástasis a distancia [26]. Los enfoques multimodales han mejorado las tasas de curación al tiempo que pretenden preservar la función y la calidad de vida [27]. Las decisiones terapéuticas en estas fases requieren un complejo equilibrio entre la morbilidad, los posibles efectos secundarios y la preservación de la función. También dependen en gran medida del tamaño y la localización anatómica del tumor primario, el estadio de la enfermedad, la edad de la persona afectada, sus preferencias, así como su estado general y las enfermedades concomitantes. Por lo tanto, estas decisiones terapéuticas deben tomarse siempre de forma interdisciplinar en el marco de una junta tumoral.
En el caso de tumores localmente avanzados y resecables, la terapia adyuvante, consistente en radioterapia o radioquimioterapia combinada (RCT), sigue a la resección con intención curativa. Esto depende de los factores de riesgo y las comorbilidades de los afectados. La evidencia microscópica de células tumorales en el resecado (R1) y la evidencia de crecimiento extracapsular en los ganglios linfáticos se consideran factores de riesgo de “alto riesgo”. Si están presentes, se recomienda un ECA combinado adyuvante. El cisplatino se ha consolidado aquí como el agente quimioterapéutico [28,29].
Cuando la resección quirúrgica es técnica o comórbidamente inviable o conduciría a resultados funcionales potencialmente pobres a largo plazo, la ECA definitiva es el estándar curativo establecido. Casi 20.000 pacientes con tumores de cabeza y cuello localmente avanzados fueron incluidos en un gran metaanálisis (Meta-analysis of Chemotherapy in Head and Neck Cancer [MACH-NC]). El ECA combinado demostró reducir la mortalidad a 5 años en 6,5 puntos porcentuales en comparación con la radioterapia sola (HR 0,83; p<0,001). La inducción adicional o la quimioterapia adyuvante no mejoraron significativamente la supervivencia global en comparación con la ECA sola [30]. La dosis alta de cisplatino (100 mg/m2 desuperficie corporal, administrada por vía intravenosa cada 21 días durante tres ciclos) administrada simultáneamente con radioterapia como parte de un ECA definitivo es el tratamiento estándar actual. Sin embargo, debido a las importantes toxicidades a corto y largo plazo asociadas al cisplatino, su uso se reserva principalmente a los pacientes más jóvenes que no presentan comorbilidades graves [30–32]. Esto dio lugar a varias modificaciones y variaciones del régimen originalmente utilizado de cisplatino (una vez cada tres semanas). En las revisiones sistemáticas, los datos se compararon entre cisplatino una vez a la semana y cisplatino cada tres semanas (criterio de inclusión: dosis acumulada de cisplatino de ≥180 mg/m2). Esto mostró resultados similares y tasas más bajas de efectos secundarios graves, especialmente nefro y ototoxicidad [33]. También pudimos confirmarlo en nuestro propio análisis, aunque la dosis acumulada de cisplatino fue menor en los pacientestratados a intervalos semanales [34]. Por lo tanto, la terapia semanal con cisplatino puede utilizarse como una alternativa aceptable, ya que la dosis es más controlable y la nefro y ototoxicidad suelen ser menos graves. Además, en pacientes que no son aptos para el cisplatino (por ejemplo, pacientes con enfermedad renal crónica, pérdida de audición crónica, edad avanzada o estado funcional ECOG límite), el carboplatino se utiliza a menudo en combinación con un taxano, aunque no existe una comparación directa en ensayos controlados aleatorizados. El cetuximab administrado simultáneamente con radioterapia ya fue aprobado como terapia estándar en 2006 después de que los datos demostraran que este tratamiento producía una mejora del control locorregional y de la supervivencia global en comparación con la radioterapia sola [35]. Sin embargo, estudios aleatorizados recientes sugieren que la radioterapia combinada con cetuximab en pacientescon carcinoma orofaríngeo VPH-positivo consigue peores resultados, incluida una menor tasa de supervivencia, en comparación directa con las altas dosis de cisplatino en combinación con radioterapia [36,37]. Así pues, la ECA combinada con cisplatino sigue siendo la terapia estándar preferida.
Otro enfoque prometedor para mejorar el pronóstico es combinar la ECA basada en cisplatino con xevinapant. El xevinapant es un antagonista de los inhibidores de la apoptosis. En un ensayo aleatorizado de fase II, la adición de xevinapant a la ECA mejoró significativamente la tasa de control tumoral locorregional como criterio de valoración primario en el plazo de 18 meses en un 21% en comparación con el placebo en combinación con la ECA (54% frente a 33%; p=0,026) [38]. Además, se observó un beneficio significativo en términos de supervivencia libre de progresión tras un seguimiento de dos años en comparación con el brazo de control (HR 0,37; p=0,0069). Tras un periodo de seguimiento de tres años, Xevinapant más ECA mostró una reducción estadísticamente significativa del 51% en el riesgo de muerte en comparación con placebo más ECA (HR 0,49; p=0,0261). Para confirmar estos resultados, actualmente se está llevando a cabo el ensayo aleatorizado de fase III TrilynX (NCT04459715).
Debido a los datos alentadores en el cáncer de cabeza y cuello recidivante/metastásico, numerosos estudios investigan actualmente el uso de inhibidores de puntos de control inmunitarios en estadios más tempranos, especialmente en tumores localmente avanzados en combinación con ECA. Por ejemplo, el estudio multinacional de fase III JAVELIN Head and Neck 100 [39] ya investigó la eficacia del avelumab, un inhibidor de PD-L1, en combinación con ECA con cisplatino en comparación con el placebo en combinación con ECA. El ensayo se interrumpió prematuramente tras un análisis intermedio porque no mostró ninguna mejora en el tiempo libre de progresión [40]. Un estudio en curso está investigando el valor de la terapia de mantenimiento con atezolizumab tras la finalización del ECA (IMvoke010; NCT03452137). Otros estudios están probando ECA combinados con inhibidores de puntos de control inmunitarios seguidos de terapia de mantenimiento. El mayor de estos ensayos es KEYNOTE-412 (pembrolizumab frente a placebo; NCT03040999).
Otro enfoque interesante que se ha investigado en varios tumores y que ha dado resultados prometedores es el uso neoadyuvante de inhibidores de puntos de control inmunitarios [41,42]. Teniendo en cuenta la situación de tratamiento naïve y la falta de células resistentes al tratamiento en comparación con la situación de recaída/metastásica, la inmunoterapia neoadyuvante puede conseguir un efecto terapéutico más potente y duradero. Por ejemplo, el tratamiento neoadyuvante anti-PD-1 en un modelo de ratón con tumores de cabeza y cuello dio lugar a una conversión de la inmunodominancia funcional e indujo respuestas inmunitarias robustas dirigidas contra el tumor [43]. Schoenfeld et al. investigaron el nivolumab (N) de forma neoadyuvante en un estudio de fase II y la combinación de nivolumab más ipilimumab (N+I) en una segunda cohorte de 29 pacientes no tratados con carcinoma de cavidad oral [44]. El nivolumab (3 mg/kg) se administró en las semanas 1 y 3, mientras que el ipilimumab (1 mg/kg) se administró sólo en la semana 1. Aunque un total de 21 pacientes experimentaron acontecimientos adversos, incluidos de grado 3/4 en 2 (N) y 5 (N+I) pacientes, no hubo retrasos en la cirugía. Además, hubo pruebas de respuesta a estas terapias en ambas cohortes. En concreto, cuatro pacientes (N, n=1; N+I, n=3) tuvieron una respuesta completa o casi completa (<10% de células tumorales vitales). Estos resultados hablan en favor de la tolerabilidad clínica y la eficacia de la inmunoterapia neoadyuvante. El estudio CAIO [45], el estudio IMCISION [46], el estudio CheckMate 358 [47], así como otros estudios [48–50], han aportado otros datos interesantes sobre el uso neoadyuvante de inhibidores de puntos de control inmunitarios, todos los cuales han demostrado la viabilidad y eficacia de esta estrategia terapéutica. En consecuencia, se iniciaron estudios más amplios sobre esta base (por ejemplo, el estudio aleatorizado de fase III KEYNOTE-689, NCT03765918). Además, es importante explorar posibles predictores de respuesta para permitir la selección de pacientes adecuados. En este caso, es importante un análisis detallado de las muestras tumorales, así como de los posibles cambios en el microambiente tumoral y de las células inmunitarias infiltradas en el tumor.
Resumen/Conclusión
La introducción de la inmunoterapia en el tratamiento de los tumores de cabeza y cuello recidivantes y/o metastásicos ha cambiado fundamentalmente la terapia de estos cuadros clínicos y ha mejorado significativamente su pronóstico. El tratamiento análogo al del estudio KEYNOTE-048 (quimioterapia con platino + 5-FU + pembrolizumab o pembolizumab mono en función del CPS y la carga tumoral/sintomática) se ha establecido como la nueva terapia paliativa de primera línea. Debido a los resultados alentadores en los estadios tumorales avanzados, la cuestión del beneficio de la inmunoterapia también se plantea para los estadios tumorales más tempranos, en combinación o secuencia con la radioterapia y la quimioterapia. Es muy probable que la secuencia de las distintas modalidades de tratamiento influya significativamente en los resultados. Sobre todo si se tiene en cuenta que la respuesta antitumoral de las células T tiene diferentes fases a las que pueden dirigirse diferentes inmunoterapias, y que tanto la radio como la quimioterapia pueden modular el sistema inmunitario al tiempo que tienen efectos citotóxicos contra las células T [51]. Se están explorando otros enfoques combinados novedosos en ensayos clínicos que combinan inmunoterapias con vacunas contra el VPH, vacunas contra tumores específicos de pacientes, terapias dirigidas a células T, virus oncolíticos y otros inmunomoduladores.
Conflictos de intereses
ED: No hay conflictos de intereses.
SR: Honorarios por servicios de consultoría (pago al Hospital Universitario de Basilea) de Astra-Zeneca, BMS, Boehringer-Ingelheim, Eisai, Eli Lilly, Merck Serono, MSD, Novartis, Pfizer, Roche, Takeda. Financiación de la investigación de AbbVie, Astra-Zeneca, BMS, Boehringer-Ingelheim, Merck. Apoyo a la participación en el congreso de Amgen, AstraZeneca, BMS, Boehringer-Ingelheim, MSD, Roche, Takeda. Miembro de la Comisión Federal de Drogas de la Oficina Federal de Salud Pública.
Mensajes para llevar a casa
- La introducción de la inmunoterapia con inhibidores de los puntos de control inmunitarios en el tratamiento de los tumores de cabeza y cuello recidivantes/metastásicos ha mejorado significativamente el pronóstico de estos pacientes.
- La monoterapia con el anticuerpo anti-PD-1 pembrolizumab en pacientes con alta expresión de PD-L1 (CPS ≥20) y la terapia combinada de platino/5-FU y pembrolizumab (independientemente de la expresión de PD-L1, pero especialmente en el caso de un CPS ≥1) representan el nuevo estándar terapéutico para los tumores de cabeza y cuello recidivantes/metastásicos basado en el estudio KEYNOTE-048.
- Para los tumores localmente avanzados e inoperables, la radioquimioterapia (RCT) definitiva combinada con cisplatino sigue siendo la terapia estándar. Las alternativas farmacológicas al cisplatino en combinación con radioterapia son el carboplatino combinado con un taxano y el cetuximab. El Xevinapant (antagonista de los inhibidores de la apoptosis) como complemento de la ECA parece prometedor (ensayo aleatorizado de fase III actualmente en curso).
- El uso de la inmunoterapia en estadios tumorales más tempranos en combinación con la ECA, como terapia de mantenimiento o en el contexto neoadyuvante, es objeto de estudios en curso.
Literatura:
- Bray F, et al.: Global cancer statistics 2018: GLOBOCAN estimates of incidence and mortality worldwide for 36 cancers in 185 countries. CA Cancer J Clin 2018; 68: 394–424.
- Siegel RL, et al.: An assessment of progress in cancer control. CA Cancer J Clin 2018; 68: 329–339.
- Mourad M, et al.: Epidemiological Trends of Head and Neck Cancer in the United States: A SEER Population Study. J Oral Maxillofac Surg 2017; 75: 2562–2572.
- Fitzmaurice C, et al: Global, regional, and national cancer incidence, mortality, years of life lost, years lived with disability, and disability-adjusted life-years for 32 cancer groups, 1990 to 2015: A Systematic Analysis for the Global Burden of Disease Study Global Burden of Disease Cancer Collaboration. JAMA Oncol. 2017; 3: 524-548.
- Gillison ML, et al.: Epidemiology of Human Papillomavirus–Positive Head and Neck Squamous Cell Carcinoma. J Clin Oncol 2015; 33: 3235–3242.
- Moore EJ, Janus J, Kasperbauer J: Transoral robotic surgery of the oropharynx: Clinical and anatomic considerations. Clin. Anat. 2012; 25: 135–141.
- Weiss BG, et al.: Transoral laser microsurgery for treatment for hypopharyngeal cancer in 211 patients. Head Neck 2017; 39: 1631–1638.
- pta T, et al.: Systematic review and meta-analyses of intensity-modulated radiation therapy versus conventional two-dimensional and/or or three-dimensional radiotherapy in curative-intent management of head and neck squamous cell carcinoma. PLoS One. 2018; 13. DOI:10.1371/journal.pone.0200137.
- Vermorken JB, Specenier P: Optimal treatment for recurrent/metastatic head and neck cancer. Annals of Oncology. Oxford University Press, 2010. DOI:10.1093/annonc/mdq453.
- Vermorken JB, et al.: Platinum-based chemotherapy plus cetuximab in head and neck cancer. N Engl J Med 2008; 359: 1116–1127.
- Saleh K, et al.: New developments in the management of head and neck cancer – Impact of pembrolizumab. Ther. Clin. Risk Manag. 2018; 14: 295–303.
- Ferris RL, et al.: Nivolumab for Recurrent Squamous-Cell Carcinoma of the Head and Neck. N Engl J Med 2016; 375: 1856–1867.
- Harrington KJ, et al.: Nivolumab versus standard, single-agent therapy of investigator’s choice in recurrent or metastatic squamous cell carcinoma of the head and neck (CheckMate 141): health-related quality-of-life results from a randomised, phase 3 trial. Lancet Oncol 2017; 18: 1104–1115.
- Cohen EEW, et al.: Pembrolizumab versus methotrexate, docetaxel, or cetuximab for recurrent or metastatic head-and-neck squamous cell carcinoma (KEYNOTE-040): a randomised, open-label, phase 3 study. Lancet 2019; 393: 156–167.
- Ferris RL, et al.: Nivolumab vs investigator’s choice in recurrent or metastatic squamous cell carcinoma of the head and neck: 2-year long-term survival update of CheckMate 141 with analyses by tumor PD-L1 expression. Oral Oncol 2018; 81: 45–51.
- Zandberg DP, et al.: Durvalumab for recurrent or metastatic head and neck squamous cell carcinoma: Results from a single-arm, phase II study in patients with ≥25% tumour cell PD-L1 expression who have progressed on platinum-based chemotherapy. Eur J Cancer 2019; 107: 142–152.
- Siu LL, et al.: Safety and Efficacy of Durvalumab with or Without Tremelimumab in Patients with PD-L1-Low/Negative Recurrent or Metastatic HNSCC: The Phase 2 CONDOR Randomized Clinical Trial. JAMA Oncol 2019; 5: 195–203.
- Ferris RL, et al.: Durvalumab with or without tremelimumab in patients with recurrent or metastatic head and neck squamous cell carcinoma: EAGLE, a randomized, open-label phase III study. Ann Oncol 2020; 31: 942–950.
- Burtness B, et al.: Pembrolizumab alone or with chemotherapy versus cetuximab with chemotherapy for recurrent or metastatic squamous cell carcinoma of the head and neck (KEYNOTE-048): a randomised, open-label, phase 3 study. Lancet 2019; 394: 1915–1928.
- Burtness B, et al.: Abstract LB-258: Efficacy of first-line (1L) pembrolizumab by PD-L1 combined positive score <1, 1-19, and ≥20 in recurrent and/or metastatic (R/M) head and neck squamous cell carcinoma (HNSCC): KEYNOTE-048 subgroup analysis. Cancer Research. American Association for Cancer Research (AACR), 2020.
- Matlung SE, et al.: Differences in T-cell infiltrates and survival between HPV+ and HPV- oropharyngeal squamous cell carcinoma. Futur. Sci. OA. 2016; 2. DOI:10.4155/fso.15.88.
- Bauml J, et al.: Pembrolizumab for Platinum- and Cetuximab-Refractory Head and Neck Cancer: Results From a Single-Arm, Phase II Study. J Clin Oncol 2017; 35: 1542–9.
- Wang J, et al.: HPV-positive status associated with inflamed immune microenvironment and improved response to anti-PD-1 therapy in head and neck squamous cell carcinoma. Sci Rep 2019; 9. DOI:10.1038/s41598-019-49771-0.
- Xu Y, et al.: Programmed Death-1/Programmed Death-Ligand 1-Axis Blockade in Recurrent or Metastatic Head and Neck Squamous Cell Carcinoma Stratified by Human Papillomavirus Status: A Systematic Review and Meta-Analysis. Front Immunol 2021; 12. DOI:10.3389/fimmu.2021.645170.
- Cohen EEW, et al.: The Society for Immunotherapy of Cancer consensus statement on immunotherapy for the treatment of squamous cell carcinoma of the head and neck (HNSCC). J Immunother Cancer 2019; 7. DOI:10.1186/s40425-019-0662-5.
- Braakhuis BJM, Brakenhoff RH, René Leemans C: Treatment choice for locally advanced head and neck cancers on the basis of risk factors: Biological risk factors. Ann Oncol 2012; 23.
DOI:10.1093/annonc/mds299. - Brana I, Siu LL: Locally advanced head and neck squamous cell cancer: Treatment choice based on risk factors and optimizing drug prescription. Ann Oncol 2012; 23. DOI:10.1093/annonc/mds322.
- Cooper JS, et al.: Postoperative concurrent radiotherapy and chemotherapy for high-risk squamous-cell carcinoma of the head and neck. N Engl J Med 2004; 350: 1937–1944.
- Bernier J, et al.: Postoperative irradiation with or without concomitant chemotherapy for locally advanced head and neck cancer.
N Engl J Med 2004; 350: 1945–1952. - Pignon JP, et al.: Meta-analysis of chemotherapy in head and neck cancer (MACH-NC): an update on 93 randomised trials and 17,346 patients. Radiother Oncol 2009; 92: 4–14.
- Adelstein D, et al.: NCCN guidelines® insights head and neck cancers, version 2.2017 featured updates to the NCCN guidelines. JNCCN J Natl Compr Cancer Netw 2017; 15: 761–770.
- Adelstein DJ, et al.: An intergroup phase III comparison of standard radiation therapy and two schedules of concurrent chemoradiotherapy in patients with unresectable squamous cell head and neck cancer. J Clin Oncol 2003; 21: 92–98.
- Mohamed A, et al.: Concurrent chemoradiotherapy with weekly versus triweekly cisplatin in locally advanced squamous cell carcinoma of the head and neck: Comparative analysis. Head Neck. 2019; 41: 1490–1498.
- Helfenstein S, et al.: 3-weekly or weekly cisplatin concurrently with radiotherapy for patients with squamous cell carcinoma of the head and neck – A multicentre, retrospective analysis. Radiat Oncol 2019; 14. DOI:10.1186/s13014-019-1235-y.
- Bonner JA, et al.: Radiotherapy plus cetuximab for locoregionally advanced head and neck cancer: 5-year survival data from a phase 3 randomised trial, and relation between cetuximab-induced rash and survival. Lancet Oncol 2010; 11: 21–28.
- Mehanna H, et al.: Radiotherapy plus cisplatin or cetuximab in low-risk human papillomavirus-positive oropharyngeal cancer (De-ESCALaTE HPV): an open-label randomised controlled phase 3 trial. Lancet 2019; 393: 51–60.
- Gillison ML, et al.: Radiotherapy plus cetuximab or cisplatin in human papillomavirus-positive oropharyngeal cancer (NRG Oncology RTOG 1016): a randomised, multicentre, non-inferiority trial. Lancet 2019; 393: 40–50.
- Bourhis J, et al.: TrilynX: A phase 3 trial of xevinapant and concurrent chemoradiation for locally advanced head and neck cancer. J Clin Oncol 2021; 39: TPS6091–TPS6091.
- Yu Y, Lee NY: JAVELIN Head and Neck 100: A Phase III trial of avelumab and chemoradiation for locally advanced head and neck cancer. Futur Oncol 2019; 15: 687–694.
- Cohen EE, et al.: Primary results of the phase III JAVELIN head & neck 100 trial: Avelumab plus chemoradiotherapy (CRT) followed by avelumab maintenance vs CRT in patients with locally advanced squamous cell carcinoma of the head and neck (LA SCCHN). ESMO Congress 2020: Annals of Oncology (2020) 31 (suppl_4): S599–S628.
- Topalian SL, Taube JM, Pardoll DM: Neoadjuvant checkpoint blockade for cancer immunotherapy. Science 2020; 367. DOI:10.1126/science.aax0182.
- Rothschild SI, et al.: SAKK 16/14: Durvalumab in Addition to Neoadjuvant Chemotherapy in Patients With Stage IIIA(N2) Non-Small-Cell Lung Cancer-A Multicenter Single-Arm Phase II Trial. J Clin Oncol 2021; 39: 2872–2880.
- Friedman J, et al.: Neoadjuvant PD-1 immune checkpoint blockade reverses functional immunodominance among tumor antigen–specific T cells. Clin Cancer Res 2020; 26: 679–689.
- Schoenfeld JD, et al.: Neoadjuvant Nivolumab or Nivolumab plus Ipilimumab in Untreated Oral Cavity Squamous Cell Carcinoma: A Phase 2 Open-Label Randomized Clinical Trial. JAMA Oncol 2020; 6: 1563–1570.
- Ferrarotto R, et al.: Impact of neoadjuvant durvalumab with or without tremelimumab on CD8+ tumor lymphocyte density, safety, and efficacy in patients with oropharynx cancer: CIAO trial results. Clin Cancer Res 2020; 26: 3211–3219.
- Vos JL, et al.: Neoadjuvant immunotherapy with nivolumab and ipilimumab induces major pathological responses in patients with head and neck squamous cell carcinoma. Nat Commun 2021; 12. DOI:10.1038/s41467-021-26472-9.
- Ferris RL, et al.: Neoadjuvant nivolumab for patients with resectable HPV-positive and HPV-negative squamous cell carcinomas of the head and neck in the CheckMate 358 trial. J Immunother Cancer 2021; 9. DOI:10.1136/jitc-2021-002568.
- Merlino DJ, et al.: Discordant Responses Between Primary Head and Neck Tumors and Nodal Metastases Treated With Neoadjuvant Nivolumab: Correlation of Radiographic and Pathologic Treatment Effect. Front Oncol 2020; 10. DOI:10.3389/fonc.2020.566315.
- Xiong Y, et al.: Immunological effects of nivolumab immunotherapy in patients with oral cavity squamous cell carcinoma. BMC Cancer 2020; 20. DOI: 10.1186/s12885-020-06726-3.
- Uppaluri R, et al.: Neoadjuvant and Adjuvant Pembrolizumab in Resectable Locally Advanced, Human Papillomavirus–Unrelated Head and Neck Cancer: A Multicenter, Phase II Trial. Clin Cancer Res 2020; 26: 5140–5152.
- Yan Y, et al.: Combining Immune Checkpoint Inhibitors With Conventional Cancer Therapy. Front Immunol 2018; 9. DOI:10.3389/fimmu.2018.01739.
DERMATOLOGIE PRAXIS 2023; 33(5): 6–12