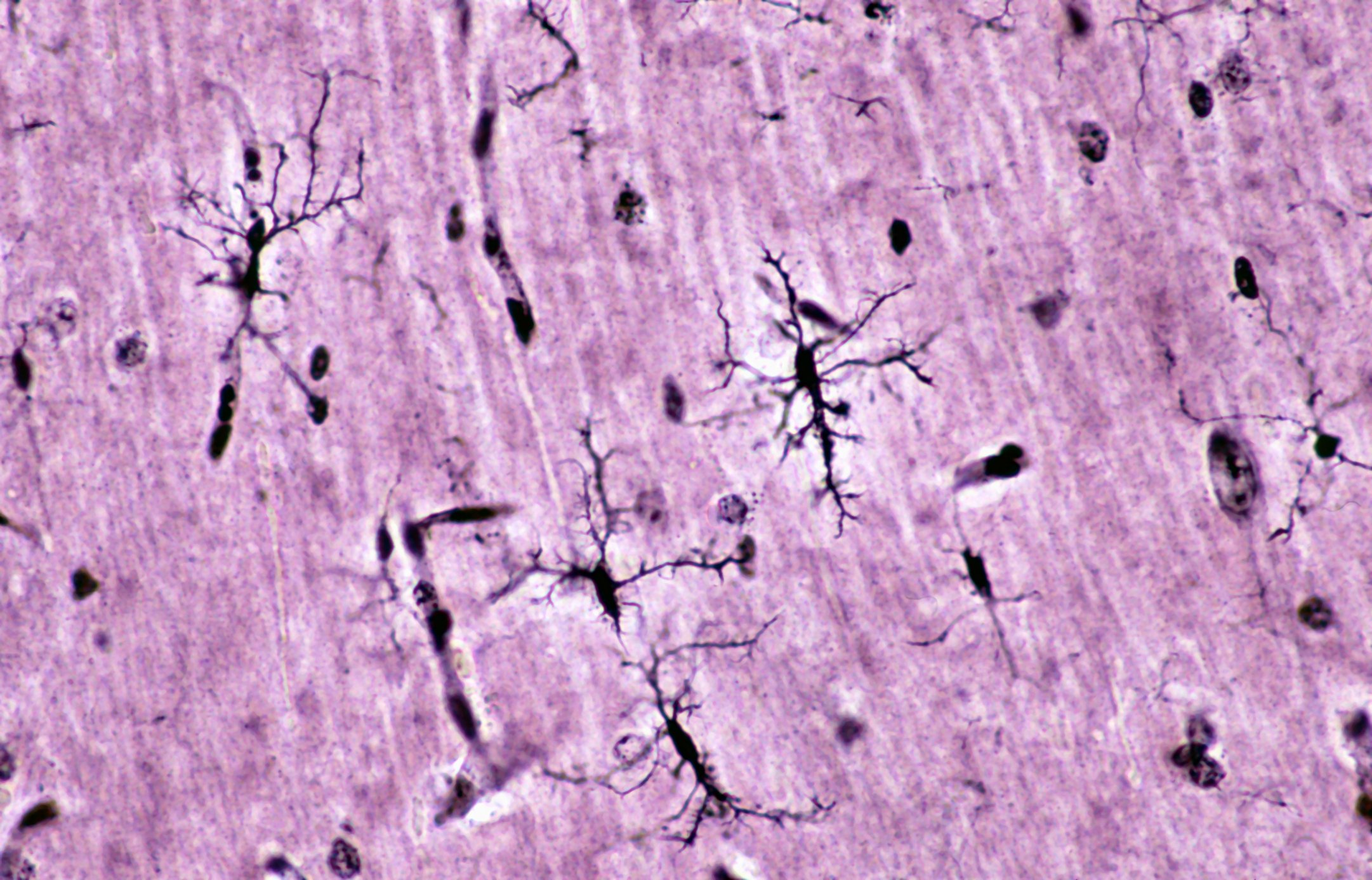
La puntuación focal (FS) en las biopsias de las glándulas salivales menores labiales es uno de los dos criterios más importantes (junto con la positividad anti-SSA) para el diagnóstico del síndrome de Sjögren primario (SSp). Con el fin de reducir las tasas de error en el diagnóstico, los algoritmos de aprendizaje profundo que utilizan redes neuronales artificiales podrían servir de apoyo a los patólogos en el futuro.
Según los criterios ACR/EULAR para el pSS, la clasificación de la puntuación de enfoque (FS) es uno de los tres criterios de clasificación, pero requiere unos conocimientos especializados que no siempre están disponibles en la práctica. El 53% de los casos conducen a una revisión del diagnóstico cuando son evaluados por expertos.
El aprendizaje automático implica familias de algoritmos que pueden tomar una gran cantidad de datos y utilizarlos para predecir algo, por ejemplo. El aprendizaje profundo es un subconjunto de este campo que se centra en una sola familia de algoritmos y se denomina “redes neuronales profundas”, explica a modo de introducción Louis Basseto, Scienta Lab, Departamento de Investigación, París [1].
El aprendizaje profundo ya se utiliza en patología médica, por ejemplo en el cáncer de mama, donde ya se emplean algoritmos para reconocer metástasis en muestras de tejido de ganglios linfáticos con gran precisión y mejor rendimiento que los patólogos. “Nuestro grupo también ha demostrado que el aprendizaje automático puede utilizarse en la artritis reumatoide para predecir la respuesta al metotrexato y a los inhibidores del TNF”. Ahora, los investigadores se han propuesto aplicar el aprendizaje profundo al síndrome de Sjögren y averiguar si puede ayudar en la categorización de la puntuación del foco y en el diagnóstico del pSS?
Aprendizaje profundo basado en biopsias de glándulas salivales
Para ello, desarrollaron dos redes de aprendizaje profundo utilizando biopsias digitalizadas de glándulas salivales labiales de pacientes para predecir la puntuación focal (FS ≥1 o FS <1) y el diagnóstico del síndrome de Sjögren primario basándose únicamente en la histología (pSS+ o pSS-). En el estudio participaron 325 pacientes (145 de la Universidad de París-Saclay, Hospital de Bicêtre, 71 de la Universidad Queen Mary de Londres y 109 de la Universidad de Birmingham), utilizando biopsias tomadas en la práctica clínica habitual. Los participantes se dividieron en tres grupos:
- pSS y FS <1 (32%, síntomas de sicca)
- pSS+ y FS ≥1 (47%)
- pSS+ y FS <1 (21%)
Todos los FS fueron confirmados previamente por patólogos y los diagnósticos de pSS por expertos.
Se utilizan una o varias imágenes de la biopsia para realizar una predicción. Cada imagen se divide en mosaicos y el algoritmo asigna una puntuación de riesgo a cada uno de estos mosaicos de forma independiente. A continuación, toda esta información se combina para hacer una predicción de la puntuación del foco o del diagnóstico, dependiendo del algoritmo que se utilice.
“Utilizamos dos conjuntos de datos diferentes”, explicó Basseto: un conjunto de entrenamiento (70% de los pacientes) y un conjunto de validación (30% de los pacientes). Los dos conjuntos contienen la misma proporción de clases positivas y negativas (pSS+/pSS- o FS ≥1/FS <1) und die verschiedenen Zentren, aus denen sich die Teilnehmer zusammensetzen, sind im Training und in der Validierung gemischt. Diese beiden Aufgaben nennt man «semi-supervised learning», also halbüberwachtes Lernen. «Das ist der Schlüssel zum Verständnis der Arbeit: Halbüberwachtes Lernen bedeutet, dass wir dem Modell im Training zwar Informationen geben – z.B. sagen wir ihm, wenn ein Patient einen FS>1. Sin embargo, no decimos qué partes de las imágenes llevarían a un patólogo a creer esto. El modelo lo determina a partir de los propios datos”.
Nuevos biomarcadores potenciales
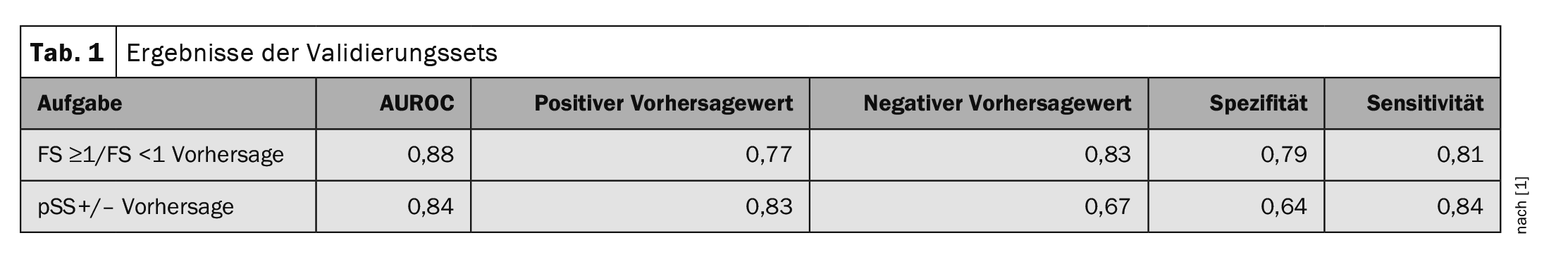
El rendimiento del algoritmo se midió mediante el área bajo la curva ROC (AUROC). En cuanto a la puntuación de enfoque (FS ≥1/FS <1), el algoritmo logró un AUROC de 0,88. El 77% de las predicciones positivas eran en realidad pacientes con una puntuación de enfoque ≥1. En el caso del valor de predicción negativo, el 83% de los datos indicaron correctamente que se trataba de un FS<1. En el caso de la predicción del diagnóstico, el AUROC fue de 0,84. El 83% de los pacientes con una predicción positiva del algoritmo eran realmente Sjögren positivos (pSS+) y el 67% de los pacientes con una predicción negativa eran realmente Sjögren negativos (pSS-) (Tabla 1).
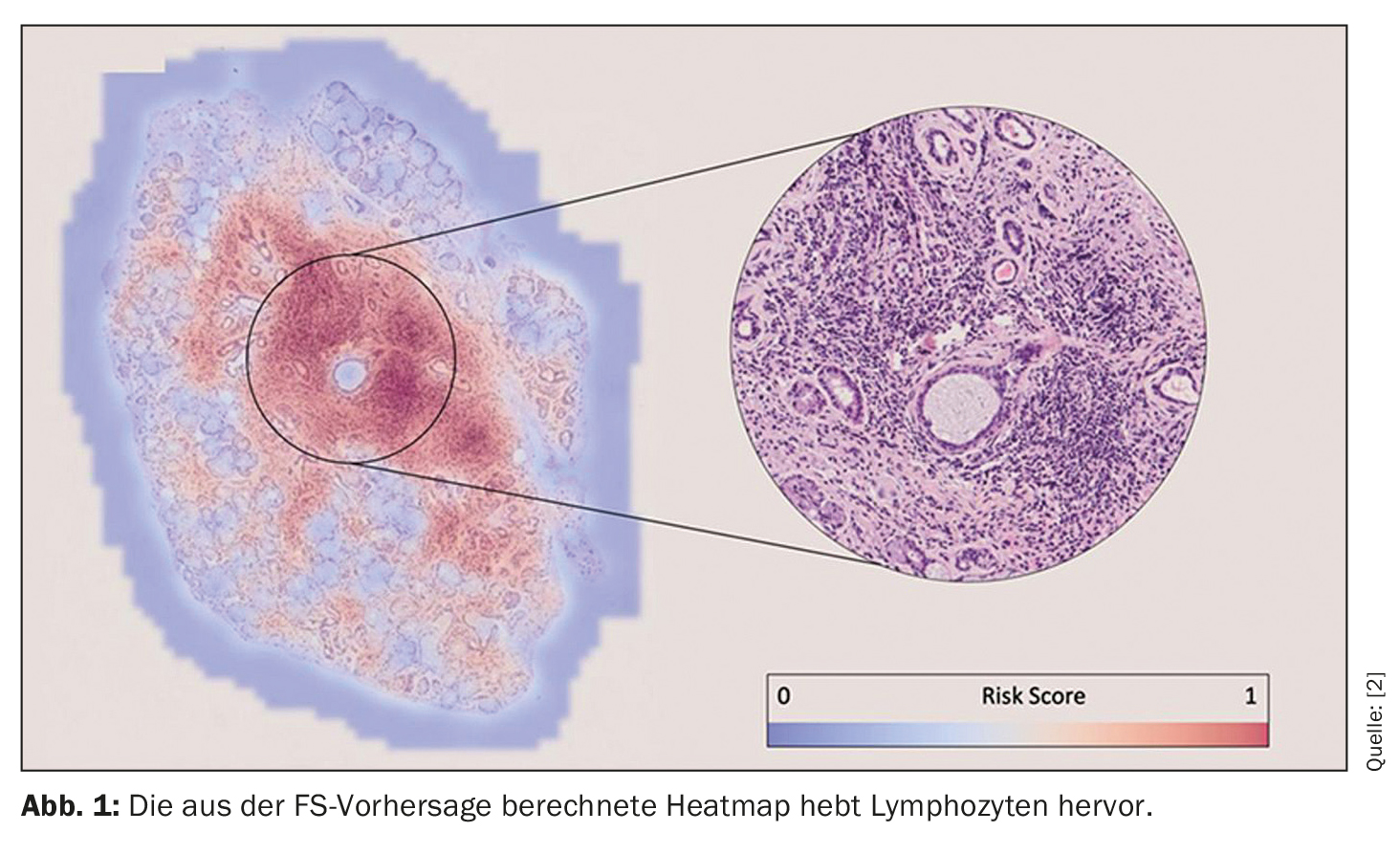
“Estas predicciones se hicieron únicamente sobre la base de las imágenes. No le dijimos al algoritmo dónde mirar para tomar su decisión, pero después del entrenamiento, podemos revisar los algoritmos para ver en qué se basaron para hacer sus predicciones.” El hallazgo de los investigadores fue que el algoritmo para la puntuación del foco identificó los focos de linfocitos para hacer una predicción (Fig. 1). Esto garantiza la explicabilidad y permite al patólogo confirmar visualmente los resultados de la predicción. Por lo tanto, esto es tranquilizador para el SL, afirma Basseto, “pero lo que es tranquilizador para el SL es muy emocionante para el diagnóstico, ya que podría conducir a la identificación potencial de nuevos biomarcadores histológicos que sólo son de interés para la población pSS+ y SL<1)”. Este aspecto es de especial interés para los futuros trabajos del grupo de investigación.
Mensajes para llevar a casa
- El aprendizaje profundo predice con precisión la puntuación de enfoque y el diagnóstico del síndrome de Sjögren primario a partir de biopsias de glándulas salivales labiales.
- El aprendizaje profundo podría reducir potencialmente la tasa de error en el diagnóstico en ~2,5 veces. La tasa de error debida al aprendizaje profundo es del 19,7% frente al 53% de los centros no expertos.
Perspectivas:
- Se necesitan más evaluaciones clínicas para validar los algoritmos en la práctica clínica real.
- Validación adicional en una cohorte mayor.
- Los trabajos en curso pretenden identificar nuevos biomarcadores histológicos asociados al diagnóstico del SSp.
Congreso: EULAR 2023
Fuente:
- Basseto L: Vortrag «Deep Learning Accurately Predicts Focus Score and Diagnosis of Primary Sjögren Syndrome using Labial Salivary Gland Biopsies»; EULAR 2023, Mailand, 2.6.2023 (online).
- Basseto L: Scientific Abstract OP0232, EULAR 2023; doi: 10.1136/annrheumdis-2023-eular.418.
InFo RHEUMATOLOGIE 2023: 5(2): 20–21