La privación del sueño ha sido una opción terapéutica crónica común para los trastornos depresivos durante varias décadas. El tratamiento de privación del sueño es rápido y bien eficaz, fácil de realizar, no invasivo, rentable y adecuado para la terapia de la depresión ambulatoria y hospitalaria. La privación de sueño conduce a una disociación funcional del cíngulo anterior de la red en reposo del cerebro, así como a un mayor reclutamiento del córtex prefrontal dorsolateral. La terapia basada en pautas incluye la privación del sueño como elemento complementario para una respuesta rápida y un aumento del tratamiento existente. La privación del sueño no debe realizarse en pacientes con antecedentes de convulsiones o depresión delirante.
Existe una estrecha relación entre la afectividad y los ritmos cronobiológicos. El ciclo sueño-vigilia desempeña un papel especial a este respecto: los cambios en la arquitectura del sueño y el afecto, ya sea hacia el polo depresivo o el maníaco, son mutuamente dependientes. Alrededor del 60-80% de los pacientes con un trastorno depresivo padecen también insomnio. Las alteraciones del sueño -especialmente los despertares matutinos- suelen preceder inmediatamente a un episodio depresivo. Así, a primera vista, parece paradójico que restringir el sueño pueda conducir a un alivio clínicamente relevante de los síntomas en una depresión ya manifiesta. El tratamiento de privación del sueño, o terapia de vigilia, se incluye en el grupo de las cronoterapias. Se trata de cambiar las condiciones ambientales de forma que se influya específicamente en los biorritmos de los pacientes (por ejemplo, privación del sueño, cambio de fase del sueño, terapia de luz, terapia de oscuridad). Más de 60 estudios han demostrado que entre el 50 y el 80% de todos los pacientes deprimidos se benefician significativamente de la privación de sueño. Especialmente en condiciones de tratamiento complicadas como la depresión bipolar, que se asocia a una baja respuesta a la medicación antidepresiva, puede producirse un efecto antidepresivo en más de la mitad de los pacientes [1]. La potencia del efecto es comparable a la de los antidepresivos estándar, con una mejor tolerabilidad al mismo tiempo. Una característica especialmente importante es que el mismo efecto antidepresivo, que se consigue con la medicación antidepresiva sólo después de cuatro a seis semanas, ya se produce en 24 – 48 horas. La privación del sueño y el tratamiento aún poco establecido con infusiones de ketamina son, por tanto, las dos únicas estrategias terapéuticas antidepresivas disponibles con un inicio de acción inmediato [2].
Una desventaja del tratamiento es la corta duración del efecto: así, más del 80% de los pacientes vuelven a recaer después de sólo una noche de sueño (la llamada noche de recuperación) [3], ciertos pacientes ya después de breves “siestas” o breves episodios de sueño durante el día después de la privación de sueño. Sin embargo, hay estudios que mostraron una respuesta sostenida tras la privación total de sueño en el 5-10% de los pacientes depresivos bipolares estudiados. En los últimos años se han desarrollado diversas estrategias para producir una remisión sostenida (por ejemplo, combinaciones con litio, antidepresivos y fototerapia). El efecto antidepresivo fuerte e inmediato, pero sólo de corta duración, hace también de la privación del sueño un método experimental preferido en la investigación de la depresión, ya que aquí se desencadena obviamente un mecanismo neurobiológico que decide en forma de “interruptor” sobre el estado del sistema “depresivo” o “no depresivo”. Después de que al principio se investigaran los efectos de la privación del sueño sobre la regulación electrofisiológica-homeostática y sobre la neurotransmisión, que mostraban un aumento del tono serotoninérgico, noradrenérgico y dopaminérgico, estudios más recientes utilizaron principalmente la imagen cerebral funcional.
Cambios en la conectividad cerebral tras la privación de sueño
Los primeros estudios de tomografía por emisión de positrones (PET) mostraron que ciertos pacientes deprimidos tenían hiperactividad metabólica en el córtex cingulado anterior (ACC) e hipoactividad en el córtex prefrontal dorsolateral (DLPFC). Una normalización opuesta de estos cambios se correlacionó con un alivio de los síntomas de la depresión. Los nuevos métodos de investigación, como el análisis de la conectividad de las redes cerebrales mediante imágenes por resonancia magnética funcional (IRMf), han permitido comprender mejor la fisiopatología de los síndromes depresivos. Por ejemplo, se ha identificado un área en el córtex prefrontal conocida como nexo dorsal, que muestra una marcada hiperconectividad con varias redes cerebrales en pacientes deprimidos [4]. Esta zona puede servir potencialmente como estructura diana o biomarcador para la investigación de terapias antidepresivas.
Un estudio de nuestro propio grupo de investigación ha demostrado ahora que la privación de sueño en individuos sanos conduce a una disociación funcional de la ACC de la red en reposo, con un aumento concomitante del reclutamiento de áreas de la DLPFC a través del nexo dorsal. En estudios posteriores, es importante examinar si los pacientes deprimidos con sobreactivación patológica del ACC e hipoactividad simultánea del DLPFC -como se sabe por estudios anteriores- se benefician específicamente de una intervención que corrija este patrón mediante la privación de sueño [5].
Práctica de la privación del sueño en el tratamiento de la depresión
A pesar de las buenas pruebas científicas sobre la eficacia y la seguridad del tratamiento de privación del sueño, todavía no tiene un estatus adecuado, especialmente en atención primaria. En la S3/Directriz Nacional de Asistencia Sanitaria de la Sociedad Alemana de Psiquiatría, Psicoterapia, Psicosomática y Neurología (DGPPN), se considera principalmente en el contexto de la oferta multimodal de las salas psiquiátrico-psicoterapéuticas. El entorno hospitalario tiene la ventaja de que la permanencia despierta se ve facilitada por el agrupamiento de los pacientes privados de sueño y la vigilancia del personal de enfermería.
Sin embargo, su facilidad de uso, su carácter no invasivo y su rentabilidad también los hacen atractivos para su uso ambulatorio. Según la directriz S3, la privación del sueño debe utilizarse como medida complementaria a un tratamiento existente, sobre todo si se quiere lograr una respuesta rápida o aumentar una terapia insuficiente (Tab. 1 ) [6].

Las indicaciones incluyen tanto la depresión unipolar como la bipolar, especialmente en cursos refractarios a la terapia. Los pacientes bipolares parecen beneficiarse incluso más que los unipolares, de modo que algunos autores ven la indicación principal del tratamiento de privación del sueño en este grupo de pacientes [7]. Los predictores clínicos de una respuesta a la privación de sueño son los cambios de humor durante el día y la presencia de un síndrome somático (“depresión melancólica”).
Dado que la privación del sueño provoca una disminución del umbral convulsivo, los pacientes con antecedentes de convulsiones no deben ser tratados de este modo, o sólo bajo una vigilancia intensiva continua. Lo mismo se aplica a los pacientes con depresión delirante, suicidalidad aguda y multimorbilidad. El principal efecto secundario es, obviamente, el aumento de la somnolencia diurna, por lo que los pacientes no deben conducir vehículos durante las horas de vigilia. Además, se han descrito cambios maníacos en pacientes bipolares, pero el riesgo no es mayor que el de los ISRS. Por lo tanto, debe tenerse especial cuidado con los pacientes de ciclación rápida. Debido al estrés físico que provoca la privación de sueño, también debe prestarse especial atención a la presencia de enfermedades cardiovasculares (Tab. 2).

Prácticamente, se utilizan dos formas de tratamiento de privación del sueño:
- En la privación parcial del sueño , el paciente se duerme sobre las 22:00 horas, se despierta a la 1:00 (o 3:00) de la madrugada de la misma noche y vuelve a conciliar el sueño normal la noche siguiente.
- En la privación total del sueño , el paciente se levanta a las 7:00 h del primer día y pasa por una fase de vigilia de 36 horas hasta las 19:00 h del día siguiente. A esto le sigue un sueño de recuperación de doce horas hasta las 7 de la mañana del día siguiente, tras el cual puede comenzar un nuevo ciclo (Fig. 1).
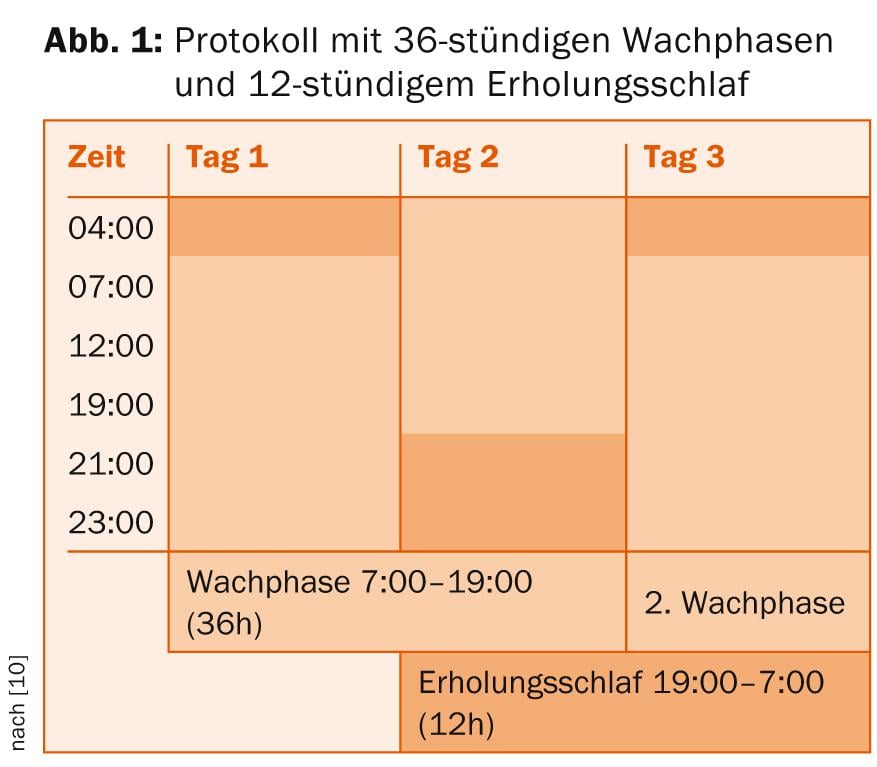
Basado en la evidencia es la aplicación de tres períodos de privación total de sueño en el plazo de una semana. La medicación existente debe continuarse en cualquier caso, pero si es necesario, deben hacerse ajustes en la medicación sedante para no dificultar innecesariamente el permanecer despierto. Otra forma de potenciar y posiblemente prolongar el efecto antidepresivo de la privación del sueño es utilizar combinaciones con antidepresivos y litio (según la directriz S3 también pindolol y hormonas tiroideas). Sin embargo, el tratamiento de privación del sueño también puede llevarse a cabo sin medicación adicional [8]. Un protocolo en el que la fototerapia (10.000 lux durante al menos 30 minutos) se aplica adicionalmente durante las fases de vigilia y por la mañana tras el sueño de recuperación parece ser especialmente prometedor [9].
La eficacia del tratamiento de privación del sueño se ha demostrado en numerosos estudios internacionales con miles de pacientes deprimidos. Una combinación racional y científicamente sólida con otras intervenciones cronoterapéuticas como la fototerapia mejora el resultado, que es comparable al del tratamiento farmacológico, con un inicio de acción significativamente más rápido y menos efectos secundarios indeseables. Un manual desarrollado en los últimos años también facilita la aplicación del tratamiento de privación del sueño en entornos ambulatorios y hospitalarios [10].
El uso de la privación del sueño en la investigación médica ha proporcionado conocimientos fascinantes sobre las conexiones entre la afectividad y la cronobiología. Debido a la creciente evidencia sobre la eficacia y seguridad del tratamiento de privación del sueño, así como a la relevancia de sus biomecanismos, cada vez es considerado por más clínicos e investigadores como un tratamiento de primera línea para los trastornos afectivos [7].
Literatura:
- Wirz-Justice A, Terman M: Handb Clin Neurol 2012; 106: 697-713.
- Bunney BG, Bunney WE: Biol Psiquiatría 2013; 73(12): 1164-1171.
- Hemmeter UM, Hemmeter-Spernal J, Krieg JC: Expert Rev Neurother 2010; 10(7): 1101-1115.
- Sheline YI, et al: Proc Natl Acad Sci U S A 2010; 107(24): 11020-11025.
- Bosch OG, et al: Proc Natl Acad Sci U S A 2013; 110(48): 19597-19602.
- DGPPN, et al.: 2010, Berlín, Heidelberg, Nueva York: Springer-Verlag GmbH.
- Benedetti F, Colombo C: Neuropsicobiología 2011; 64(3): 141-151.
- Bauer M, et al: World J Biol Psychiatry 2013; 14(5): 334-385.
- Dallaspezia S, Benedetti F: Expert Rev Neurother 2011; 11(7): 961-970.
- Wirz-Justice A, Benedetti F, Terman M: 2009, Basilea, Suiza: Karger.
InFo NEUROLOGÍA Y PSIQUIATRÍA 2014; 12(2): 16-18.