La cirugía es la forma más importante de tratamiento del meningioma, seguida de la radioterapia. Este último se utiliza para los tumores de mayor grado, los que presentan restos no extirpables o para determinados meningiomas de la base del cráneo.
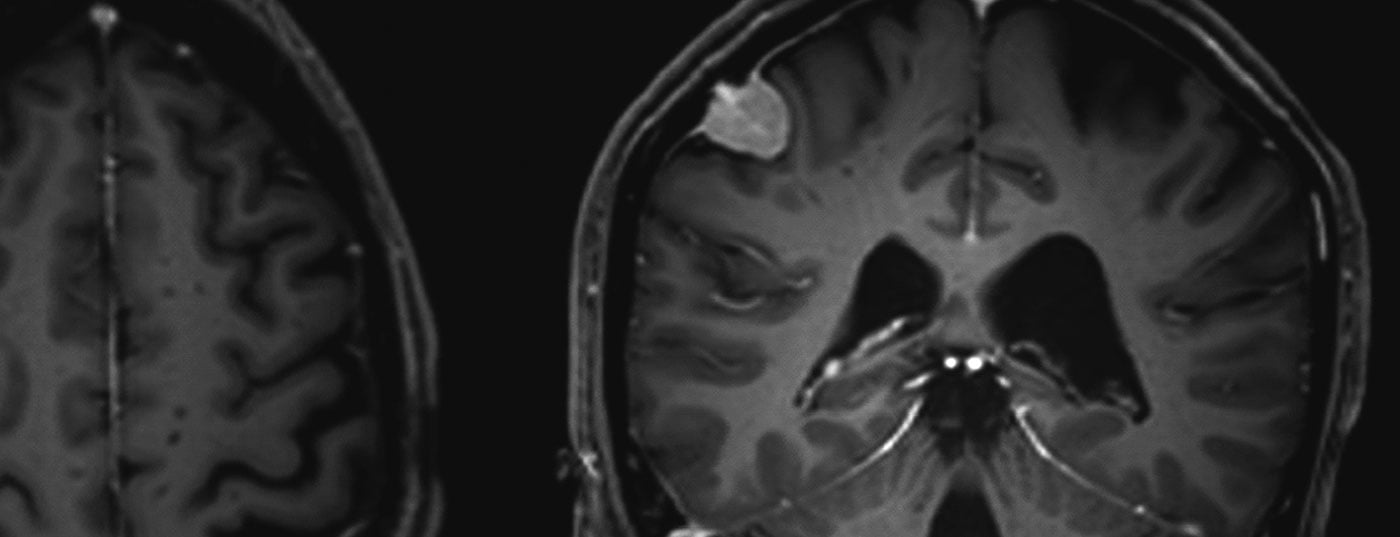
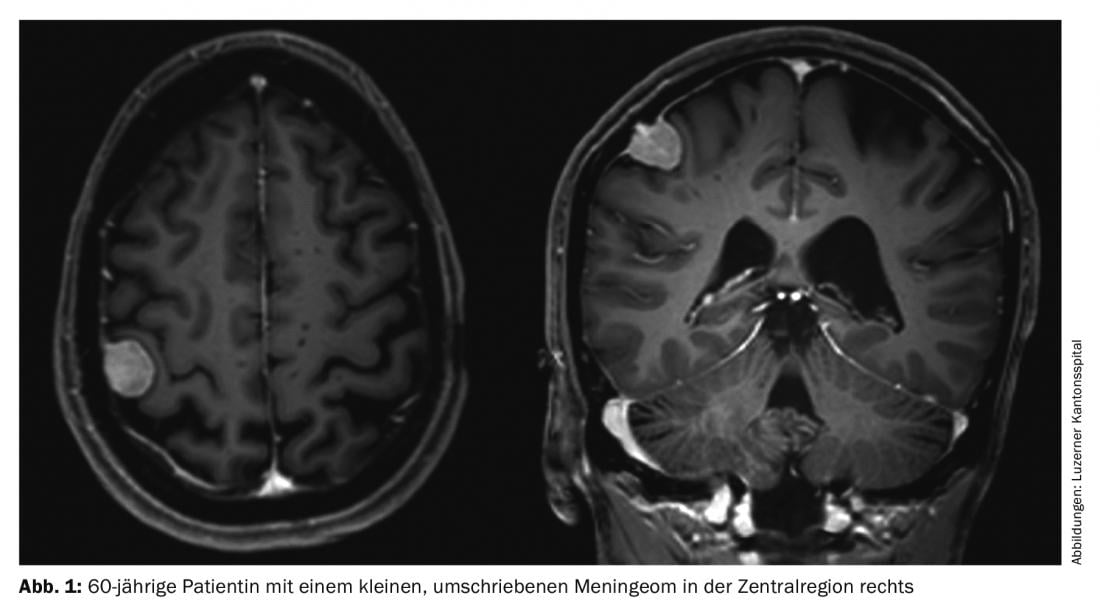
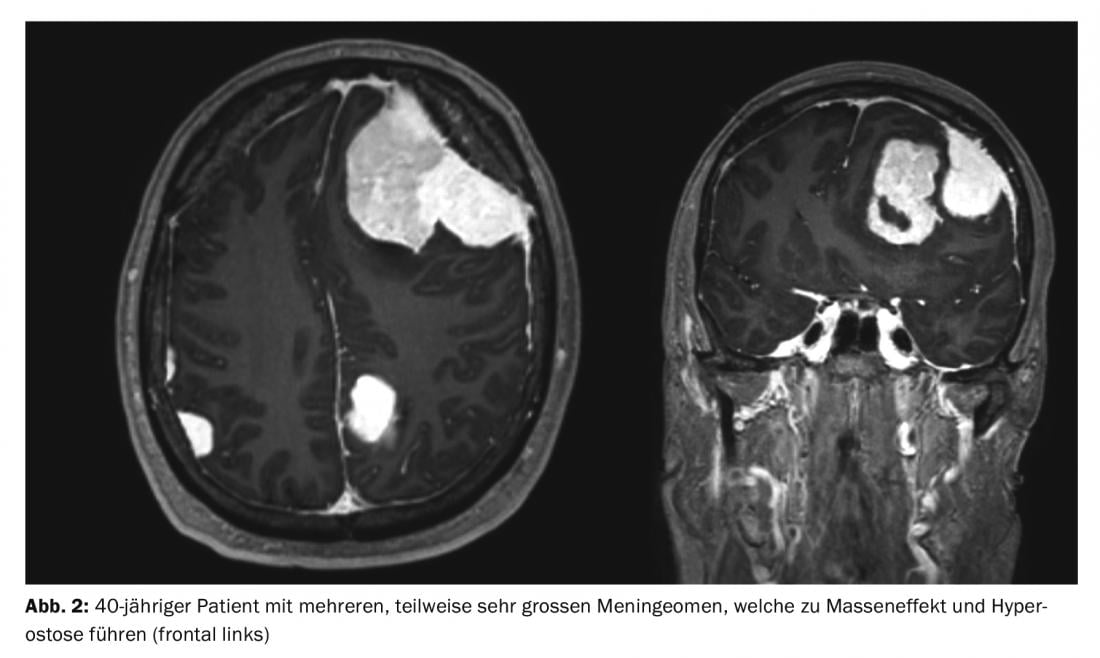
Los meningiomas representan aproximadamente un tercio de todos los tumores primarios del sistema nervioso central. En EE.UU. se registra una incidencia de 7,61/100.000 habitantes entre 2008 y 2012 [1]. Se trata de tumores predominantemente benignos y de crecimiento lento. Estos pueden afectar a todo el eje neural. Surgen de las células meningoteliales aracnoideas y, por tanto, son en su mayoría intracraneales-extraaxiales (craneales) o intradurales-extramedulares (espinales). Los tumores múltiples están presentes en el 8% de los casos (Fig. 1 y 2) [2], especialmente en síndromes genéticos como la neurofibromatosis. La localización espinal se encuentra en alrededor del 10% de los casos. Los meningiomas intracraneales se localizan con mayor frecuencia a lo largo de la falx cerebri, el ala esfenoidal o sobre la convexidad [3].
Histología y clasificación de la OMS 2016
Los meningiomas se clasifican según la clasificación de tumores cerebrales de la OMS en grados I (benignos), II (atípicos) y III (meningiomas anaplásicos, que pueden hacer metástasis sistémicas y presentan altas tasas de recidiva tras la resección) [4].
El diagnóstico de un meningioma suele realizarse histológicamente en secciones teñidas con hematoxilina y eosina sobre la base de criterios típicos como la formación de verticilos, las pseudoinclusiones nucleares o la evidencia de cuerpos de psammoma (calcificaciones en capas concéntricas) [4,5]. El diagnóstico histológico puede confirmarse con inmunohistoquímica, por ejemplo para los marcadores antígeno de membrana epitelial (EMA) o receptor de somatostatina 2a.
Desde la nueva clasificación de la OMS de 2016, la invasión del tejido cerebral, que no es rara en sí misma, se evalúa ahora como criterio para el grado II de la OMS (meningioma atípico), incluso si no se dan otros criterios de atipia [4]. Esto se basa en las tasas comparables de recurrencia y mortalidad de los meningiomas con invasión del parénquima cerebral y los que presentan signos histológicos de atipia [6]. Además, se aplican estos criterios de atipia (se cumplen al menos tres de los cinco criterios histológicos siguientes):
- Necrosis
- Sheeting (pérdida de la formación del vórtice o del
- histoarquitectura fascicular)
- Nucleolos prominentes
- Alta celularidad
- Células pequeñas [4,6].
Los meningiomas anaplásicos de grado III de la OMS, aproximadamente el 2% de todos los meningiomas, muestran mitosis frecuentes (>20 mitosis en diez campos visuales) e invasión del tejido cerebral, suelen recaer pronto incluso tras la resección total y muy raramente pueden metastatizar fuera del sistema nervioso central [7].
Marcadores moleculares
El diagnóstico molecular también desempeña un papel cada vez más importante en los meningiomas. Por ejemplo, existen pruebas preliminares de que las mutaciones de la transcriptasa inversa telomerasa (TERT) conducen a un crecimiento tumoral más agresivo en los meningiomas, independientemente del grado individual de la OMS [8,9].
La mayoría de los meningiomas tienen sólo una copia del brazo largo del cromosoma 22 (22q) [10]. La neurofibromina 2, un gen localizado en 22q, también suele presentar mutaciones adicionales; éste es también el caso de la neurofibromatosis 2, que se caracteriza, entre otras cosas, por meningiomas múltiples [11]. Ciertas aberraciones cromosómicas, como la pérdida del brazo corto del cromosoma 1 (1p), del brazo largo del cromosoma 10 (10q) o del 14 (14q), se asocian a un mayor riesgo de malignidad y recidiva [12,13]. Se están llevando a cabo intensas investigaciones con el objetivo de integrar los marcadores moleculares, similares a los de otros tumores cerebrales, en la clasificación de la OMS y permitir así diagnósticos más específicos y posiblemente también una terapia más individualizada en el sentido de las llamadas “terapias dirigidas” en el futuro.
Clínica
La clínica depende de la localización y el tamaño de los meningiomas. Los meningiomas supratentoriales pueden presentarse con déficits neurológicos de cualquier tipo o crisis epilépticas. A los pacientes con epilepsia sintomática se les ajusta la medicación antiepiléptica, que puede suspenderse tras la extirpación completa de los meningiomas en el curso de unas semanas postoperatorias tras la normalización de la electroencefalografía. Los meningiomas espinales suelen causar dolor nocturno, que suele ser difuso pero también puede ser radicular ceñido al nivel del tumor. Una paraparesia insidiosa y lentamente progresiva, que inicialmente se manifiesta simplemente como un trastorno de la marcha, no es infrecuente que se reconozca tardíamente porque suele afectar a pacientes de edad avanzada en los que son frecuentes otras formas de trastornos de la marcha. Dado que la clínica suele estar causada por la compresión local más que por la invasión del tumor en sí, el pronóstico de recuperación de los déficits neurológicos es favorable si la cirugía se realiza con prontitud.
Debido al creciente uso de la IRM en la práctica clínica, los meningiomas se descubren cada vez con más frecuencia de forma casual (hasta en un 1% de todas las IRM).
Imágenes
Habitualmente, se utiliza la resonancia magnética con contraste para el diagnóstico y seguimiento de los meningiomas; en caso de contraindicaciones, se emplea la tomografía computarizada con contraste como alternativa [14,15].
La resonancia magnética de perfusión puede utilizarse para diferenciar los meningiomas de otras entidades, ya que los meningiomas suelen presentar un aumento del volumen sanguíneo cerebral relativo (VSCr) y otras lesiones (por ejemplo, las metástasis durales) no [16]. Utilizando ligandos peptídicos como el 90Y-dotatoc o el 68Ga-dotatoc como trazadores para la tomografía por emisión de positrones (PET), la expresión del receptor 2 de la somatostatina puede utilizarse para diferenciar los meningiomas del tejido sano [17,18]. En la espectroscopia de resonancia magnética, los meningiomas muestran un pico característico de alanina entre 1,3 y 1,5 ppm (“partes por millón”) [19].
Gestión y terapia
Hoy en día, los meningiomas se descubren a menudo por casualidad: una resonancia magnética para aclarar cefaleas rara vez revela una causa de dolor, pero no es infrecuente que sea un hallazgo incidental. Existen pocas pruebas y relativamente débiles en la literatura sobre el tratamiento posterior de dichas lesiones asintomáticas con un seguimiento clínico y por imagen a intervalos primero semestrales y luego anuales [14,20–22]. Si la terapia se hace necesaria debido a los síntomas clínicos o al crecimiento documentado por imagen, la resección microneuroquirúrgica es prácticamente siempre la terapia de primera elección [14]. El objetivo de la cirugía debe ser -siempre que sea posible- una resección completa del tumor, incluyendo la duramadre y el hueso afectados. La extensión de la resección de los meningiomas y, en consecuencia, su riesgo de recidiva se siguen clasificando según la clasificación de Simpson de 1957 [23] (Tab. 1) [22,24].
La embolización preoperatoria de los meningiomas puede simplificar la cirugía en casos concretos, por ejemplo, si el riego sanguíneo del tumor no puede controlarse bien por medios quirúrgicos o, por razones anatómicas, sólo al final de la resección. Los meningiomas de grado III de la OMS, es decir, anaplásicos, deben intervenirse quirúrgicamente de la forma más radical posible para reducir al máximo el riesgo de recidiva y metástasis [14].
La radiocirugía (radiación convergente estereotáctica de dosis única) puede utilizarse para tumores pequeños, para los que no pueden operarse o sólo pueden operarse de forma incompleta, para la localización en la zona del seno cavernoso o la punta del hueso temporal, o para pacientes de edad avanzada y alta comorbilidad. En determinados casos, por ejemplo en el caso de tumores de mayor tamaño en la zona del vértice petroso o el seno cavernoso, la dosis de radiación también puede aplicarse como radioterapia fraccionada dividida en varias dosis. En los meningiomas de grado II de la OMS, el ensayo ROAM/EORTC 1308 (ISRCTN71502099) está reclutando actualmente pacientes con resecciones tumorales de grado I-III de Simpson para asignarlos aleatoriamente a radioterapia postoperatoria precoz o a terapia placebo con el fin de investigar si la radioterapia puede reducir el riesgo de recidiva tumoral o prolongar el periodo libre de recidiva [25]. Actualmente se recomienda la radioterapia fraccionada adyuvante para los meningiomas de grado II de la OMS resecados de forma incompleta o para los tumores de grado II de la OMS con progresión [26–28], aunque los estudios individuales han mostrado resultados poco claros o ningún beneficio convincente [29–32]. Del mismo modo, se recomienda la radioterapia fraccionada postoperatoria para los meningiomas de grado III de la OMS, independientemente de la extensión de la resección [14].
La farmacoterapia desempeña un papel totalmente secundario en el tratamiento de los meningiomas. Esto podría cambiar en el futuro gracias al descubrimiento de objetivos potenciales para “terapias dirigidas”.
Operación
Un meningioma se extirpa mediante una técnica microquirúrgica. Si la localización es cercana a estructuras elocuentes como el tronco encefálico o la médula espinal, la cirugía se realiza con monitorización neurofisiológica intraoperatoria, especialmente potenciales evocados motores.
En el caso de los tumores intracraneales, la tecnología de neuronavegación se utiliza para la planificación quirúrgica con el fin de lograr un abordaje lo más centrado posible en el tumor. Esta debe ser lo más pequeña y suave posible, pero lo suficientemente grande como para poder ver suficientemente los bordes del tumor. La localización de la altura de la columna vertebral se realiza simplemente con rayos X o fluoroscopia. Tras la laminotomía o hemilaminectomía y antes de la apertura de la duramadre, se comprueba la correcta exposición con ultrasonidos. Para acceder, se reinsertan las láminas de los cuerpos vertebrales afectados y se vuelven a fijar con miniplacas de titanio (laminotomía/laminoplastia). Los enfoques mínimamente invasivos, como las hemilaminectomías, que sólo requieren una exposición unilateral y permiten una curación más rápida y menos dolorosa, se utilizan cada vez con más frecuencia.
Una vez realizada la craneotomía, los meningiomas se extirpan lo más completamente posible, preferiblemente en una sola pieza y con su punto de unión a la duramadre. También se extirpa el hueso afectado si es técnicamente posible. La duramadre se reconstruye con materiales propios del paciente (periostio del cráneo) o ajenos (parches de sustitución de la duramadre fabricados con materiales sintéticos o xenogénicos). Una resección de este tipo con extirpación completa del tumor, incluida la escisión de la inserción dural y la escisión del hueso afectado, se clasifica según el grado I de Simpson (tab. 1) . En los casos en que esto no es técnicamente posible, por ejemplo cerca de la base del cráneo, se realiza una resección menos destructiva (grado II-III de Simpson). Las biopsias (Simpson V) para meningiomas son una excepción extremadamente rara.

En el postoperatorio, los pacientes son monitorizados en la unidad de cuidados intensivos durante una noche como norma. En el primer día postoperatorio, también se toma una resonancia magnética como norma para documentar el tumor residual y cualquier complicación (isquemia, hemorragia, hidrocefalia). En las operaciones de meningioma casi nunca se produce una cantidad inesperada de tumor residual, que podría conducir a una reoperación temprana. La estancia media en el hospital es de cuatro a cinco días en los casos no complicados y la convalecencia es de unas seis semanas.
Cuidado posterior
El seguimiento postoperatorio se realiza mediante exámenes seriados de RM. Para los meningiomas de grado I de la OMS, se recomienda un intervalo anual durante los primeros cinco años y, a partir de entonces, un intervalo bienal de seguimiento clínico y por imagen [14]. Para los meningiomas de grado II de la OMS, se recomienda un intervalo de control más corto, de seis meses [33], y para los meningiomas de grado III de la OMS, se recomienda incluso un intervalo de control de tres a seis meses [14].
Previsión
La tasa de supervivencia a 5 años de todos los meningiomas combinados es de aproximadamente el 90% y depende principalmente de la tasa de recidiva (grado I de la OMS: 10%/grado II de la OMS: 30%/grado III de la OMS: 50%) [34].
La extensión de la resección de los tumores según la gradación de Simpson (Tab. 1) estárelacionada con el pronóstico especialmente en el caso de los meningiomas de convexidad, la gradación parece ser menos relevante para los meningiomas de falx o de la base del cráneo [35]. Parece existir una correlación global más con la supervivencia libre de recidiva y menos con la supervivencia global [36].
Mensajes para llevarse a casa
- Hasta nuevo aviso, la terapia quirúrgica es la primera y más importante forma de terapia, seguida de la radioterapia.
- La radioterapia se utiliza para los tumores de mayor grado, los que presentan restos no extirpables o para determinados meningiomas de la base del cráneo.
- Los meningiomas con invasión cerebral se clasifican como tumores de grado II según la nueva clasificación de la OMS de 2016.
Literatura:
- Ostrom QT, et al: Informe estadístico CBTRUS: Tumores cerebrales primarios y del sistema nervioso central diagnosticados en Estados Unidos en 2008-2012. Neuro Oncol 2015; 17(Suppl 4): iv1-iv62.
- Sheehy JP, Crockard HA: Meningiomas múltiples: una revisión a largo plazo. J Neurosurg 1983; 59(1): 1-5.
- Yamashita J, et al: Recurrencia de meningiomas intracraneales, con especial referencia a la radioterapia. Surg Neurol 1980; 14(1): 33-40.
- Louis DN, et al: Clasificación de los tumores del sistema nervioso central de la Organización Mundial de la Salud de 2016: resumen. Acta Neuropathol 2016; 131(6): 803-820.
- Nowosielski M, et al: Retos diagnósticos en el meningioma. Neuro Oncol 2017. DOI: 10.1093/neuonc/nox101 [Epub ahead of print].
- Perry A, et al: Graduación de meningiomas: un análisis de los parámetros histológicos. Am J Surg Pathol 1997; 21(12): 1455-1465.
- Thomas HG, Dolman CL, Berry K: Meningioma maligno: características clínicas y patológicas. J Neurosurg 1981; 55(6): 929-934.
- Sahm F, et al: Las mutaciones AKT1E17K se agrupan con meningiomas meningoteliales y transicionales y pueden detectarse mediante inmunohistoquímica SFRP1. Acta Neuropathol 2013; 126(5): 757-762.
- Goutagny S, et al.: Alta incidencia de mutaciones activadoras del promotor TERT en meningiomas en progresión maligna. Patología cerebral 2014; 24(2): 184-189.
- Dumanski JP, et al: Cartografía de deleción de un locus del cromosoma 22 humano implicado en la oncogénesis del meningioma. Proc Natl Acad Sci U S A 1987; 84(24): 9275-9279.
- Rouleau GA, et al: La alteración en un nuevo gen que codifica una proteína putativa organizadora de membranas causa la neurofibromatosis tipo 2. Nature 1993; 363(6429): 515-521.
- Tabernero MD, et al: Caracterización de las anomalías del cromosoma 14 mediante hibridación in situ interfásica e hibridación genómica comparativa en 124 meningiomas: correlación con características clínicas, histopatológicas y pronósticas. Am J Clin Pathol 2005; 123(5): 744-751.
- Maillo A, et al.: Las recidivas tempranas en meningiomas histológicamente benignos/de grado I se asocian a tumores de gran tamaño y a la coexistencia de monosomía 14 y del(1p36) en el clon celular tumoral ancestral. Neuro Oncol 2007; 9(4): 438-446.
- Goldbrunner R, et al: Directrices de la EANO para el diagnóstico y tratamiento de los meningiomas. Lancet Oncol 2016; 17(9): e383-391.
- Saloner D, et al: Técnicas modernas de obtención de imágenes de meningiomas. J Neurooncol 2010; 99(3): 333-340.
- Kremer S, et al: Contribución de la RM de contraste dinámico a la diferenciación entre metástasis dural y meningioma. Neurorradiología 2004; 46(8): 642-648.
- Collamati F, et al: Hacia la cirugía radioguiada con β-decaptores: captación de un análogo de la somatostatina, DOTATOC, en meningioma y glioma de alto grado. J Nucl Med 2015; 56(1): 3-8.
- Rachinger W, et al: El aumento de la captación de 68Ga-DOTATATO en las imágenes PET discrimina el meningioma y el tejido libre de tumor. J Nucl Med 2015; 56(3): 347-353.
- Majós C, et al: Meningiomas intraventriculares: hallazgos espectroscópicos de RM y RM en dos casos. AJNR Am J Neuroradiol 1999; 20(5): 882-885.
- Vernooij MW, et al: Hallazgos incidentales en la resonancia magnética cerebral en la población general. N Engl J Med 2007; 357(18): 1821-1828.
- Sughrue ME, et al: Toma de decisiones de tratamiento basada en la historia natural publicada y la tasa de crecimiento de los meningiomas pequeños. J Neurosurg 2010; 113(5): 1036-1042.
- Sughrue ME, et al: La relevancia de la resección de grado I y II de Simpson en el tratamiento neuroquirúrgico moderno de los meningiomas de grado I de la Organización Mundial de la Salud. J Neurosurg 2010; 113(5): 1029-1035.
- Simpson D: La recidiva de los meningiomas intracraneales tras el tratamiento quirúrgico. J Neurol Neurosurg Psychiatry 1957; 20(1): 22-39.
- Gousias K, Schramm J, Simon M: La clasificación de Simpson revisitada: la cirugía agresiva y su lugar en el tratamiento moderno del meningioma. J Neurosurg 2016; 125(3): 551-560.
- Jenkinson MD, et al: The ROAM/EORTC-1308 trial: Radiation versus Observation following surgical resection of Atypical Meningioma: study protocol for a randomised controlled trial. Ensayos 2015; 16: 519.
- Aghi MK, et al: Tasas de recurrencia a largo plazo de meningiomas atípicos tras resección total macroscópica con o sin radiación adyuvante postoperatoria. Neurocirugía 2009; 64(1): 56-60; discusión 60.
- Komotar RJ, et al: El papel de la radioterapia tras la resección macroscópica-total de los meningiomas atípicos. Neurocirugía 2012; 117(4): 679-686.
- Park HJ, et al: El papel de la radioterapia adyuvante en el meningioma atípico. J Neurooncol 2013; 115(2): 241-247.
- Hammouche S, et al.: Análisis de la supervivencia a largo plazo de los meningiomas atípicos: tasas de supervivencia, factores pronósticos y tratamiento quirúrgico y radioterápico. Acta Neurochir (Viena) 2014; 156(8): 1475-1481.
- Mair R, et al: Radioterapia para meningiomas atípicos. J Neurosurg 2011; 115(4): 811-819.
- Stessin AM, et al.: ¿Mejora la radioterapia adyuvante de haz externo los resultados de los meningiomas no benignos? Un análisis basado en la Vigilancia, Epidemiología y Resultados Finales (SEER). J Neurosurg 2012; 117(4): 669-675.
- Yoon H, et al.: Meningioma atípico: se necesitan ensayos aleatorizados para resolver los resultados retrospectivos contradictorios sobre el papel de la radioterapia adyuvante. J Cancer Res Ther 2015; 11(1): 59-66.
- Marosi C, et al: Meningioma. Crit Rev Oncol Hematol 2008; 67(2): 153-171.
- Mahaley MS, et al: Encuesta nacional sobre patrones de atención a pacientes con tumores cerebrales. J Neurosurg 1989; 71(6): 826-836.
- Voss KM, et al: La clasificación de Simpson en la cirugía del meningioma: ¿influye la localización del tumor en el valor pronóstico? J Neurooncol 2017; 133(3): 641-651.
- Nanda A, et al: Relevancia del sistema de clasificación de Simpson y supervivencia sin recidiva tras la cirugía del meningioma de grado I de la Organización Mundial de la Salud. J Neurosurg 2017; 126(1): 201-211.
InFo ONCOLOGÍA Y HEMATOLOGÍA 2017; 5(6): 11-15