Tanto para los tumores de células germinales como para los epiteliales de ovario, la primera línea de tratamiento es la cirugía y la quimioterapia. Sin embargo, muchas cosas han cambiado en los últimos años, especialmente en el cáncer de ovario. Así pues, existe una base de datos cada vez mayor sobre la terapia de mantenimiento con bevacizumab y/o inhibidores de PARP.
Mientras que los enfoques oncológicos dirigidos aún no han podido establecerse en los tumores de células germinales del ovario, ahora están establecidos en la práctica diaria con los inhibidores PARP en la terapia de mantenimiento de los tumores ováricos epiteliales y han sido aprobados por las autoridades. No obstante, algunas cuestiones siguen sin respuesta, como la combinación y la secuencia ideales de los principios activos. También faltan comparaciones directas entre las distintas sustancias. Y no son sólo los agentes recién introducidos los que no están claros, sino también las terapias estándar de primera línea para los tumores de ovario. ¿Debería posponerse la operación a una fecha posterior para aumentar las posibilidades de una resección R0? ¿Y cómo podría mejorarse la atención a los pacientes con tumores de células germinales en vista del escaso número de casos?
Tumores de células germinales: ¿aprender de los hombres?
Aunque los tumores de células germinales del ovario tienen un buen pronóstico tras una intervención quirúrgica satisfactoria, es necesario mejorar los estudios sobre la terapia óptima. Por ejemplo, hay pocos datos sobre el valor de la radioterapia y no es seguro que la quimioterapia sea realmente necesaria en todos los casos en la medida en que se lleva a cabo hoy en día. El panorama de estudio también está escasamente poblado en el entorno recurrente, a pesar del pronóstico extremadamente malo y, por tanto, de la elevadanecesidad médica . Mientras que en los hombres se publican una y otra vez hallazgos apasionantes sobre el tratamiento del seminoma y el no seminoma, éstos son poco frecuentes en los tumores de células germinales femeninos. Por ello, una de las estrategias consiste en transferir los resultados de los estudios de cohortes masculinas o mixtas a pacientes femeninas. Esto se debe a que los tumores de células germinales se dan con mucha más frecuencia en los hombres, con una incidencia de 6/100.000 al año, que en las mujeres, con una incidencia de 0,2/100.000/año. Por un lado, este enfoque es una oportunidad, pero también alberga peligros, advirtió la Prof. Viola Heinzelmann, Jefa del Centro de Tumores Ginecológicos y Médico Jefe de Ginecología/Oncología Ginecológica del Hospital Universitario de Basilea, en el Congreso de las Sociedades Alemana, Austriaca y Suiza de Hematología y Oncología Médica celebrado este año en Berlín. En muchos aspectos -como los biomarcadores disponibles, la edad de aparición y las estrategias de tratamiento- los tumores de células germinales masculinos y femeninos son realmente similares. No obstante, existen diferencias relevantes como el aumento de la incidencia en el sexo masculino y la estadificación.
Actualmente, la terapia de primera línea -en gran parte extrapolada de los datos de estudios de tumores de células germinales masculinos- consiste en particular en cirugía (laparotomía o mínimamente invasiva) y quimioterapia. Debe evitarse la ruptura para impedir que el tumor se extienda. La cirugía de preservación de la fertilidad puede realizarse en la mayoría de los casos, pero la histerectomía y la anexectomía se recomiendan una vez finalizada la planificación familiar [1]. Los pacientes con disgerminoma o teratoma en estadio IA inmaduro sólo requieren observación postoperatoria, mientras que todos los demás pacientes deben recibir quimioterapia en los diez días siguientes a la intervención [1]. Esto tiene efectos duraderos sobre la fertilidad y puede ser innecesario en el estadio IA para todos los tumores de células germinales, pero en este caso se carece de datos fiables.
Las recidivas también deben extirparse quirúrgicamente siempre que sea posible. Para el tratamiento de segunda línea se utilizan, en particular, vinblastina/ifosfamida/cisplatino (VeIP) o paclitaxel/ifosfamida/cisplatino. Sin embargo, también existen enfoques curativos basados en el carboplatino con buenos resultados [2]. Otras opciones experimentales incluyen la quimioterapia a dosis altas con trasplante autólogo de células madre, BEP acelerado o estándar (bleomicina/etopósido/platino), carboplatino/paclitaxel y vigilancia activa [3]. Existe un estudio de fase II publicado en 2021 sobre el uso de inmunoterapia con inhibidores de puntos de control, en el que no se observó ningún beneficio con la administración de pembrolizumab [4]. Debido a la elevada inestabilidad genómica, las terapias dirigidas para los tumores de células germinales no son más bien una opción, según el Prof. Heinzelmann. Más prometedor es un ensayo aleatorio multicéntrico en curso que compara paclitaxel/carboplatino con bleomicina/etopósido/cisplatino en el contexto de la recidiva. Los resultados de este estudio se esperan para 2024.
En el congreso de este año de la Sociedad Europea de Oncología Médica (ESMO) se presentaron dos innovaciones interesantes, al menos para los tumores de células germinales masculinos. Así pues, en el seminoma en estadio IIA/B, parece justificada una reducción de la intensidad de la terapia a un único ciclo de carboplatino y radioterapia [5]. El cabazitaxel también podría proporcionar un beneficio de supervivencia en tumores avanzados de células germinales tras dos o tres líneas previas de tratamiento [6]. Aún debe investigarse si los resultados de estos estudios son también aplicables a las pacientes femeninas. La radiación no forma parte de la terapia estándar para las mujeres, por un lado por razones de preservación de la fertilidad y por otro debido a las condiciones anatómicas. Los ensayos aleatorios aún no han investigado esta opción en las mujeres. Para hacer frente a la insuficiente base de datos sobre el tratamiento de los tumores de células germinales femeninos, las dos redes ENGOT (Red europea de grupos de ensayos oncológicos ginecológicos) y GCIS (Intergrupo Internacional de Cáncer Ginecológico Cáncer de ovario) que son coordinar e iniciar estudios importantes para aportar por fin claridad en el caso de los disgerminomas, teratomas y similares en las mujeres.
Centrarse en la terapia de primera línea del cáncer de ovario
Además de los tumores de células germinales, la reunión anual de la DGHO, la OeGHO, la SSMO y la SGH/SSH también se ocupó del mucho más frecuente carcinoma de ovario. En particular, la atención se centró en si debía administrarse quimioterapia neoadyuvante antes de la cirugía. Y también se habló de la terapia de mantenimiento con bevacizumab y/o inhibidor de PARP. Además de la cirugía y la quimioterapia adyuvante, esto ya forma parte del tratamiento estándar en primera línea a partir del estadio III [7]. Aunque ya se han demostrado los beneficios correspondientes en términos de supervivencia sin progresión (SLP) en los distintos ensayos pivotales, aún no existen datos publicados sobre la supervivencia global con el nuevo tratamiento de mantenimiento recomendado.
En principio, la resección macroscópicamente completa se considera extremadamente importante en términos de pronóstico [8]. Esto se consigue en aproximadamente el 60% de los casos, con una mayor tasa de resecciones R0 tras la quimioterapia neoadyuvante. Por lo tanto, es una consideración obvia realizar la cirugía sólo después de haber completado la quimioterapia primaria. Sin embargo, este enfoque no parece mejorar el resultado [9,10]. Según los datos actuales, la liberación del tumor tras la cirugía primaria es, por tanto, superior a la de la cirugía de intervalo. Esto también se refleja en las directrices, que no contemplan la quimioterapia neoadyuvante [7]. Sin embargo, la secuencia de tratamiento sólo se ha investigado hasta ahora en tumores avanzados, a menudo principalmente inoperables. Por lo tanto, la cuestión de la quimioterapia neoadyuvante sigue sin respuesta en la actualidad para aquellas pacientes que se consideran operables en primera instancia. Por este motivo, se puso en marcha el estudioTRUST (Trial on Radical Upfront Surgical Therapy), que incluye a pacientes en estadios IIIB, IIIC y IV evaluados como libres de tumor. La evaluación de los datos está en pleno apogeo y debería aclarar finalmente si, después de todo, la cirugía de intervalo podría ser superior al tratamiento estándar en determinados casos. Un factor que no debe descuidarse aquí es la morbilidad y la mortalidad asociadas a la cirugía. Según la profesora Barbara Schmalfeldt, jefa del Centro de Cáncer Ginecológico del Centro Médico Universitario de Hamburgo-Eppendorf, se debería reconocer mejor a las pacientes con un riesgo elevado de cirugía. Estos pacientes, alrededor del 10%, se beneficiarían más de la quimioterapia primaria seguida de una reevaluación de la cirugía [11–13]. Sin embargo, identificar a estos pacientes frágiles es todo un reto. En el congreso se presentó como enfoque el llamado método de las “4 A”, según el cual la edad, la albúmina, el estadio de la enfermedad (enfermedad avanzada) y el estado general se tienen en cuenta en la decisión sobre el tratamiento.
A pesar de los datos convincentes a favor de la terapia de mantenimiento en primera línea, la cirugía y, si es posible, la resección completa siguen siendo de gran importancia, algo en lo que también hizo hincapié el Prof. Schmalfeldt. Así pues, la SLP depende en gran medida del remanente tumoral, incluso bajo terapia de mantenimiento [14].
El papel de los inhibidores de PARP en el cáncer de ovario seroso de alto grado
Las innovaciones más revolucionarias de los últimos años en el tratamiento del cáncer de ovario se refieren a la terapia de mantenimiento de primera línea. Tras la introducción del inhibidor del VEGF bevacizumab en esta indicación, se añadieron también los inhibidores del PARP niraparib y olaparib en presencia de una mutación BRCA u otra deficiencia de recombinación homóloga (HRD). El requisito previo para la terapia de mantenimiento con bevacizumab y/o inhibidor de PARP es una respuesta a la quimioterapia de primera línea [15]. El beneficio de la inhibición del VEGF -en la que el bevacizumab se inicia simultáneamente con la quimioterapia y se continúa tras el final de ésta- se confirmó en la Reunión Anual de la ASCO de este año. En cambio, prolongar el tratamiento de 15 a 30 meses no aportó ningún beneficio adicional [16]. El uso de los inhibidores de PARP olaparib y niraparib en la terapia de mantenimiento de primera línea también conlleva un beneficio comprobado en la SLP en tumores HRD positivos en comparación con el placebo, así como con la monoterapia con bevacizumab [17]. Esto ya ha dado lugar a las aprobaciones de Swissmedic y a las correspondientes modificaciones de las directrices [7,15].
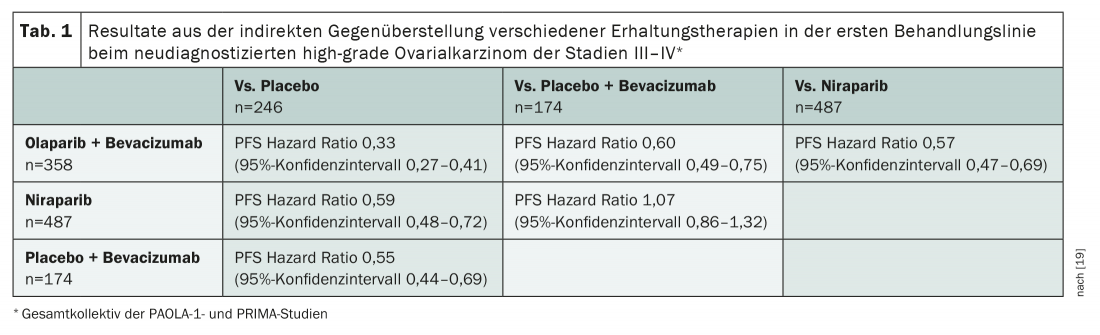
Aunque el beneficio de los inhibidores de PARP en el cáncer de ovario de alto grado HRD-positivo ya apenas suscita controversia, aún quedan algunas preguntas por responder sobre su uso. Hasta ahora, no existen comparaciones directas entre las sustancias activas individuales. Además, la terapia combinada con bevacizumab es siempre objeto de controversia. Para ello existen dos comparaciones indirectas ajustadas a la población sobre la base de los estudios de registro [18,19]. Son metodológicamente cuestionables – y extremadamente interesantes. Por un lado, aportan pruebas de que la administración simultánea de un inhibidor de PARP con bevacizumab tiene ventajas sobre la monoterapia con inhibidor de PARP en términos de SLP. Esta opción también parece funcionar mejor en comparación con la administración de bevacizumab solo (tab. 1) . Por lo tanto, si no existe contraindicación para el bevacizumab, debe utilizarse esta sustancia, en los casos positivos para el DRH complementada con un inhibidor de PARP. Si existen contraindicaciones para el bevacizumab, puede iniciarse una terapia de mantenimiento con inhibición de PARP sola tras la quimioterapia en pacientes con DRH positivo. Los inhibidores de PARP -en este caso olaparib, niraparib y rucaparib- también están aprobados para el cáncer de ovario recurrente sensible al platino, independientemente del estado de la mutación.
Con el aumento del uso de agentes dirigidos, la cuestión de la estrategia óptima de pruebas es cada vez más importante. Una cosa está clara: las pruebas genéticas deben ofrecerse en cualquier caso [7]. Mientras que algunos centros realizan primero el diagnóstico del tumor y después el de la línea germinal, otros prefieren el enfoque opuesto. Falta una norma establecida.
Fuente: Simposio científico “Actualización de los tumores de ovario” presidido por Sigrun Greil-Ressler y Hans Tesch, 04.10.2021, Reunión anual de las sociedades alemana, austriaca y suiza de hematología y oncología médica, Berlín (D).
Literatura:
- Brown J, et al: Revisión de consenso del Intergrupo de Cáncer Ginecológico (GCIG) para los tumores de células germinales del ovario. Int J Gynecol Cancer. 2014; 24(9 Suppl 3): S48-54.
- De Giorgi U, et al.: Quimioterapia de rescate a dosis altas en pacientes femeninas con tumores germinales recidivantes/refractarios: un análisis retrospectivo del Grupo Europeo de Trasplante de Sangre y Médula Ósea (EBMT). Ann Oncol. 2017; 28(8): 1910-1916.
- Uccello M, et al.: Tratamiento anticanceroso sistémico en tumores malignos de células germinales de ovario (MOGCT): gestión actual y enfoques prometedores. Ann Transl Med. 2020; 8(24): 1713.
- Tsimberidou AM, et al: Pembrolizumab en pacientes con tumores de células germinales metastásicos avanzados. Oncólogo. 2021; 26(7): 558-e1098.
- Papachristofilou A, et al: Dosis única de carboplatino seguida de radioterapia de ganglios implicados como tratamiento curativo para el seminoma en estadio IIA/B: Resultados de eficacia del ensayo internacional multicéntrico de fase II SAKK 01/10. Congreso ESMO 2021, Sesión de comunicaciones conferidas – Tumores genitourinarios, no prostáticos 2, Resumen #LBA30.
- Baciarello G, et al.: Un ensayo prospectivo de fase II de cabazitaxel en pacientes varones con tumores metastásicos de células germinales pretratados con quimioterapia: el estudio CABA-GCT. Congreso ESMO 2021, Mini sesión oral – Tumores genitourinarios, no prostáticos, Resumen #655MO.
- AWMF S3-Leitlinie: Diagnostik, Therapie und Nachsorge maligner Ovarialtumoren, Version 5.0, September 2021.
- du Bois A, et al: Papel del resultado quirúrgico como factor pronóstico en el cáncer de ovario epitelial avanzado: un análisis exploratorio combinado de 3 ensayos multicéntricos de fase 3 prospectivamente aleatorizados: por el Arbeitsgemeinschaft Gynaekologische Onkologie Studiengruppe Ovarialkarzinom (AGO-OVAR) y el Groupe d’Investigateurs Nationaux Pour les Etudes des Cancers de l’Ovaire (GINECO). Cancer. 2009; 115(6): 1234-1244.
- Vergote I, et al: Quimioterapia neoadyuvante o cirugía primaria en el cáncer de ovario en estadio IIIC o IV. N Engl J Med. 2010; 363(10): 943-953.
- Kehoe S, et al: Quimioterapia primaria frente a cirugía primaria para el cáncer de ovario avanzado de diagnóstico reciente (CHORUS): un ensayo abierto, aleatorizado, controlado y de no inferioridad. Lancet. 2015; 386(9990): 249-257.
- Vergote I, et al: Quimioterapia neoadyuvante en el cáncer de ovario avanzado: ¿en qué estamos de acuerdo y en qué no? Gynecol Oncol. 2013; 128(1): 6-11.
- Aletti GD, et al: Enfoque multidisciplinar en el tratamiento de pacientes con cáncer de ovario avanzado: un enfoque personalizado. Resultados de una unidad especializada en cáncer de ovario. Gynecol Oncol. 2017; 144(3): 468-473.
- Ataseven B, et al.: La albúmina sérica preoperatoria se asocia con la tasa de complicaciones postoperatorias y la supervivencia global en pacientes con cáncer de ovario epitelial sometidas a cirugía citorreductora. Gynecol Oncol. 2015; 138(3): 560-565.
- Harter P, et al: Eficacia del olaparib de mantenimiento más bevacizumab según el estado de los biomarcadores en pacientes de alto y bajo riesgo clínico con cáncer de ovario avanzado recién diagnosticado en el ensayo PAOLA-1. Revista Internacional de Cáncer Ginecológico. 2020; 30: A13-A4.
- Swissmedic drug information: www.swissmedicinfo.ch (última consulta: 28.10.2021).
- Pfisterer J, et al.: Duración óptima del tratamiento con bevacizumab (BEV) combinado con carboplatino y paclitaxel en pacientes (pts) con cáncer epitelial primario de ovario (EOC), de trompas de Falopio (FTC) o peritoneal (PPC): Un ensayo multicéntrico aleatorizado abierto de 2 brazos de fase 3 ENGOT/GCIG del Grupo de Estudio AGO, GINECO y NSGO (AGO-OVAR 17/BOOST, GINECO OV118, ENGOT Ov-15, NCT01462890). Reunión anual de la ASCO 2021, Sesión de resúmenes orales Cáncer ginecológico, resumen nº 5501.
- Ray-Coquard I, et al: Olaparib más bevacizumab como mantenimiento de primera línea en el cáncer de ovario. N Engl J Med. 2019; 381(25): 2416-2428.
- Vergote I, et al: Comparación indirecta ajustada a la población de los estudios SOLO1 y PAOLA-1/ENGOT-ov25 de olaparib con o sin bevacizumab, bev solo y placebo en el tratamiento de mantenimiento de mujeres con cáncer de ovario en estadio III/IV recién diagnosticado con mutación BRCA. Reunión anual de la SGO 2020, resumen nº 35.
- Hettle R, et al: Comparación indirecta del tratamiento ajustada a la población (PAITC) del inhibidor de PARP de mantenimiento (PARPi) con o sin bevacizumab frente a bevacizumab en mujeres con cáncer de ovario (CO) de diagnóstico reciente. Reunión anual de la ASCO 2020, Sesión de pósteres Cáncer ginecológico, Resumen nº 6052.
InFo ONCOLOGY & HEMATOLOGY 2021; 9(6): 19-22 (publicado el 7.12.21, antes de impresión).