Además de las enfermedades infecciosas, los problemas cutáneos son uno de los motivos de consulta más frecuentes en las consultas de pediatría y medicina general, y los dermatólogos también se enfrentan regularmente a pacientes pediátricos. ¿Qué signos cutáneos deben alertarnos? ¿La mancha es realmente inofensiva o forma parte de un síndrome con problemas internos asociados? ¿Cuántos diagnósticos son necesarios? Este artículo pretende agudizar la vista en busca de manifestaciones cutáneas importantes de enfermedades sistémicas en la infancia sobre la base de algunos síntomas principales clásicos y señalar pasos diagnósticos sensatos.
“Manos en el cubo-signo
La adolescente de la figura 1 presentaba pápulas transitorias de color blanquecino a translúcido con arrugas excesivas en la zona de la palma de la mano tras un breve contacto con el agua o la sudoración, acompañadas de ardor y picor desagradables.

Este fenómeno, resumido bajo el término “arrugamiento aquagénico de las palmas” (AWP), puede ser un signo cutáneo específico de la fibrosis quística (FQ) (prevalencia del 41-84%) o de un estado de portador heterocigoto del gen de la FQ [1]. Mientras que la arruga palmar sólo se produce tras un tiempo de contacto con el agua de 11,5 minutos en individuos sanos, este fenómeno ya puede observarse tras dos minutos en pacientes con FQ y tras siete minutos en portadores heterocigotos de FQ [1]. La PPA puede ser el primer síntoma de un fenotipo leve de FQ en individuos de apariencia por lo demás sana [2]. Sin embargo, también puede observarse de forma idiopática y transitoria, especialmente en adolescentes.
No se sabe cuántos de los afectados por la PEA tienen realmente una mutación del gen de la fibrosis quística.
“Ojos de mapache”

Las lesiones cutáneas perioculares, que recuerdan a la visión de un “mapache” con sus características marcas oscuras en forma de gafas (Fig. 2) , nos hacen pensar en una serie de diagnósticos diferenciales graves en la infancia y la niñez:
- Neuroblastoma metastásico (equimosis)
- Lupus eritematoso neonatal (LEN)
- Fractura de la base del cráneo, por ejemplo en maltrato infantil (equimosis)
- Amiloidosis (muy rara en la infancia).
El lactante de tres meses de la figura 3, que nos fue remitido con la descripción de un hemangioma de anteojos, presentaba máculas periorbitarias, eritematosas y ligeramente petequiales desde el nacimiento, que eran principalmente compatibles con el lupus eritematoso neonatal (LEN) de los diagnósticos diferenciales antes mencionados.

La detección de anticuerpos anti-Ro/SSA y anti-La/SSB en la madre y el niño confirmó rápidamente la sospecha diagnóstica. La afectación cardiaca, especialmente el bloqueo AV, que puede producirse en aproximadamente el 10-20% de los niños con NLE, se descartó mediante ecocardiografía y ECG. Sobre todo en 6º-7º grado. Las manifestaciones cutáneas típicas de la NLE aparecen a las dos semanas de vida. Son características las máculas y placas eritematosas anulares, en parte policíclicas, con predilección por la cabeza y especialmente la región periocular, similares al cuadro del lupus eritematoso cutáneo subagudo (LECS). La NLE muestra el curso típico de una enfermedad autoinmune de transmisión pasiva. Con la eliminación de los autoanticuerpos maternos, suele producirse una curación cutánea completa entre los ocho y los doce meses de edad.
A diferencia de los síntomas cutáneos, el bloqueo AV completo fetal/congénito y la fibrosis miocárdica como consecuencia de la miocarditis suelen ser, por desgracia, irreversibles. No es infrecuente que esto requiera un cuidado sostenido del marcapasos. El NLE es responsable del 80% de todos los bloqueos AV congénitos [3]. Dado que el 20% de los hermanos posteriores de un paciente con NLE y el 2% de los bebés de mujeres embarazadas anti-Ro/SSA positivas (¡el 50% de los cuales son asintomáticos!) corren el riesgo de padecer NLE, se recomienda un seguimiento ecocardiográfico fetal semanal entre las semanas 16 y 24 de gestación [3]. Los recién nacidos de este grupo de riesgo o los lactantes con sospecha clínica de lupus neonatal deben ser evaluados por cardiología pediátrica poco después de nacer y ser objeto de seguimiento si se detectan anomalías. La relevancia clínica de la NLE radica, por tanto, en la detección precoz de su afectación cardiaca.
Manchas rojas en la cara
Son frecuentes las manchas rojas en la cara. Aunque muchas lesiones son inofensivas y remiten espontáneamente, es importante reconocer y tratar con prontitud las alteraciones persistentes y, por tanto, estéticamente perjudiciales, así como aquellas con posibles complicaciones funcionales.
¿Más que un hemangioma?
Los hemangiomas infantiles (HI) son los tumores benignos más frecuentes en la infancia y se dan hasta en un 5% de los niños. Se caracterizan por un patrón de crecimiento típico de rápida proliferación en los primeros meses de vida, seguido de una estabilización y una lenta regresión a partir de los dos años. Así pues, aunque la mayoría de los HI no requieren tratamiento, debe prestarse atención al posible deterioro funcional causado por el crecimiento expansivo, especialmente en el caso de los hemangiomas de la región periorbitaria o centrofacial, sobre todo en la cara. Éstas deben evaluarse precozmente, idealmente al inicio de la fase de proliferación (entre uno y dos meses de edad) en centros especializados y tratarse con betabloqueantes sistémicos (propranolol). Además, es importante pensar en los problemas asociados más allá del hemangioma en las siguientes presentaciones.
El hemangioma de la barba: Los hemangiomas en forma de placa en la barbilla y la mandíbula inferior (“región de la barba”) y el yugulum pueden ser signos de advertencia de hemangiomas asociados de las vías respiratorias superiores. Durante un estrecho seguimiento en los tres primeros meses de vida, debe prestarse especial atención a síntomas como la ronquera, los síntomas de crup y el estridor como signos de un hemangioma subglótico. En los casos de sospecha clínica, es de gran importancia la confirmación diagnóstica rápida mediante laringotraqueoscopia directa (¡la resonancia magnética no es la imagen de elección!) y el inicio de la terapia con propranolol y/o terapia láser [5].
Síndrome PHACES: Un hemangioma de tipo placa de más de 5 cm de tamaño en la cabeza o el cuello puede ser indicativo del síndrome PHACES (Tab. 1), que incluye una amplia gama de malformaciones asociadas, especialmente anomalías cardiacas, vasculares y cerebrales.

Las niñas se ven afectadas en el 75% de los casos [7]. En los hemangiomas compatibles (Fig. 4 ), se encuentran al menos una, pero normalmente varias manifestaciones extracutáneas del síndrome PHACES en más del 30% [7]. Además de un examen oftalmológico y una aclaración cardiológica pediátrica, debe realizarse una angiografía por resonancia magnética de la cabeza y el cuello antes de iniciar un tratamiento betabloqueante habitualmente necesario [7].
Mancha de vino de Oporto con consecuencias: Mientras que los hemangiomas clásicos aún no son visibles al nacer o sólo lo son como lesiones precursoras discretas, las malformaciones capilares (MC = tinción de vino de Oporto) ya son visibles como máculas eritematosas homogéneas en el primer día de vida. Con una prevalencia del 0,3%, son significativamente más raras que la HI, crecen proporcionalmente al cuerpo, persisten durante toda la vida y causan principalmente problemas estéticos [8]. Si existe CM en la cara, se recomienda precaución en algunas situaciones, además del deterioro cosmético. Si se ven afectados los párpados (sobre todo los superiores), existe un riesgo importante de glaucoma ipsilateral, que es una urgencia pediátrica. Por lo tanto, es obligatorio un examen oftalmológico en los primeros días de vida, así como revisiones oftalmológicas periódicas en el curso posterior de la vida. Si se incluye la región temporo-frontal (segmento V1), debe considerarse la posibilidad de un síndrome de Sturge-Weber (tríada: CM fronto-temporal segmentario, glaucoma ipsilateral y angiomatosis leptomeníngea) (Fig. 5), que no debe confundirse con el síndrome PHACES.

El síndrome de Sturge-Weber se caracteriza clínicamente por epilepsia infantil temprana difícil de tratar, posible parálisis y deterioro cognitivo. Además de una evaluación oftalmológica rápida, se recomienda la realización de una resonancia magnética del cráneo en la infancia.
Hay que distinguir de las manchas de vino de Oporto en sentido estricto las inofensivas “picaduras de cigüeña” que se dan en el 50% de los recién nacidos y que representan malformaciones capilares funcionales, normalmente de regresión espontánea. Siempre se distribuyen simétricamente, con mayor frecuencia en la línea media de la cara y el cuello. La afectación frecuente de los párpados no se asocia a un riesgo de glaucoma.
Erupción del pañal – ¿trivial?

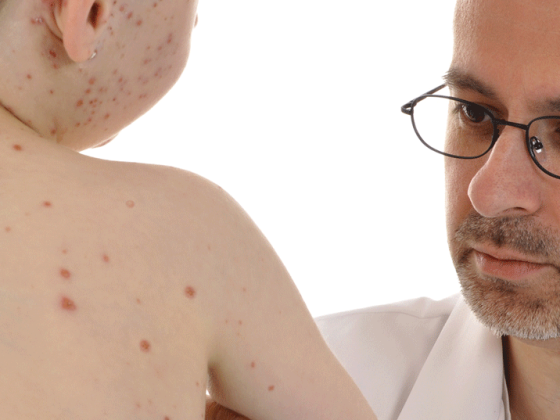
El lactante de la figura 6 llevaba varias semanas padeciendo un exantema papular muy pruriginoso, en parte petequial, en la zona del pañal y pequeñas fisuras en las flexuras, que seguía extendiéndose a pesar de las terapias anteriores. El diagnóstico diferencial de las dermatosis del pañal es amplio (Tab. 2).

Si se presentan pápulas persistentes de color rojo parduzco y no hay respuesta a la terapia antiinflamatoria tópica, debe realizarse una evaluación adicional mediante biopsia. En nuestro bebé, el diagnóstico de histiocitosis de células de Langerhans (HCL) pudo confirmarse histológicamente. Se trata de un diagnóstico diferencial importante en la dermatitis persistente del pañal y el eccema seborreico de los intertriginos en lactantes y niños pequeños. Una pista clínica es el aspecto hemorrágico frecuentemente observado de las eflorescencias y las hemorragias puntuales tras la muda.
La HCL es una afección oncológica (incidencia 0,4:100.000 niños menores de 15 años con un pico de edad en los 3 primeros años) con acumulación clonal y proliferación de células de Langerhans en diversos órganos (esqueleto 80% [Osteolysen], piel 25%, hígado, bazo, médula ósea y ganglios linfáticos) [9]. En los casos de sospecha puramente radiológica de HCL (por ejemplo, osteolisis), merece la pena realizar un examen dermatológico meticuloso, ya que incluso los hallazgos cutáneos mínimos pueden ser la clave para la confirmación histológica. Esto significa que se puede prescindir de una arriesgada biopsia de órganos internos o del esqueleto. La clasificación en HCL monosintomática (HCL-SS) de pronóstico excelente y HCL multisistémica (HCL-MS) de pronóstico muy variable se realiza según un programa de examen estandarizado. La terapia se lleva a cabo en el marco del “protocolo de tratamiento colaborativo internacional LCH-IV para la histiocitosis de células de Langerhans” (www.histiocytesocie ty.org) [9].
Pápulas pruriginosas
La niña de doce años de la figura 7 llevaba seis semanas padeciendo pápulas en el lado extensor con picor intenso en el sentido del prurigo simple subacuta.

No hubo indicaciones anamnésicas para el eczema atópico. Además de una linfadenopatía cervical y axilar, se observó una LDH elevada con unos parámetros de laboratorio por lo demás anodinos. Histológicamente, se pudo confirmar la sospecha clínica y radiológica de enfermedad de Hodgkin. El prurigo simplex subacuta, que se observa con regularidad en adultos (principalmente mujeres) sin una causa interna identificable, es una rareza en los niños. por lo general sólo cabe esperar en asociación con la dermatitis atópica. En la situación aquí descrita, está indicada una aclaración interna sobre una enfermedad subyacente hepática, nefrológica o hematooncológica. La enfermedad de Hodgkin es la representante clásica, representa el 5% de las neoplasias malignas en la infancia y la adolescencia y muy a menudo (20-30%) muestra síntomas cutáneos [11]:
- Prurigo simplex subacuta/eczema
- Eritema nodoso
- Infiltración cutánea específica de la enfermedad de Hodgkin: micosis fungoide, linfomas de células T CD30+.
El prurigo simple acuta (strophulus infantum) debe distinguirse del prurigo simple subacuta como reacción aguda a las picaduras repetidas de insectos en la infancia. El predominio de las seropapulares es típico en este caso.
Manchas blancas y marrones en el lactante y el niño pequeño
Xantogranulomas juveniles y neurofibromatosis: Las múltiples manchas café con leche (número ≥6, tamaño >0,5 cm prepuberal) son un primer signo bien reconocido de neurofibromatosis tipo 1 (NF1) en la infancia y la niñez temprana. Sin embargo, sólo el 54% de los niños con NF1 cumplen los criterios de diagnóstico clínico en el primer año de vida [12]. Los niños que puedan estar afectados deben someterse a cuidadosos controles pediátricos del desarrollo y a un examen oftalmológico inicial en torno a los doce meses de edad. Las imágenes cerebrales están indicadas en caso de alteraciones visuales (glioma óptico) u otras anomalías neurológicas. No se requiere un análisis genético para el diagnóstico, pero puede ser útil en casos poco claros. Si se encuentran simultáneamente múltiples manchas café con leche y uno o más xantogranulomas juveniles (JXG) (Fig. 8), esto representa una constelación de riesgo para la aparición de leucemia mielomonocítica juvenil (LMMJ). La LMMJ, que suele aparecer en la infancia y la niñez, es significativamente más frecuente en los pacientes con NF1 que en los niños sanos. Si el JXG está presente al mismo tiempo, el riesgo se multiplica por 20-30 [13]. Con la ayuda de un estrecho seguimiento y un diagnóstico precoz, puede mejorarse el pronóstico de la LMMJ.
“Manchas blancas”: Al evaluar las manchas blancas, es esencial distinguir las lesiones hipopigmentadas de las despigmentadas y las manchas congénitas de las adquiridas. Las máculas hipopigmentadas únicas y bien definidas en el sentido de un nevus depigmentosus no son infrecuentes en los lactantes, con un 0,8%, y en los niños mayores, con hasta un 5%, pero sólo un 0,5% de todas las personas tienen más de dos manchas de este tipo [14]. Si se encuentran más de tres de estas hipopigmentaciones en forma de hoja de fresno o de confeti (Fig. 9), se trata de un posible primer signo cutáneo de esclerosis tuberosa (ET).

En esta situación en la primera infancia, los controles pediátricos cuidadosos del desarrollo son primordiales. Si se producen anomalías neurológicas, está indicada una rápida evaluación neuropediátrica. Hasta dos tercios de los niños con ET presentan mutaciones espontáneas, por lo que unos antecedentes familiares negativos no son un argumento en contra de este diagnóstico.
“Señal de collar de pelo”
La aplasia cutis congénita es una aplasia congénita de la piel y en la mayoría de las estructuras más profundas. Las causas son múltiples [15]. Si la aplasia cutis está presente cerca de la línea media del cráneo, puede ser una expresión de disrafismo craneal oculto. A menudo, alrededor del pelo aparece una hipertricosis arremolinada muy característica de pelos más oscuros y largos, similar a las isobaras del mapa del tiempo (Fig. 10), denominada “signo del collar capilar”. En esta situación, está indicada la obtención de imágenes mediante ecografía o mejor IRM del cráneo, especialmente antes de la intervención quirúrgica [16].

Púrpura en la infancia
Desde su completo bienestar, el lactante de la figura 11 desarrolló placas purpúricas urticariales, en parte blancoides, en las extremidades y en la cara, compatibles con el edema hemorrágico agudo de la infancia (EHAI), también conocido como púrpura cocarda de Seidlmayer. La gripe aviar altamente patógena suele aparecer repentinamente tras infecciones víricas previas -normalmente entre los cuatro meses y los dos años de edad- y se cura en el plazo de una a tres semanas sin consecuencias duraderas. Llama la atención la aparente contradicción de unas manifestaciones cutáneas flagrantes, un estado general del niño sin alteraciones y, por regla general, la ausencia de otras manifestaciones orgánicas. Si la presentación es típica, el diagnóstico puede hacerse puramente clínico y puede omitirse una biopsia.
¿Representa la AHEI un subgrupo de la púrpura de Schönlein Hennoch (PSH) (Fig. 12)? Esta cuestión sigue siendo controvertida.

A diferencia de la AHEI, el curso de la PSH se caracteriza principalmente por la posible afectación de órganos (especialmente riñones, intestinos y articulaciones). En la PSH, suele haber dolor abdominal tipo cólico, por lo que debe considerarse y excluirse ecográficamente una posible intususcepción o hemorragia intestinal. Incluso sin signos iniciales de nefritis PSH, el seguimiento clínico (medición de la tensión arterial y estado de la orina) está indicado durante al menos tres a seis meses (una o dos veces por semana durante el primer mes, y después una vez al mes) [17]. En caso de estado general disminuido, fiebre alta, signos de inflamación notablemente aumentados y parámetros de coagulación anormales, debe cuestionarse siempre el diagnóstico de PSH o AHEI y excluirse el diagnóstico diferencial de púrpura fulminans (en el contexto de una sepsis meningocócica), que puede poner en peligro la vida.
Conclusión
En resumen, esperamos haber proporcionado a los lectores de este artículo información interesante y práctica para la evaluación de los niños con manifestaciones dermatológicas. Por supuesto, un artículo de este tipo sólo puede cubrir una pequeña selección de los muchos y excitantes signos y síntomas de la piel.
Literatura:
- Pride HB, et al: Journal of the American Academy of Dermatology 2013; 68(6): 885 e881-812; quiz 897-888.
- Weibel L, Spinas R: The New England journal of medicine 2012; 366(21): e32.
- Buyon JP, et al: Nature clinical practice Reumatología 2009; 5(3): 139-148.
- Brown SJ, et al: Lupus eritematoso neonatal. En: Harper J, Oranje A, Prose N (eds.): Textbook of Pediatric Dermatology, 3ª edición, Vol. 1. Oxford: Blackwell Publishing 2011; p. 14.1-14.12.
- Weibel L: VASA Zeitschrift fur Gefässkrankheiten 2011; 40(6): 439-447.
- Theiler M, et al: J Dtsch Dermatol Ges 2013; 11(5): 397-405.
- Metry D, et al: Pediatrics 2009; 124(5): 1447-1456.
- Boon LM: Malformaciones vasculares. En: Harper J, Oranje A, Prose N (eds.): Textbook of Pediatric Dermatology, 3ª edición. Oxford: Blackwell Publishing 2011; 12.11-12.24.
- Minkoff M: Monatschr Kinderheilkd 2012; 160: 958-966.
- Lewis-Jones S: Erupción del pañal. En: Lewis-Jones S (ed.): Paediatric Dermatology, Oxford: Oxford University Press 2010; 192-199.
- Rubenstein M, Duvic M: Revista internacional de dermatología 2006; 45(3): 251-256.
- Boyd KP, et al: J Am Acad Dermatol 2009; 61: 1-14.
- Raygada M, et al:Cáncer de sangre pediátrico 2010; 54: 173-175.
- Vanderhooft SL, et al: J Pediatr 1996; 129(3): 355-361.
- Frieden F: J Am Acad Dermatol 1986; 14(4): 646-660.
- Stevens CA: Am J Med Genet A 2008; 146A(4): 484-487.
- Scheer HS, Weibel L: JAMA 2013; 309(20): 2159-2160.
- Hospach T, Klaus G: Púrpura Schönlein-Henoch. Directriz de la GKJ y la DGKJ, Ene.2013, AWMF Online, www.awmf.org/uploads/tx_szleitlinien/027-064l_S1_Purpura_Schönlein_Henoch_2013-01.pdf
PRÁCTICA DERMATOLÓGICA 2013; 23(5): 4-8