Con la creciente aplicación clínica de las células CAR-T, los aspectos prácticos de la terapia son una cuestión cada vez más importante. ¿Qué pacientes deberían recibir tratamiento con células CAR-T fuera de los ensayos clínicos? ¿Cuál es la forma óptima de tratar los efectos secundarios? ¿Y cómo se puede maximizar la eficacia de la terapia? Estas y otras cuestiones fueron debatidas por expertos en el congreso de este año de la Asociación Europea de Hematología (EHA).
Dos productos de células CAR-T, el axicaptagen ciloleucel y el tisagenlecleucel, están aprobados actualmente en Suiza, y tres se comercializan ya en EE UU. Más recientemente, la Administración de Alimentos y Medicamentos de EE.UU. aprobó el lisocaptagen maraleucel en febrero de 2021. Y se están investigando diligentemente otros productos, los ensayos clínicos están en pleno apogeo. No es de extrañar que cada vez surjan más preguntas sobre la aplicación práctica de las terapias con células CAR-T.
Selección de pacientes: un paseo por la cuerda floja
Las diferentes características de los pacientes y de la enfermedad desempeñan un papel importante en la selección de los candidatos adecuados. La selección es el primer paso crítico para el éxito de la terapia. Es importante excluir a los pacientes con pocas posibilidades de éxito o con un riesgo de toxicidad demasiado elevado. Y sin embargo, la terapia no debe negarse a nadie que pueda beneficiarse potencialmente de ella. En el linfoma difuso de células B grandes (DLBCL), por ejemplo, también hay algunos candidatos entre los pacientes no trasplantables que son adecuados para el tratamiento con células CAR-T en la tercera línea de terapia, a pesar de la edad mayoritariamente avanzada y el mayor número de comorbilidades en este grupo de pacientes. Los datos actuales muestran que los resultados en pacientes mayores de 65 años son comparables a los de pacientes más jóvenes. Aparte de un ligero aumento de la neurotoxicidad, hasta ahora no se han demostrado efectos negativos de una mayor edad de los pacientes.
A diferencia de la edad, el estado funcional parece tener un impacto significativo en las posibilidades de éxito del tratamiento con células CAR-T. Los expertos del Congreso de la EHA coincidieron en ello. Dado que se ha demostrado sistemáticamente que un mal estado funcional es un requisito previo desfavorable para la terapia, las células CAR-T no deben utilizarse en pacientes con un estado ECOG (Eastern Cooperative Oncology Group) ≥3. Para la mayoría de los ensayos clínicos, el requisito previo es un estado ECOG de 0-1. E incluso en el ámbito comercial, existen diferentes directrices en los distintos países.
Aún existe mucha incertidumbre sobre el papel de las comorbilidades en la selección de pacientes. En general, sin embargo, las terapias con células CAR-T se toleran mejor que los trasplantes de células madre y, por tanto, suponen menos exigencias para las funciones orgánicas del corazón, los pulmones y los riñones. Según los conocimientos actuales, las comorbilidades sólo desempeñan un papel menor en el riesgo de efectos secundarios. Al menos las enfermedades secundarias de leves a moderadas no son un problema para una terapia con células CAR-T y no deben evaluarse como criterio de exclusión. Para algunos pacientes que no son aptos para un trasplante debido a sus comorbilidades, las células CAR-T constituyen así una nueva opción potencialmente curativa.
Además de las características de los pacientes -especialmente la puntuación de rendimiento-, que deben tenerse en cuenta en la selección de candidatos adecuados, diversos aspectos de la enfermedad también desempeñan un papel en la selección de pacientes para las terapias con células CAR-T. En particular, se consideran factores desfavorables una elevada actividad proliferativa, un gran volumen tumoral, signos de un entorno tumoral proinflamatorio y la afectación del SNC. (Recuadro). La reducción de la carga tumoral antes del inicio de la terapia con células CAR-T -la denominada terapia puente- es un tema importante a este respecto, sobre el que probablemente podamos esperar más noticias en el futuro.

Efectos secundarios: ¿Acción o reacción?
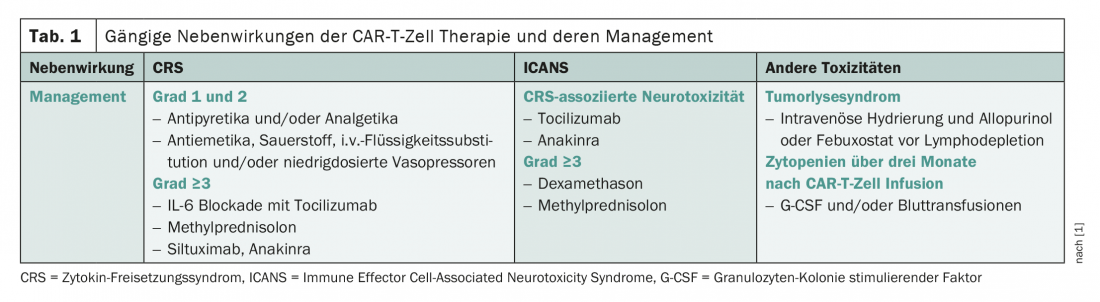
El espectro de efectos secundarios de las células CAR-T se caracteriza por el síndrome de liberación de citoquinas (SRC), una reacción inflamatoria sistémica, y la neurotoxicidad (Tab. 1) [1]. Mientras que la RSC se produce clásicamente en los primeros días de tratamiento, el daño nervioso suele producirse en fases posteriores de la terapia. Las complicaciones que se han estudiado con menos detalle hasta la fecha incluyen el síndrome de lisis tumoral y las citopenias. Estos últimos han sido bastante subestimados hasta ahora, pero a menudo han demostrado ser problemáticos en la práctica clínica diaria. Dependiendo de el producto, el perfil de efectos secundarios es algo diferente.
Además, los pacientes con una mayor carga tumoral suelen tener un mayor riesgo de toxicidad. Los daños nerviosos son más frecuentes en pacientes de edad avanzada. Conocer estos factores de riesgo permite estratificar el riesgo y, por tanto, tomar medidas a tiempo. Consisten, entre otras cosas, en la reserva de plazas en la unidad de cuidados intensivos y la administración profiláctica de tocilizumab o esteroides.
La profilaxis farmacológica de la RSC y la neurotoxicidad no está exenta de controversia. Por ejemplo, algunos estudios muestran que aunque los efectos secundarios pueden mitigarse, el efecto sobre el control de la enfermedad no es insignificante. Así, según Pere Barba, del Hospital Vall d’Hebron de Barcelona, cada caso debe evaluarse individualmente en cuanto a la utilidad de la profilaxis. Por ejemplo, desaconseja la profilaxis con tocilizumab para el lisocaptagen maraleucel debido al bajo riesgo de SIR. En general, las toxicidades se tratan hoy en día de forma cada vez más agresiva. Mientras que en el pasado sólo se solía llevar a cabo un tratamiento específico de las reacciones adversas a los medicamentos de casi tercer grado, ahora se tratan todas las toxicidades de grado 2, es decir, de extensión moderada. En la RSC, se utiliza sobre todo el tocilizumab; en la neurotoxicidad, los esteroides desempeñan el papel más importante en el tratamiento. El efecto de este uso anterior de esteroides sobre la eficacia de la terapia con células T CAR es un tema muy debatido. Además, no debe descuidarse el aumento del riesgo de infección. En esta tensión, el mejor enfoque, según Barba, es tratar agresivamente al principio, pero suspender los esteroides lo antes posible. Desgraciadamente, algunos pacientes experimentan un nuevo episodio de neurotoxicidad, la llamada “segunda oleada”, durante la abstinencia.
En el futuro, el producto podría modificarse para mejorar el manejo de los efectos secundarios; los estudios correspondientes están en marcha. Si se producen toxicidades graves, las células CAR-T podrían “desconectarse” utilizando anticuerpos, por ejemplo. Aún está por ver si este enfoque puede prevenir las graves consecuencias de la terapia. Los expertos del Congreso de la EHA se mostraron bastante escépticos al respecto. Entonces, a menudo el daño ya está fijado, la cascada inflamatoria desencadenada.
Antes de la infusión: Optimizar las condiciones
Antes de que se puedan infundir las células CAR-T, hay que dar pasos importantes con terapias puente para reducir la carga tumoral, leucaféresis y linfodepleción, que pueden tener un impacto significativo en el éxito del tratamiento. En cuanto a la estrategia óptima para el control de la enfermedad antes de la terapia celular CAR-T, en la actualidad sigue existiendo una gran incertidumbre; la situación de los datos es insuficiente. Parece claro que la terapia puente es necesaria para la mayoría de los pacientes, ya que una carga de enfermedad elevada conlleva indiscutiblemente un peor resultado y un mayor riesgo de toxicidad. Los expertos reunidos en el congreso de la EHA coincidieron en que la progresión de la enfermedad debe evitarse en la medida de lo posible, aunque ello implique la administración de altas dosis de quimioterapia. En un estudio retrospectivo en el que se compararon diferentes procedimientos puente con respecto a la supervivencia global y libre de progresión de los pacientes con LDCBG, la radioterapia obtuvo los mejores resultados [2]. Sin embargo, este análisis sólo incluyó a cien pacientes y fue de naturaleza retrospectiva.
Para garantizar la propagación, el mantenimiento y la función más eficaces de las células CAR-T, se eliminan las células inmunitarias citotóxicas endógenas y las células inmunosupresoras en la denominada “linfodepleción”. Entre otras cosas, se liberan citoquinas endógenas que promueven la proliferación de células T. En los ensayos, se suele utilizar una combinación de fludarabina y ciclofosfamida, que se administra durante tres días. Como alternativa, existe la opción de utilizar bendamustina. Un punto de debate es la cuestión de si la quimioterapia linfodepletora debe administrarse también a aquellos pacientes que -por ejemplo tras un trasplante de células madre- ya presentan linfopenia. Esto debería aclararse con el uso creciente de células CAR-T, al igual que la cuestión de si son posibles mejores regímenes de linfodepleción.
El momento oportuno es el factor decisivo para obtener las células T del propio paciente mediante leucaféresis. En particular, la recogida debe tener lugar a una distancia suficiente de la quimioterapia puente. Esto es de suma importancia para la calidad del producto. Como regla general: intervalo de dos semanas desde la quimioterapia, intervalo de tres días a una semana desde la administración de esteroides. Sin embargo, no sólo el momento de la fase previa al tratamiento es de gran importancia para el éxito de la terapia celular CAR-T, sino también su duración global. En la actualidad, transcurren unos dos meses desde el contacto inicial hasta la infusión de las células CAR-T, demasiado tiempo si se tiene en cuenta que la enfermedad progresa durante este tiempo. Por ejemplo, un estudio publicado recientemente muestra que de 108 pacientes que inicialmente eran aptos para la terapia con células T CAR, sólo 52 recibieron finalmente el producto [3]. Aunque se aprecia una tendencia a acortar el tiempo de espera, aún hay margen de mejora. El aumento de la demanda impone exigencias cada vez mayores a las infraestructuras y a los oleoductos, que primero deben construirse en muchos lugares. Estos requisitos sólo pueden satisfacerse mediante una cooperación eficaz entre las clínicas, los centros y la industria.
Fuente: Sesión de expertos/mesa redonda “¿Cuál es la mejor manera de ayudar a los pacientes a tener éxito con las terapias de células T CAR?” en el Congreso de la EHA celebrado virtualmente el 11.06.2021, Claire Roddie, Londres, Reino Unido y Pere Barba, Barcelona, España.
Literatura:
- Yáñez L, Sánchez-Escamilla M, Perales MA: Toxicidad de las células T CAR: Manejo actual y orientaciones futuras. Hemasfera. 2019; 3(2): e186.
- Pinnix CC, et al: Terapia puente previa al ciloleucel axicabtagénico para el linfoma de células B grandes en recaída/refractario. Blood Adv. 2020; 4(13): 2871-2883.
- Carpio C, et al.: Proceso de selección y causas de no elegibilidad para la terapia con células CAR-T CD19 en pacientes con linfoma no Hodgkin de células B agresivo en recaída/refractario en un centro europeo. Leuc Linfoma. 2021: 1-4.
InFo ONCOLOGY & HEMATOLOGY 2021; 9(4): 26-27 (publicado el 20.9.21, antes de impresión).