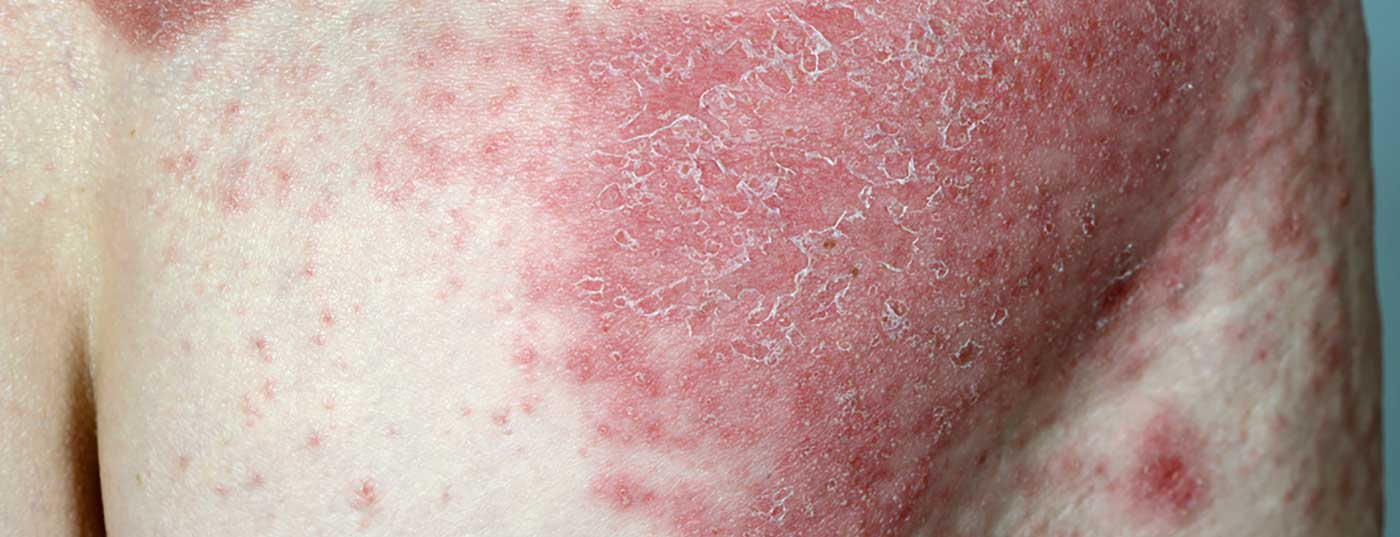
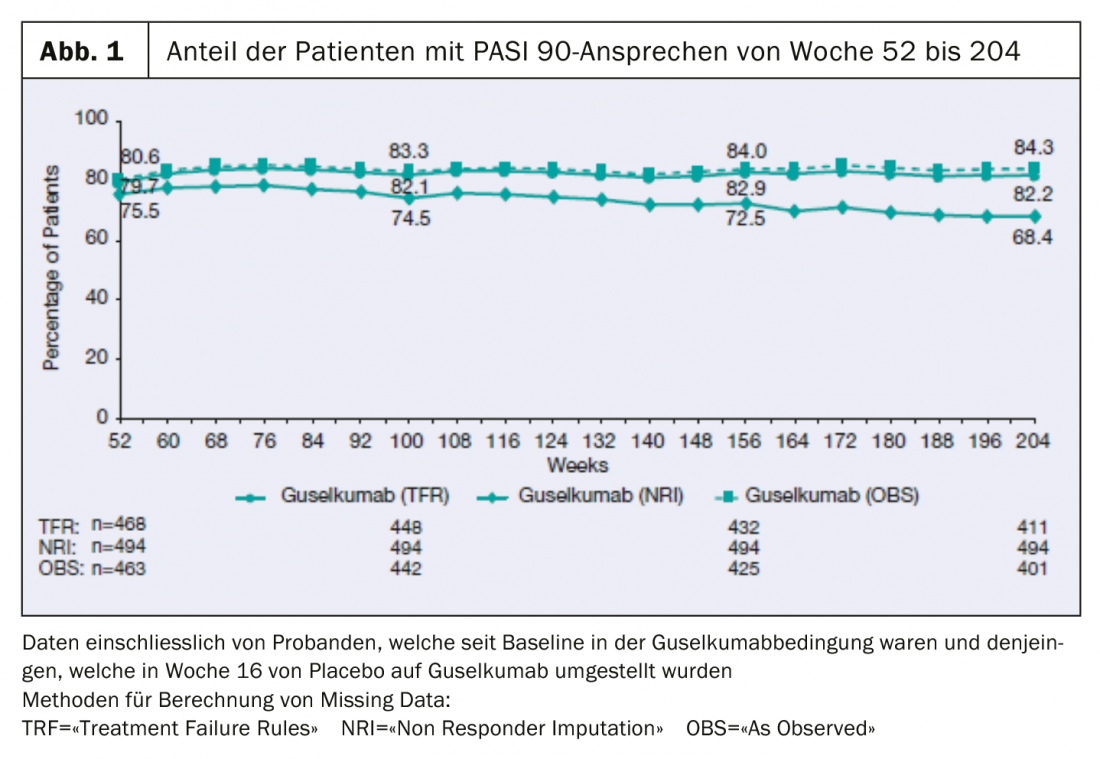
Los datos a largo plazo recientemente presentados del ensayo clínico de fase III VOYAGE 1 muestran que el 84% de los pacientes siguen alcanzando el PASI-90 después de 204 semanas.
El anticuerpo monoclonal guselkumab (TREMFYA®) está aprobado en Suiza desde 2018 para adultos con psoriasis en placas de moderada a grave que cumplan los requisitos para recibir tratamiento sistémico [1]. En el ensayo pivotal VOYAGE 1 (n=837), el guselkumab fue significativamente superior al adalimumab y al placebo en todos los criterios de valoración primarios (respuesta PASI-90) y secundarios clave (IGA 0/1, respuesta PASI-75).
Alta eficacia y tolerabilidad sostenidas
Ya están disponibles los datos de cuatro años de la fase abierta del estudio multicéntrico, aleatorizado y doble ciego VOYAGE 1, que se presentaron en el 39º Congreso de Dermatología Clínica de Otoño celebrado en Las Vegas (EE.UU.) [2]: La proporción de pacientes con PASI 90 se mantuvo estable hasta la semana 204: 8 de cada 10 pacientes mostraron una respuesta PASI 90 con guselkumab durante este periodo. (Fig. 1). El 82% de los pacientes que recibieron TREMFYA® (guselkumab) en el grupo combinado de pacientes aleatorizados inicialmente a la condición de guselkumab o placebo con cambio a guselkumab en la semana 16 lograron al menos una mejora del 90% en el índice de gravedad del área de psoriasis (PASI 90) en la semana 204. Además, una puntuación IGA de 0 (libre de lesiones) o 1 (casi libre de lesiones) era medible en este momento de medición.
El guselkumab (TREMFYA®) es el primer anticuerpo monoclonal totalmente humano aprobado que se une selectivamente a la subunidad p19 de la interleucina-23 (IL-23) e inhibe su interacción con el receptor de la IL-23 [1]. Esta sustancia bloquea así la liberación de estas citocinas inflamatorias, que intervienen en la formación de placas en la psoriasis. TREMFYA® fue generalmente bien tolerado por los pacientes con psoriasis durante el desarrollo clínico [3–5]. Tampoco se identificaron nuevas señales de seguridad durante el periodo abierto de 4 años [2].
Estudio de seguimiento de fase III VOYAGE 1
Los sujetos fueron asignados aleatoriamente al inicio del estudio a placebo, guselkumab o adalimumab. La fase de tratamiento controlada con placebo duró de la semana 0 a la 16. Posteriormente, los pacientes en la condición de placebo fueron cambiados a guselkumab hasta la semana 48, y se realizó una comparación con el principio activo adalimumab (semanas 0-48). Los participantes en el estudio fueron asignados aleatoriamente a recibir guselkumab en la semana 0 y los que cambiaron de placebo a guselkumab en la semana 16 recibieron guselkumab en la semana 48, con 8 semanas de diferencia. A partir de la semana 52, todos los participantes recibieron guselkumab. La eficacia se evaluó mediante el índice de área y gravedad de la psoriasis (PASI75/90/100) y las puntuaciones IGA (0=libre de lesiones, 1=casi libre de lesiones). Los datos que faltaban se calcularon utilizando los métodos siguientes: NRI (“Non-Responder Imputation Rules”), TFR (“Treatment Failure”) y OBS (“As Observed”).
Fuente: Janssen-Cilag AG
Literatura:
- Guía temática Tremfya®, 02/2019, www.swissmedicinfo.ch, último acceso 24.10.2019
- Griffiths CE, et al: Mantenimiento de la respuesta con hasta 4 años de tratamiento continuo con guselkumab: resultados del ensayo de fase 3 VOYAGE 1. Conferencia de Dermatología Clínica de Otoño. Oct, 2019; Las Vegas, EE.UU.
- Blauvelt A, et al: Eficacia y seguridad del guselkumab, un anticuerpo monoclonal anti-interleucina-23, en comparación con el adalimumab para el tratamiento continuo de pacientes con psoriasis de moderada a grave: Resultados del ensayo VOYAGE 1 de fase III, doble ciego, controlado con placebo y comparador activo. J Am Acad Dermatol 2017; 76(3): 405-417.
- Reich K, et al: Eficacia y seguridad del guselkumab, un anticuerpo monoclonal anti-interleucina-23, comparado con el adalimumab para el tratamiento de pacientes con psoriasis moderada a grave con retirada y retratamiento aleatorizados: Resultados del ensayo VOYAGE 2 de fase III, doble ciego, controlado con placebo y comparador activo. J Am Acad Dermatol 2017; 76(3): 418-431.
- Langley R, et al: Eficacia y seguridad del guselkumab en pacientes con psoriasis que presentan una respuesta inadecuada al ustekinumab: resultados del ensayo aleatorizado, doble ciego y de fase III NAVIGATE. Br J Dermatol 2018; 178(1): 114-123.
DERMATOLOGIE PRAXIS 2019; 29(6): 31 (publicado el 8.12.19, antes de impresión).