En la tercera jornada del Congreso EULAR de este año se presentaron novedades en el campo de la fibromialgia, la artritis idiopática juvenil, la artritis psoriásica y la osteoartritis. Expertos de cuatro países diferentes presentaron los hallazgos actuales sobre la patogénesis, las estrategias de diagnóstico y las formas de terapia de estas cuatro enfermedades reumáticas.
En la primera conferencia de la Sesión Caliente 6, el Prof. Dr. med. José António P. da Silva, de Portugal, profundizó en la fibromialgia. Las investigaciones demuestran que los cambios en el sistema nervioso central son la razón del sufrimiento. Como resultado, el cerebro procesa las señales de dolor de forma incorrecta, lo que provoca una intensificación de la sensación de dolor. Por lo tanto, en los pacientes con fibromialgia se necesita un estímulo mucho más débil que en las personas sanas para provocar dolor [1]. “En el tratamiento de esta enfermedad, se aplican a los médicos las mismas reglas que para todas las afecciones crónicas(Tab. 1).
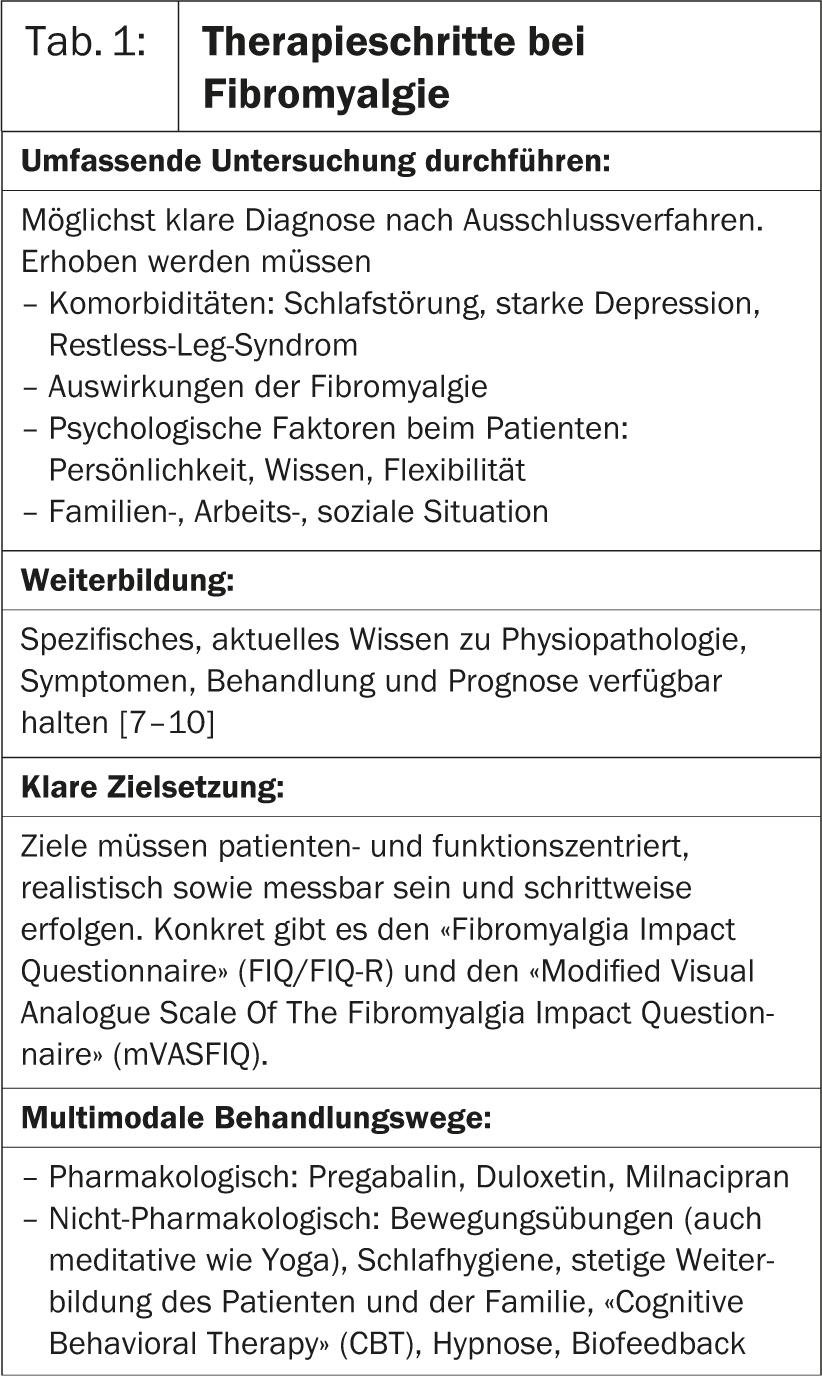
Tiene que hacerlo:
- Llevar a cabo una investigación exhaustiva
- formarse más
- Establezca objetivos terapéuticos claros
- encontrar vías de tratamiento multimodales, es decir, farmacológicas pero también no farmacológicas
- Vigile de cerca la respuesta a la terapia y los progresos o retrocesos.
- sacar conclusiones para la redefinición de la terapia.
El médico también tiene que demostrar que aborda la experiencia individual de la enfermedad del paciente con una mentalidad abierta y sin prejuicios, y que realmente se toma en serio el dolor del paciente”, afirma el Prof. da Silva. Según su propia valoración, la fibromialgia está inducida por el estrés, lo que provoca tensión muscular y dolor muscular. Por lo tanto, es importante preguntar con precisión las expectativas del paciente y evaluar en colaboración unos objetivos terapéuticos realistas para que la terapia genere el menor estrés adicional posible [2].
La pregabalina 450 mg/día ha demostrado su eficacia en los ensayos (alivio del dolor: 46,9% frente a placebo: 31,5%), pero acompañada de diversos efectos secundarios como mareos, fatiga, sequedad de boca, aumento de peso y edema periférico. Uno de cada cuatro pacientes interrumpió la terapia por este motivo (NND: 6) [3]. La duloxetina y el milnaciprán sólo ofrecen un pequeño beneficio en el alivio del dolor. Los problemas de sueño, la fatiga y la calidad de vida (CdV) tampoco mejoran sustancialmente en comparación con el placebo [4].
Dado que la depresión es frecuente como comorbilidad en la fibromialgia, la fluoxetina, la paroxetina o la sertralina también pueden ser eficaces. Casas et al. (2012) mostraron un alivio del dolor con efectos secundarios menores bajo terapia antidepresiva en un pequeño grupo de pacientes. Sin embargo, un número notable de participantes abandonó la terapia precisamente por el mal balance efecto/efecto secundario [5].
“Como alternativa no farmacológica puede considerarse, por ejemplo, la terapia cognitivo-conductual (TCC), que también alivia el dolor y reduce la depresión [6]”, afirma el profesor da Silva.
Artritis idiopática juvenil
El doctor Pierre Quartier, de París, habló sobre la artritis idiopática juvenil (AIJ). “Existen varios subtipos: artritis idiopática juvenil sistémica (también conocida como enfermedad de Still), poliartritis juvenil, oligoartritis, artritis psoriásica y otras. La aparición de esta enfermedad se produce siempre antes de los 16 años”, afirma el Dr. Quartier. La AIJ sistémica (AIJS), por ejemplo, es una forma especialmente grave de reumatismo infantil. Los criterios son inicio <16 años, duración >6 semanas, sin diagnóstico diferencial, fiebre ≥15 días y uno o más de los siguientes: Erupción cutánea, linfadenopatía, hepatomegalia o esplenomegalia, inflamación de las membranas serosas.
“En cualquier caso, un reumatólogo pediátrico debe trabajar en un equipo multidisciplinar. Esto significa que los padres del niño, el médico de cabecera, los cuidadores de la escuela o la guardería, etc. deben participar estrechamente en la terapia. Si es posible, se recomienda un tratamiento no agresivo. Se utilizan antiinflamatorios no esteroideos (AINE), inyecciones articulares (corticosteroides), fisioterapia y otras formas de cuidados”, afirma el Dr. Quartier. “Actualmente se están llevando a cabo numerosos ensayos clínicos sobre opciones farmacológicas para las formas de AIJ(Tab. 2). En general, el tratamiento de la AIJ puede considerarse un trabajo en proceso”.
Artritis psoriásica
“¿Qué hay de nuevo en el campo de la artritis psoriásica?” Esta pregunta fue respondida en la conferencia del doctor Juan J. Gómez-Reino, de Santiago. Estudios recientes respaldan la evidencia de que existe una relación entre un IMC elevado (obesidad) y el desarrollo de artritis psoriásica (APs) en pacientes con psoriasis confirmada [11, 12]. El tabaquismo también se ha confirmado como un importante factor de riesgo para la psoriasis [13].
En cuanto a las herramientas de diagnóstico en la APs temprana, los criterios del Grupo de Estudio CASPAR son más sensibles que los criterios de Moll y Wright [14]. Además, la resonancia magnética y los ultrasonidos (US) son cada vez más importantes en la APs. Aumentan la comprensión de esta enfermedad y contribuyen así a mejorar el diagnóstico y el control del tratamiento. La recién desarrollada puntuación PsAMRI ya se está utilizando en ensayos controlados aleatorios. Es muy adecuado para la medición objetiva de la actividad de la enfermedad. “La resonancia magnética multiarticular de todo el cuerpo (RMM-AMB) proporciona una especie de instantánea de la inflamación en las articulaciones afectadas en la APs [15]”, explicó el Dr. Gómez-Reino. “Además, la IRM puede ayudar a diferenciar la artritis reumatoide de la APs. Esto es especialmente cierto en pacientes seleccionados en los que los exámenes clínicos, de laboratorio y radiográficos convencionales no arrojaron resultados claros.”
En el tratamiento, los diferentes grados de eficacia y la evidencia de la tradicional
fármacos antirreumáticos modificadores de la enfermedad (DMARD), se resumen en la Tabla 3.
En conjunto, según el Dr. Gómez-Reino, surgen los siguientes puntos relevantes para la práctica:
- Las vías patogénicas recién identificadas se están considerando como dianas terapéuticas en la APs.
- La obesidad y el tabaquismo son factores de riesgo reversibles para la APs y para la respuesta a la terapia.
- La ecografía y la resonancia magnética tienen un gran potencial para el diagnóstico de la APs.
- El inhibidor oral de la PDE-4 apremilast, y posiblemente los biológicos que interfieren en la vía IL-23/IL-17, podrían ser un tratamiento alternativo para los pacientes con APs en los que los inhibidores del TNF no funcionan bien.
- Los factores de riesgo cardiovascular (dislipidemia, hipertensión, obesidad, diabetes mellitus, tabaquismo) son más prevalentes en los pacientes con APs que en los controles [16].

Osteoartritis
Según la Prof. Dra. med. Margreet Kloppenburg, de Leiden, hay dos temas de especial interés en este momento:
- El papel del hueso subcondral en la osteoartritis: La molécula de señalización de citoquinas “factor de crecimiento transformante β” (TGF-β) en el hueso subcondral podría ser una posible diana terapéutica.
- La terapia no farmacológica. En el tratamiento, la fisioterapia en particular puede ser eficaz. Sin embargo, sólo ciertas formas de la misma, como muestra un metaanálisis de Wang et al. (2012) muestra: Los ejercicios aeróbicos y acuáticos redujeron la discapacidad. Los ejercicios aeróbicos y de fuerza y los ultrasonidos redujeron el dolor y mejoraron la función. Así que una sola forma de terapia no podría mejorar todas las limitaciones al mismo tiempo. La diatermia, la ortopedia y la estimulación magnética fueron ineficaces [17].
“Todavía estamos en proceso de comprender esta enfermedad”, afirma el Prof. Kloppenburg. “Por ejemplo, la densidad mineral ósea (DMO) está asociada a la patogénesis de la osteoartritis: Un cambio en la DMO sistémica se asocia a la progresión de la enfermedad. También hay que examinar más de cerca el papel del hueso. Un estudio reciente demuestra que la administración de bifosfonatos puede reducir el dolor [18].”
Otros desiderata actuales se refieren a nuevas estrategias de diagnóstico. Según el profesor Kloppenburg, la IRM no es adecuada para la práctica clínica porque en la gran mayoría de las personas que no muestran evidencia radiográfica de osteoartritis, las lesiones pueden detectarse en las etapas media y avanzada de la vida [19].
“Además, el ranelato de estroncio, que en realidad es un fármaco para la osteoporosis, ha demostrado ser eficaz en la terapia. Un análisis post hoc de un ensayo sobre osteoporosis muestra que el ranelato de estroncio podría reducir la progresión radiográfica y el dolor de espalda en la artrosis vertebral frente al placebo [20]. Existen resultados similares para la artrosis de rodilla. En general, el fármaco fue bien tolerado [21]”, explicó el profesor Kloppenburg.
Fuente: EULAR, 12-15 de junio de 2013, Madrid
Literatura:
- Fibro Collaborative: Mayo Clin Proc 2012; 87: 488.
- Paiva, Jones: Best Pract Res Clin Rheumatol 2010; 24: 341-352.
- Tzellos, et al: J Clin Pharm Ther 2010 dic; 35(6): 639-56.
- Hauser, et al: The Cochrane Library 31 de enero de 2013.
- Casas, et al: CNS Drugs 2012; 26(4): 297-307.
- Bernardy, et al: J Rheumatol 2010 oct; 37(10): 1991-2005.
- Burckhardt, et al: J Rheumatol 1994; 21: 714-720.
- King, et al: J Rheumatol 2002; 29: 2620-2627.
- Rooks, et al: Arch Intern Med 2007; 167: 2192-2200.
- White, et al: Arthritis Rheum 2002; 47: 260-265.
- Wenqing, et al: Ann Rheum Dis 2012; 71: 1267-1272.
- Jon Love, et al: Ann Rheum Dis 2012; 71(8): 1273-1277.
- Li, et al: American Journal of Epidemiology 2011; 175(5): 402-413.
- Coates, et al: Arthritis Rheum 2012 oct; 64(10): 3150-5.
- Coates, et al: Best Pract Res Clin Rheumatol 2012; 26(6): 805-22.
- Jamnitski, et al: Ann Rheum Dis 2013; 72: 211-216.
- Wang, et al: Ann Intern Med 2012 Nov 6; 157(9): 632-44.
- Laslett, et al: Ann Rheum Dis. doi: 10.1136/annrheumdis-2012-202989.
- Guermazi, et al: BMJ 2012; 345. doi: http://dx.doi.org/10.1136/bmj.e5339 (Publicado el 29 de agosto de 2012).
- Bruyere, et al: Ann Rheum Dis 2008; 67: 335-339.
- Reginster, et al: Ann Rheum Dis 2013; 72: 179-186.












