Desde hace más de una década, los biomarcadores en el LCR y, más recientemente, en la voz han revolucionado verdaderamente el diagnóstico de la enfermedad de Alzheimer, permitiendo una detección más precisa y exacta de la patología. Las directrices 2024, con su enfoque clínico-biológico integrado, ofrecen un procedimiento más completo para el diagnóstico y la gestión personalizada de la enfermedad, con cursos específicos para cada estadio de la patología.
Puede realizar el examen CME en nuestra plataforma de aprendizaje después de revisar los materiales recomendados. Haga clic en el siguiente botón:
La enfermedad de Alzheimer (EA) es la principal causa de demencia en el mundo y afecta a más de 50 millones de personas. Esta patología neurodegenerativa progresiva se caracteriza por problemas de memoria, codificación y funciones cognitivas causados por la acumulación de placas amiloides y ovillos neurofibrilares en el cerebro. Históricamente, el diagnóstico se basaba principalmente en la observación de los síntomas clínicos, a menudo confirmados post mortem mediante análisis cervicales. Sin embargo, con la llegada de tecnologías modernas como la neuroimagen y el análisis de biofluidos, la AM se ha ido redefiniendo progresivamente como una patología biológica [1]. La introducción de biomarcadores, detectables en fluidos corporales como el líquido cefalorraquídeo (LCR) y, más recientemente, en la orina, ha cambiado significativamente la forma de diagnosticar la enfermedad, permitiendo una detección cada vez más precisa de la misma en los estudios de investigación. En 2018, el Institut National du Vieillissement (NIA) y la Association Alzheimer (AA) introdujeron el cuadro A/T/N (Amiloide/Tau/Neurodégénérescence), que permite diagnosticar la fisiopatología de la AM a partir de biomarcadores específicos [2]. Este cuadro ha transformado así la critériología del AM y su diagnóstico. Este artículo propone examinar esta transición de la AM de una interpretación clínica a una validación clínico-biológica, con especial atención a los biomarcadores más destacados detectados en el LCR y la voz, así como a las nuevas directrices 2024, que incorporan un enfoque clínico-biológico complementario para un diagnóstico preciso [3].
Los biomarcadores en el líquido cefalorraquídeo (LCR)
El líquido céfalo-raquídeo es un fluido biológico esencial para el estudio de los biomarcadores de la MA. Refleja directamente los cambios patológicos que se producen en el cuello uterino. Entre los biomarcadores más importantes que se miden en el LCR se encuentran el amiloide-β 42 (Aβ42), la proteína tau total (t-tau) y la proteína tau fosforilada (p-tau).
Amiloide-β 42 (Aβ42) y la relaciónAβ42/Aβ40: El amiloide-β 42 (Aβ42) es una proteína clave que forma las placas amiloides en el cerebro de los pacientes con MA. Se observa una disminución de la concentración de Aβ42 en el LCR debido a su acumulación en forma de placas. Cette diminution est un marqueur précoce de la pathologie amyloïde. [4,5] La relación Aβ42/Aβ40 es un indicador utilizado para mejorar la precisión del diagnóstico . Alors que Aβ42 diminue dans le LCR en raison de la formation de plaques, les niveaux d’Aβ40, une forme de la protéine amyloïde moins spécifique à la pathologie, restent stables. El cociente Aβ42/Aβ40 permite corregir las variaciones individuales de los niveles de amiloide-β y mejora la sensibilidad y la especificidad del diagnóstico de la AM. Un cociente bajo indica una acumulación de amiloide significativa y constituye un indicador fiable de la enfermedad.
La proteína Tau y su hiperfosforilación: La tau total (t-tau) en el LCR es un marcador general de la neurodegeneración. La proteína tau, en condiciones normales, está implicada en la estabilización de los microtúbulos de las neuronas. Sin embargo, en la MA, los niveles elevados de tau total en el LCR indican una degradación neuronal. Aunque tau es un indicador de la neurodegeneración [6], no es específico de la MA y puede ser elevado en otras patologías neurodegenerativas o tras una lesión cerebral aguda. La tau fosforilada (p-tau) es una forma modificada de la proteína tau, en la que los grupos fosfatos se añaden a sitios específicos, favoreciendo así la formación de cadenas neurofibrilares, una característica clave de la MA. Las principales formas de p-tau medidas en el LCR son p-tau181, p-tau217 y p-tau231. Estos biomarcadores son más específicos de la MA que la tau total.
- P-tau181 es uno de los primeros biomarcadores tau fosforilados identificados en la enfermedad de Alzheimer (MA). Su aumento en el LCR refleja los cambios patológicos relacionados con el enquistamiento de las neurofibrillas, que son un rasgo característico de la MA [7]. p-tau181 es un biomarcador sensible y relativamente específico de la MA, que permite diferenciar esta enfermedad de otros problemas neurodegenerativos. Sin embargo, aunque se asocia mayoritariamente a la AM, también puede ser muy elevado en otras formas de enfermedad.
- La p-tau217 está más estrechamente relacionada con la patología del AM que la p-tau181. [8,9] Estudios recientes han demostrado que la p-tau217 tiene una mejor correlación con la formación de placas amiloides y enquistamientos de tau . Debido a su mayor sensibilidad y especificidad, la p-tau217 podría sustituir progresivamente a la p-tau181 como biomarcador de referencia para el diagnóstico preclínico, sobre todo en las fases temprana y tardía de la enfermedad.
- El P-tau231 es un biomarcador aún en fase de estudio, pero podría aportar información complementaria sobre los estadios intermedios del DCL. [10,11] Su utilidad podría residir principalmente en el seguimiento de la transición entre el deterioro cognitivo leve (DCL) y la demencia . Aunque se trata de un promotor, p-tau231 aún requiere más investigación para validar su especificidad y su papel potencial en la práctica clínica.
- MTBR-Tau243: El MTBR-Tau243 es un biomarcador específico y prometedor para la detección de la patología tau en la enfermedad de Alzheimer (MA). Este biomarcador se caracteriza por su capacidad para detectar específicamente los agregados insolubles de tau, que están fuertemente asociados a los síntomas clínicos de la MA, en particular al deterioro cognitivo. Estudios recientes han demostrado que el MTBR-Tau243, medido en el liquide céphalorachidien (LCR), es el marcador que más corrélé à l’imagerie tau-PET, superando a otras formas de tau fosforiladas como la p-tau181 y la p-tau217. [12] Además, muestra un aumento significativo durante las fases avanzadas de la enfermedad, lo que constituye un indicador relevante para el seguimiento de la evolución de la patología tau .
Tecnologías avanzadas para la detección de proteínas en plasma
La detección de la proteína tau fosforilada (p-tau) en plasma representa uno de los avances recientes más prometedores en el campo de los biomarcadores de la enfermedad de Alzheimer (EA). Históricamente, la medición de la p-tau en plasma se ha visto limitada debido a su bajísima concentración y a la presencia de otras proteínas circulantes. [16–20] Sin embargo, tecnologías ultrasensibles como SIMOA (utilizada por Quanterix) y los inmunoensayos automatizados (desarrollados por Roche y Fujirebio) han superado estos obstáculos . Ahora permiten la detección precisa de biomarcadores como p-tau181, p-tau217 y la relación Aβ42/Aβ40, a concentraciones muy bajas. Entre estos biomarcadores, el p-tau217 se distingue por su capacidad para clasificar mejor la patología amiloide y tau, superando a otros biomarcadores como el Aβ42/Aβ40, que suelen ser menos sensibles debido a las variaciones del pH. Estas pruebas se utilizan cada vez más, no sólo en investigación, sino también para un diagnóstico preclínico más accesible y menos invasivo. Otras empresas, como C2N Diagnostics, han optimizado las pruebas de cribado para la detección de Aβ42/Aβ40 mediante espectrometría de masas. Aunque este biomarcador presenta una precisión menor que el p-tau217, sigue siendo crucial para evaluar la carga amiloide cervical, pero su interpretación debe asociarse a otros biomarcadores para garantizar una evaluación clínica fiable. Aunque estas innovaciones han demostrado un gran potencial para diversos biomarcadores, aún requieren una validación adicional antes de que puedan utilizarse ampliamente en la práctica clínica. No obstante, con las precauciones adecuadas, estas tecnologías podrían integrarse progresivamente en la práctica clínica, ofreciendo perspectivas prometedoras para un diagnóstico precoz, menos invasivo y potencialmente aplicable a la depilación masiva en el futuro.
Los biomarcadores sanguíneos
En los últimos años, los biomarcadores sanguíneos han cobrado importancia como alternativa no invasiva a los análisis de líquido cefalorraquídeo (LCR). Su facilidad de uso y su potencial de depósito los convierten en una valiosa herramienta para el diagnóstico de la enfermedad de Alzheimer (EA). Entre los biomarcadores más estudiados se encuentran las proteínas fosforiladas tau (p-tau), la cadena ligera de neurofilamentos (NfL), las proteínas ácidas gliofibrilares (GFAP), así como biomarcadores amiloides como la relación Aβ42/Aβ40 en plasma. [17] Aunque estos biomarcadores ofrecen perspectivas interesantes, su rendimiento varía en función de la tecnología utilizada y del estadio de la enfermedad .
Amiloide-β en la sangre: una alternativa prometedora pero limitada: La detección de proteínas amiloides en la sangre, en particular la relación Aβ42/Aβ40, representa un punto de inflexión para el diagnóstico no invasivo de la AM. [16] Sin embargo, estudios comparativos recientes demuestran que las pruebas basadas en Aβ42/Aβ40 son globalmente menos eficaces que las basadas en las proteínas p-tau217 . De hecho, las fluctuaciones debidas a factores periféricos no relacionados con la patología cervical, como la presencia de APP en diferentes tejidos, complican la interpretación de este biomarcador. Tecnologías como SIMOA y Lumipulse permiten medir este cociente con precisión, pero las variaciones sistémicas pueden reducir su especificidad. Aunque los biomarcadores amiloides pueden utilizarse para evaluar la carga amiloide cervical, a menudo es necesario combinarlos con otros biomarcadores para mejorar la precisión del diagnóstico.
Las proteínas tau fosforiladas (p-tau): diferencias tecnológicas e implicaciones clínicas: Las formas de p-tau que se miden en la sangre, como p-tau181, p-tau217 y, a veces, p-tau231, desempeñan un papel crucial en el diagnóstico precoz del MA. Según estudios recientes, la p-tau217 es uno de los biomarcadores más prometedores, con mejor precisión diagnóstica que la p-tau181, especialmente para diferenciar el MA de otras formas de depresión.
- P-tau181: Aunque es una de las primeras formas utilizadas para el diagnóstico sanguíneo, la P-tau181 presenta una sensibilidad limitada, sobre todo en estadios muy precoces de la enfermedad [8]. [21] Pruebas como las propuestas por Roche y Quanterix muestran un rendimiento aceptable, pero inferior al de la p-tau217 en términos de correlación con los resultados de la PET amiloide .
- [22]P-tau217: Según estudios recientes, el p-tau217 detectado mediante tecnologías como C2N y Fujirebio Lumipulse ofrece una mayor sensibilidad y especificidad para la detección de la patología amiloide, superando a otros biomarcadores en pruebas comparativas . [21] Los resultados del p-tau217 son particularmente elevados en las fases preclínicas de la enfermedad, lo que lo convierte en una herramienta esencial para un diagnóstico precoz .
Neurofilamento leucocitario (NfL): un marcador no específico de neurodegeneración: El NfL es un marcador no específico de neurodegeneración que se mide en la sangre. Bien que les niveaux de NfL augmentent dans plusieurs maladies neurodégénératives, y compris la MA, ses performances sont inférieures à celles de p-tau. El estudio muestra que pruebas como el Roche NeuroToolKit y el Quanterix Neurology 4-Plex permiten detectar la NfL con una buena sensibilidad, pero con una especificidad inferior en comparación con la p-tau217. No obstante, la NfL sigue siendo un marcador excelente para seguir la evolución de la degeneración neuronal y para evaluar los tratamientos neuroprotectores.
Gliofibrillaire acide protéine (GFAP): un marqueur de l’inflammation gliale: GFAP reflète l’inflammation gliale liée à l’activation des astrocytes dans le cerveau. El estudio muestra que el GFAP es un marcador promotor de la detección de la inflamación asociada a la patología amiloide, con aumentos significativos observados en los pacientes amiloides positivos. No obstante, al igual que el NfL, el GFAP no es específico de la MA y puede observarse en otras patologías neuroinflamatorias. [25] Las tecnologías Roche y Quanterix permiten medir la GFAP con gran precisión, y su combinación con el p-tau mejora la evaluación clínica .
Nota: El gen APOE, y en particular el alelo ε4, es el principal factor de riesgo genético de la AM. [26,27] Los portadores del alelo ε4 corren el riesgo de desarrollar la enfermedad . El alelo también se asocia a niveles más elevados de p-tau y placas amiloides, lo que aumenta la probabilidad de una rápida progresión de la patología. Además, los portadores de APOE ε4 suelen presentar niveles elevados de GFAP, lo que indica una neuroinflamación más marcada, lo que sugiere que este alelo contribuye no sólo a la acumulación de amiloide, sino también a la inflamación asociada a la AM. La consideración de la genética también puede servir de indicador para interpretar los resultados de un análisis de plasma de un paciente sintomático.
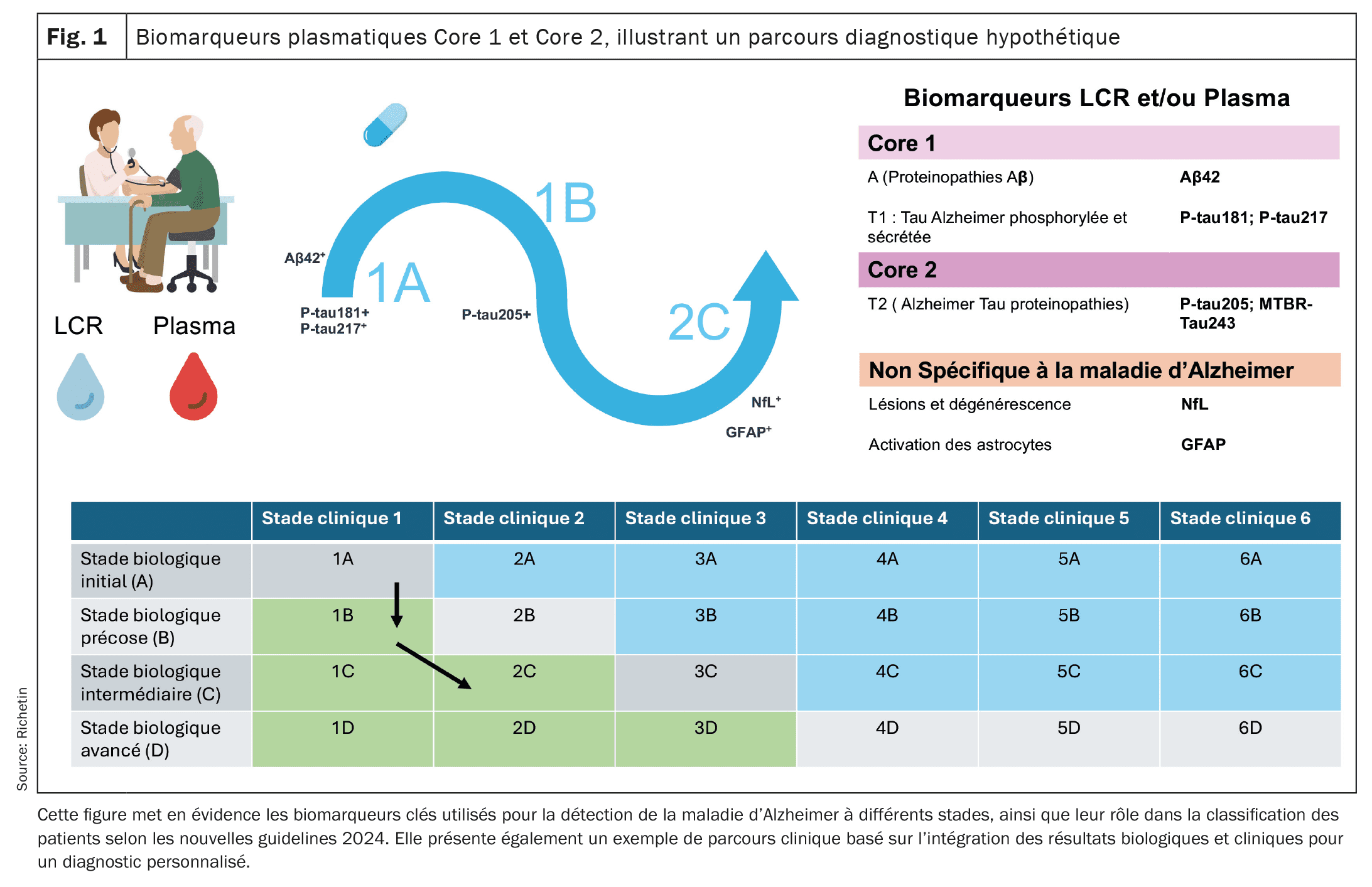
| Por tanto, está en marcha un nuevo concepto de vías de diagnóstico que probablemente se perfeccionará en los próximos años. A partir de ahora, las vías clasificarán a los pacientes en función de las anomalías de los biomarcadores Core 1 y Core 2, así como de la presencia o ausencia de síntomas clínicos, con el fin de ajustar el diagnóstico y el seguimiento. Estas nuevas directrices podrían proporcionar un marco más preciso para la evaluación diagnóstica y el seguimiento de la evolución de la AM de forma más personalizada, al integrar los biomarcadores plasmáticos, el LCR y las evaluaciones clínicas. También facilitan una carga adaptada a cada estadio de la enfermedad, desde la fase preclínica hasta las fases avanzadas de neurodegeneración. |
¿De la investigación al diagnóstico?
En las últimas décadas, los avances en la investigación de los biomarcadores de la enfermedad de Alzheimer han dado lugar a una transición crucial hacia la aplicación clínica y unos diagnósticos de precisión cada vez más accesibles. Los primeros estudios se centraron en la identificación de la patología amiloide y la proteinopatía tau en el líquido cefalorraquídeo (LCR), lo que condujo al desarrollo de pruebas capaces de detectar estas anomalías con gran precisión. Estos biomarcadores, utilizados inicialmente en investigación, han permitido confirmar la presencia de cambios fisiopatológicos antes que los síntomas. Sin embargo, el acceso a estas pruebas estaba limitado a los centros de investigación especializados debido a las técnicas invasivas y costosas utilizadas. Con la introducción de los biomarcadores plasmáticos, en particular las formas p-tau y la relación Aβ42/Aβ40, la investigación ha dado un paso decisivo hacia una aplicación clínica más amplia. La capacidad de detectar estos biomarcadores en el organismo, gracias a tecnologías ultrasensibles, ha abierto la puerta a una detección clínica no invasiva y más fácilmente realizable. Estas innovaciones podrían permitir confirmar fácilmente la fisiopatología del AM en pacientes con un cuadro clínico sugestivo e identificar a los individuos asintomáticos y en riesgo de desarrollar AM, incluso antes de la aparición de los síntomas cognitivos. Sin embargo, siguen existiendo retos en cuanto a la estandarización de las pruebas, su variabilidad (variación circadiana, función renal, función vascular), su disponibilidad en los grandes centros y la imputación de los costes, en particular para el reembolso de las pruebas plasmáticas. La integración progresiva de los biomarcadores en las vías asistenciales cotidianas, combinada con tecnologías de imagen como la PET amiloide y la PET-tau, permite no sólo un diagnóstico más preciso, sino también una mejor evaluación de la progresión de la enfermedad. Esta transición de la investigación a la clínica representa un gran avance para la medicina personalizada y podría permitir estrategias de prevención de segundo o tercer nivel en función del estadio de la enfermedad.
Hacia un enfoque clínico-biológico más integral
[16]En 2024, el Institut National du Vieillissement (NIA) y la Asociación de Alzheimer propusieron nuevas directrices basadas en un enfoque que combina evaluaciones clínicas y biológicas para mejorar el diagnóstico y el seguimiento de la evolución de la enfermedad de Alzheimer (EA) . Estas directrices se organizan en torno a dos categorías de biomarcadores: el Núcleo 1 y el Núcleo 2, así como varias vías de diagnóstico (1A, 1B, etc.), que permiten clasificar a los pacientes en función de la evolución de su patología. Los biomarcadores del Núcleo 1 miden directamente la patología amiloide y tau. Incluyen indicadores como la relación bêta-amiloide Aβ42/Aβ40 y las formas de tau fosforilada (p-tau181, p-tau217). Estas anomalías aparecen en las primeras fases de la enfermedad, a menudo en correlación con los resultados de las imágenes amiloides por PET, lo que facilita un diagnóstico preliminar antes de que aparezcan los síntomas clínicos. Los biomarcadores plasmáticos, en particular p-tau217 y p-tau181, han demostrado ser útiles para detectar estas anomalías en el plasma, lo que permite una detección más amplia y menos invasiva. No obstante, la interpretación de estos resultados debe asociarse a una evaluación clínica exhaustiva. Les biomarkers du Core 2 reflètent le processus de neurodégénérescence et de protéinopathie tau plus avancée, tels que la MTBR-tau243. Elles deviennent anormales dans les étapes plus avancées de l’MA, en association directe avec l’aparition de symptomes cognitifs. Biomarcadores como la cadena ligera de neurofilamentos (NfL) y la proteína ácida gliofibrilar (GFAP), detectados en el semen y el líquido cefalorraquídeo (LCR), proporcionan información precisa sobre la degeneración neuronal y la inflamación, desempeñando un papel crucial en la evaluación de la progresión de la enfermedad y la adaptación de las estrategias terapéuticas.Proposition d’un scénario hypothétique pour le parcours diagnostique et thérapeutique d’un patient atteint de la maladie d’Alzheimer
Étape 1: Depistage dans un centre de la memoire (Parcours 1A): El Sr. K., de 62 años, consulta durante una visita rutinaria sin síntomas cognitivos perceptibles. Teniendo en cuenta sus antecedentes familiares de enfermedad de Alzheimer, se le orientaría para una evaluación preliminar en un centro de la memoria. Un test sanguíneo podría revelar niveles anormalmente elevados de p-tau217 así como una relación Aβ42/Aβ40 reducida, indicadores potenciales de una patología amiloide. Ces résultats seraient confirmés par une analyse du liquide céphalorachidien (LCR), montrant une accumulation anormale d’amyloïde et de protéines tau. En esta fase, el Sr. K. no presentaba ningún síntoma clínico, pero sus biomarcadores del núcleo 1 (p-tau y Aβ) podían indicar una patología preclínica de Alzheimer (curso 1A). Dada la detección preclínica de esta patología amiloide, sería concebible proponer una terapia antiamiloide como el lecanemab o el donanemab para prevenir la formación de placas amiloides en el cerebro. Estos tratamientos, administrados en fase preclínica, podrían tener como objetivo ralentizar la progresión de los síntomas cognitivos graves.
Étape 2: Apparition de troubles cognitifs légers (Parcours 1B): Deux ans plus tard, le Sr. K. pourrait commencer à ressentir des troubles de la mémoire légers, comme des oublis de rendez-vous. Se realizaría entonces una reevaluación clínica, que incluiría una nueva serie de análisis sanguíneos y una prueba lombaire. Los resultados podrían mostrar anomalías persistentes en los biomarcadores del núcleo 1, confirmando la continuidad de la patología amiloide y tau. Las pruebas neuropsicológicas pudieron revelar una ligera détérioration cognitiva. En esta fase, el Sr. K. entró en el curso 1B, caracterizado por la presencia de problemas cognitivos leves (deterioro cognitivo leve, o DCL) asociados a biomarcadores anormales. Esta evolución podría justificar una intensificación de la vigilancia y un aumento del potencial de la terapia antiamiloide para mejorar la prevención de los síntomas graves. Estos tratamientos seguirían administrándose para ralentizar la progresión hacia una enfermedad confirmada.
Étape 3: Évolution vers une neurodégénérescence avancée (Parcours 2C): Cinq ans après le diagnostic initial, les symptômes de Mr K. s’aggraveraient. Pudo presentar problemas cognitivos más graves que afectaban a sus actividades cotidianas, marcando así la transición a una demencia más avanzada. Se llevó a cabo una nueva serie de análisis de biomarcadores, que reveló anomalías en los biomarcadores Core 2, como la variación p-tau205. Además, los biomarcadores de neurodegeneración, como la NfL (cadena ligera de neurofilamentos) y la GFAP (proteína ácida fibrilar glial), pueden indicar neuroinflamación y destrucción activa de neuronas. Una imagen tau-PET podría mostrar un aumento de la acumulación de tau en las regiones asociadas a la cognición. En esta fase, el Sr. K. se encontraba en el curso 2C, con una neurodegeneración pronunciada. El plan de tratamiento se centró en el manejo de los síntomas cognitivos y conductuales, con una combinación de tratamientos sintomáticos, cuidados personalizados y un mayor apoyo a la familia, con el objetivo de mantener la calidad de vida del paciente.
Conclusión: Este escenario hipotético pone de relieve la importancia de la detección previa mediante biomarcadores sanguíneos y LCR en la enfermedad de Alzheimer. También muestra que la introducción de fármacos antiamiloides podría ayudar a ralentizar la progresión de la enfermedad antes de la aparición de los síntomas. El seguimiento continuado de los biomarcadores, unido a las evaluaciones neuropsicológicas, permite ajustar las intervenciones terapéuticas en función de la evolución biológica y clínica, garantizando así un enfoque personalizado del paciente.
Ventajas clínicas del diagnóstico precoz
El diagnóstico precoz de la enfermedad de Alzheimer, posible gracias a los biomarcadores en el LCR y la voz, aporta importantes beneficios clínicos. Permite intervenir en una fase en la que los tratamientos, aunque limitados en su capacidad de revertir la enfermedad, pueden detener la progresión de los síntomas cognitivos. Al identificar la patología en el estadio 1A, cuando los pacientes aún no presentan signos clínicos, los médicos pueden poner en marcha estrategias terapéuticas preventivas destinadas a ralentizar la transición a estadios más sintomáticos. Otra ventaja clave de la intervención precoz es que ofrece la posibilidad de planificar mejor los cuidados a largo plazo. Una vez identificada la patología mediante biomarcadores amiloides o tau, los pacientes y sus familias pueden beneficiarse de una mejor anticipación del desarrollo de la enfermedad. Esto incluye decisiones más informadas en cuanto a los cuidados, la gestión financiera y la organización de la vida diaria, así como el establecimiento de redes de apoyo adaptadas. Este enfoque proactivo permite mejorar la calidad de vida del paciente, ralentizando los efectos incapacitantes de la demencia y favoreciendo unos cuidados personalizados.
El diagnóstico preclínico, gracias a biomarcadores como p-tau217 y Aβ42/Aβ40, también permite tomar una decisión terapéutica más precisa y adaptada al paciente. Los médicos pueden determinar con mayor rapidez si un paciente es apto para someterse a ensayos clínicos sobre nuevas terapias o a tratamientos para modificar la enfermedad con el fin de reducir la acumulación de amiloide o tau. Al tratar a los pacientes en las primeras fases de la enfermedad, también es posible limitar el impacto de las complicaciones secundarias asociadas al desarrollo de la MA, como la pérdida de autonomía, los problemas de comportamiento y el aumento de la carga que soportan los cuidadores. [28] Por último, el diagnóstico precoz permite una mejor gestión de los recursos médicos, especialmente en países con escasos recursos . Al identificar con mayor precisión a los pacientes que más necesitan un seguimiento estrecho o intervenciones específicas, los médicos pueden adaptar sus prácticas y priorizar los cuidados en función de la gravedad de la enfermedad. Esto también podría tener implicaciones económicas positivas al reducir los costes a largo plazo asociados a las intervenciones tardías para la demencia avanzada, que a menudo implican hospitalización y cuidados más complejos.
Conclusión
Los biomarcadores en el LCR y la voz han revolucionado verdaderamente el diagnóstico de la enfermedad de Alzheimer, permitiendo una detección más precisa y exacta de la patología, incluso antes de la aparición de los síntomas clínicos. Las directrices 2024, con su enfoque clínico-biológico integrado, ofrecen un procedimiento más completo para el diagnóstico y la gestión personalizada de la enfermedad, con cursos específicos para cada estadio de la patología. Sin embargo, a pesar de estos avances, es necesario seguir esforzándose por hacer más accesibles estas tecnologías, en particular ampliando su disponibilidad más allá de los centros especializados y abordando las cuestiones del coste y el reembolso. Estas iniciativas serán cruciales para mejorar la gestión de esta enfermedad a gran escala, al permitir un acceso más equitativo a un diagnóstico precoz y a intervenciones terapéuticas y de supervivencia más adecuadas.
Mensajes para llevar a casa
- Desde hace más de una década, los biomarcadores en el LCR y, más recientemente, en la voz han revolucionado verdaderamente el diagnóstico de la enfermedad de Alzheimer, permitiendo un diagnóstico más preciso y exacto de la patología.
- Las directrices 2024, con su enfoque clínico-biológico integrado, ofrecen un procedimiento más completo para el diagnóstico y el tratamiento personalizado de la enfermedad, con cursos específicos para cada fase de la patología.
- Sin embargo, a pesar de estos avances, es necesario seguir esforzándonos para que estas tecnologías sean más fiables y accesibles. En los próximos años, los biomarcadores de la enfermedad de Alzheimer en la voz podrían transformar la forma en que se diagnostica la enfermedad de Alzheimer con antelación, ofreciendo así una ventana de oportunidad para la intervención incluso antes de la aparición de los síntomas clínicos.
- Marcadores como p-tau217 y la relación Aβ42/Aβ40 favorecen una mayor precisión diagnóstica, lo que permite prever estrategias terapéuticas para minimizar la progresión de la enfermedad.
- Estos avances ofrecieron a los médicos herramientas más sensibles, menos invasivas y potencialmente aplicables en la práctica clínica rutinaria.
- Aunque existen retos en términos de estandarización y costes para los sistemas sanitarios, las directrices 2024 abren la puerta a la atención personalizada, combinando la evaluación biológica y clínica para optimizar los cuidados en cada fase de la enfermedad.
Littérature:
- Huang S, Wang YJ, Guo J: Biomarcadores biofluídicos de la enfermedad de Alzheimer: avances, problemas y perspectivas. Boletín de Neurociencia 2022 38: 6 38, 677-691 (2022).
- Jack CR, et al: Marco de investigación NIA-AA: Hacia una definición biológica de la enfermedad de Alzheimer. Alzheimer’s & Dementia 2018; 14: 535-562.
- Jack CR, et al: Criterios revisados para el diagnóstico y la estadificación de la enfermedad de Alzheimer: Grupo de trabajo de la Asociación de Alzheimer. Alzheimer’s and Dementia 2024; 20: 5143-5169.
- Salvadó G, et al: Asociaciones específicas entre biomarcadores plasmáticos y cargas postmortem de placa amiloide y ovillos tau. EMBO Mol Med 2023; 15.
- Hansson O, Lehmann S, Otto M, et al: Ventajas y desventajas del uso de la proporción de amiloide β (Aβ) 42/40 del LCR en el diagnóstico de la enfermedad de Alzheimer. Alzheimers Res Ther 2019; 11: 1-15.
- Holper S, Watson R, Yassi N: Tau como biomarcador de la neurodegeneración. Revista Internacional de Ciencias Moleculares 2022; 23: 7307.
- Kurihara M, Komatsu H, Sengoku R: ARTÍCULO COMPLETO LCR P-Tau181 y otros biomarcadores en pacientes con enfermedad de inclusión intranuclear neuronal. Citar como: Neurology® 2023; 100: 1009-1019.
- Janelidze S, et al: P-tau181 plasmático en la enfermedad de Alzheimer: relación con otros biomarcadores, diagnóstico diferencial, neuropatología y progresión longitudinal hacia la demencia de Alzheimer. Nat Med (2020), doi: 10.1038/s41591-020-0755-1.
- Janelidze S, et al: La p-tau217 del líquido cefalorraquídeo funciona mejor que la p-tau181 como biomarcador de la enfermedad de Alzheimer. Nature Communications 2020; 11(1): 1-12.
- Ashton NJ, et al: Plasma p-tau231: un nuevo biomarcador de la patología incipiente de la enfermedad de Alzheimer. Acta Neuropathol 2021; 141: 709-724.
- Buerger K, et al: La proteína tau del LCR fosforilada en la treonina 231 se correlaciona con el deterioro cognitivo en sujetos con DCL. Neurología 2002; 59: 627-629.
- Horie K, et al: El MTBR-tau243 del LCR es un biomarcador específico de la patología de los ovillos de tau en la enfermedad de Alzheimer. Nature Medicine 2023; 29(8): 1954-1963.
- Lantero-Rodriguez J, et al: LCR p-tau205: un biomarcador de la patología tau en la enfermedad de Alzheimer. Acta Neuropathol 2024; 147: 1-17.
- Olsson B, et al: Biomarcadores de LCR y sangre para el diagnóstico de la enfermedad de Alzheimer: una revisión sistemática y metaanálisis. Lancet Neurol 2016; 15: 673-684.
- Santangelo R, et al: El cociente p-tau181/Aβ42 del LCR ofrece una buena precisión “in vivo” en el diagnóstico diferencial de la demencia de Alzheimer. Curr Alzheimer Res 2019; 16: 587-595.
- Schindler SE, et al: Comparación directa de los principales análisis de sangre para detectar la patología de la enfermedad de Alzheimer. Alzheimer’s & Dementia (2024), doi: 10.1002/ALZ.14315.
- Hampel H, et al: Biomarcadores sanguíneos para la enfermedad de Alzheimer: estado actual y uso futuro en un panorama sanitario mundial transformado. Neuron 2023; 111: 2781-2799.
- Hansson O, et al: Recomendaciones de uso apropiado de la Asociación de Alzheimer para biomarcadores sanguíneos en la enfermedad de Alzheimer. Alzheimer’s & Dementia 2022; 18: 2669-2686.
- Hansson O, Blennow K, Zetterberg H, Dage J: Biomarcadores sanguíneos para la enfermedad de Alzheimer en la práctica clínica y los ensayos. Nat Aging 2023; 3: 506-519.
- Álvarez-Sánchez L, Peña-Bautista C, Baquero M, Cháfer-Pericás C: Novedosas tecnologías de detección ultrasensible para la identificación de biomarcadores sanguíneos tempranos y mínimamente invasivos de la enfermedad de Alzheimer. Revista de la enfermedad de Alzheimer 2022; 86: 1337-1369.
- Blennow K, et al: El valor clínico potencial de los biomarcadores plasmáticos en la enfermedad de Alzheimer. Alzheimer’s & Dementia 2023; 19: 5805-5816.
- Ashton NJ, et al: Precisión diagnóstica de un inmunoensayo de Tau 217 fosforilada en plasma para la patología de la enfermedad de Alzheimer. JAMA Neurol 2024; 81: 255-263.
- Alcolea D, Beeri MS, Rojas JC, et al: Biomarcadores sanguíneos en las enfermedades neurodegenerativas: Implicaciones para el Neurólogo Clínico. Neurología 2023; 101: 172-180.
- Palmqvist S, et al: Precisión discriminativa de la fosfo-tau217 plasmática para la enfermedad de Alzheimer frente a otros trastornos neurodegenerativos. JAMA 2020; 324: 772-781.
- Kim KY, Shin KY, Chang KA: GFAP como biomarcador potencial de la enfermedad de Alzheimer: una revisión sistemática y metaanálisis. Cells 2023: 12.
- Yakoub Y, et al: Trayectorias longitudinales de biomarcadores sanguíneos en la enfermedad de Alzheimer preclínica. Alzheimers Dement 2023; 19: 5620-5631.
- Stevenson-Hoare J, et al: Biomarcadores plasmáticos y genética en el diagnóstico y la predicción de la enfermedad de Alzheimer. Cerebro 2023; 146: 690-699.
- Nwamekang Belinga L, et al: Biomarcadores circulantes para la enfermedad de Alzheimer: Desbloquear el potencial diagnóstico en los países de ingresos bajos y medios, centrándose en África. Neurodegener Dis 2024; 24: 26-40.
InFo NEUROLOGÍA Y PSIQUIATRÍA 2024; 22(6): 14-19