El diagnóstico, la terapia y el seguimiento del cáncer de testículo están claramente definidos por recomendaciones de consenso internacional. Las posibilidades de curar el cáncer testicular son altas con un tratamiento adecuado. Los pacientes con cáncer testicular deben ser presentados en un centro oncológico especializado.
Aunque el cáncer de testículo es poco frecuente, con una incidencia de alrededor de 10/100.000 habitantes, es el cáncer más común en el grupo de edad de los hombres de 15 a 40 años. En alrededor del 3%, también existe un estadio precanceroso en el testículo contralateral no tumoral (CIS o TIN o IGCNU), y en alrededor del 5% el cáncer testicular se produce principalmente de forma extragonadal (los denominados tumores extragonadales de células germinales). Por lo tanto, el diagnóstico diferencial de tumor testicular o tumor de células germinales debe incluirse en todos los hombres con un tumor primario poco claro [1]. Debido a la respuesta inusualmente buena a la terapia y gracias a los estudios realizados con constancia, el cáncer testicular se convirtió muy pronto en una especie de “enfermedad modelo” para describir el éxito de la acción oncológica.
Diagnóstico, estadificación y estratificación del riesgo
El diagnóstico primario del cáncer de testículo implica en primer lugar los pasos que se muestran en la tabla 1. Sólo es necesario realizar un TAC o una RMN de la cabeza si se detectan metástasis pulmonares o si se presentan síntomas clínicos. La PET-TC no tiene ningún papel en el diagnóstico primario del cáncer testicular [1].

En cuanto a la histología, es importante la distinción entre seminomas, no seminomas y teratomas maduros. Todos los tumores mixtos y todos los tumores de pacientes con elevación de AFP se consideran no seminomas independientemente de su histología. En la estadificación, en la rutina clínica se distingue entre el estadio I, con enfermedad confinada al testículo, y los estadios de tumor metastásico. En pacientes con una clara elevación de los marcadores tumorales AFP y HCG, no es necesaria la confirmación histológica, incluso en el caso de tumores extragonadales de células germinales.
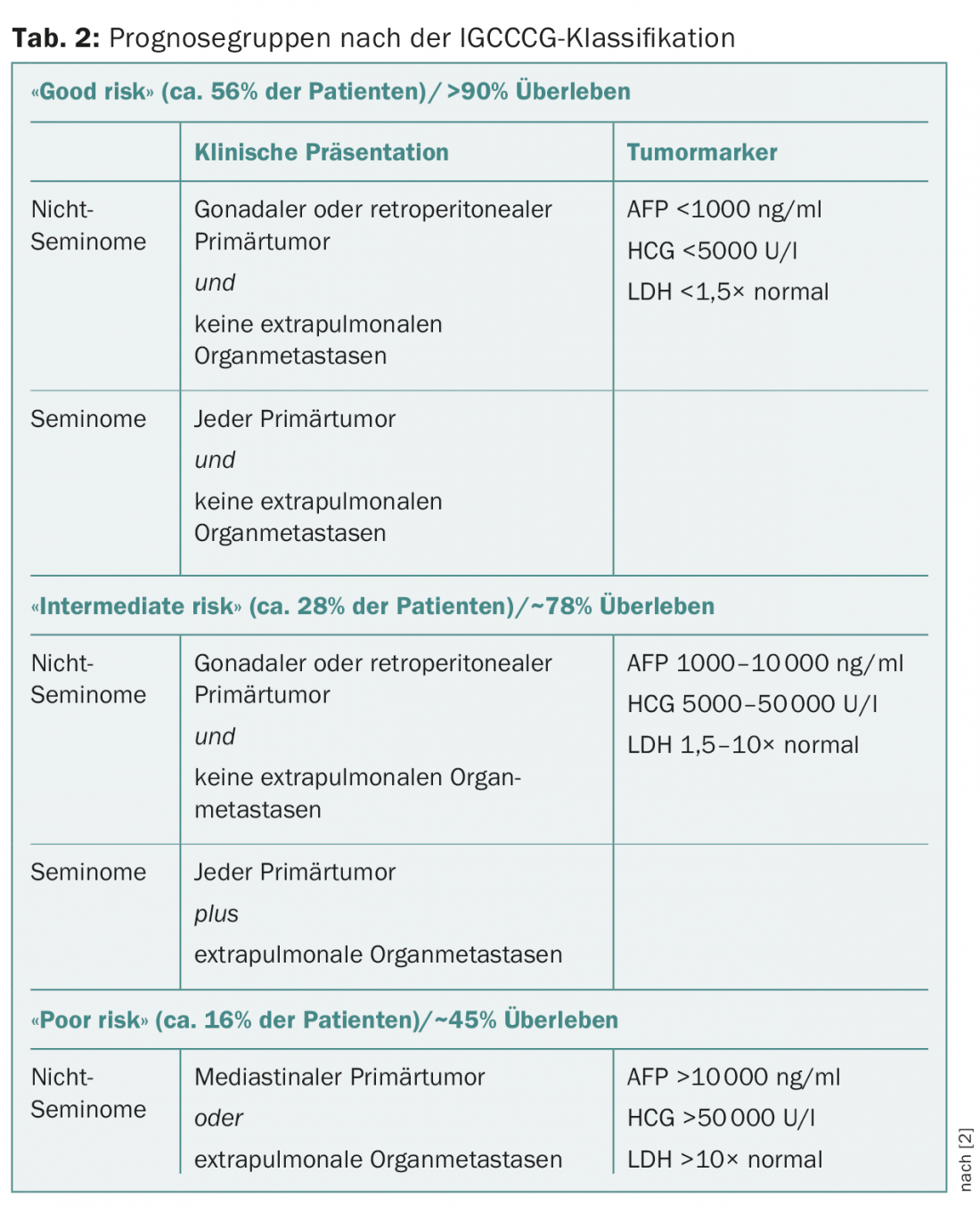
En el estadio clínico I con enfermedad confinada al testículo, el tamaño del tumor, la infiltración de la rete testis y, más recientemente, la invasión vascular linfovascular en el tumor primario se discuten como factores de riesgo de metástasis oculta en los seminomas, pero son controvertidos. En los no seminomas en estadio I, la invasión vascular linfovascular en el tumor primario se confirma como un factor de riesgo de metástasis oculta, pero la importancia de la infiltración de la rete testicular o del porcentaje de carcinoma embrionario es controvertida. Los estadios tumorales metastásicos se dividen en tres grupos de pronóstico según la clasificación del IGCCCG (International Germ Cell Cancer Collaborative Group) (Tab. 2) [2].
Terapia primaria
Los pacientes con enfermedad gonadal reciben principalmente una orquiectomía. Una biopsia del testículo contralateral no afectado es útil para identificar a los pacientes con CIS o TIN o IGCNU, pero sigue siendo opcional. Los pacientes con enfermedad ampliamente metastatizada y un tumor primario gonadal, por otro lado, reciben principalmente quimioterapia y sólo tras la finalización de la quimioterapia una orquiectomía.
Terapia de fase I
Los pacientes con seminoma en estadio I reciben vigilancia activa de forma estándar con un riesgo de recurrencia de entre el 10 y el 25%. La terapia adyuvante con un ciclo de carboplatino a una dosis AUC 7 puede reducir el riesgo de recidiva al 5%, pero es una terapia excesiva para la mayoría de las pacientes. La radioterapia paraaórtica adyuvante con 20 Gy se reserva para casos individuales.
Las pacientes con no seminomas en estadio I sin invasión linfovascular en el tumor primario reciben vigilancia activa de forma estándar con un riesgo de recurrencia de aproximadamente el 15%. Un ciclo de quimioterapia adyuvante con cisplatino, etopósido y bleomicina (PEB) puede reducir el riesgo de recidiva a menos del 3%, pero es un tratamiento excesivo para la mayoría de las pacientes.
Las pacientes con no seminomas en estadio I e invasión linfovascular en el tumor primario reciben también vigilancia activa, con un riesgo de recidiva de alrededor del 50%, o un ciclo de quimioterapia adyuvante con PEB, que reduce el riesgo de recidiva a menos del 3%. La linfadenectomía retroperitoneal como terapia primaria para los no seminomas en estadio I se reserva para casos individuales.
Antes de cualquier terapia adyuvante de seminomas y no seminomas en estadio I, es necesaria una determinación de los marcadores tumorales AFP, HCG y LDH. Los pacientes con marcadores tumorales persistentemente elevados o incluso en aumento tras la orquiectomía no se consideran en estadio I sino en estadio tumoral metastásico, incluso en ausencia de pruebas radiológicas de metástasis.
Terapia para estadios metastásicos
Los pacientes con seminoma metastásico reciben tres ciclos (“buen riesgo”), raramente cuatro ciclos (“riesgo intermedio”) de PEB, dependiendo de la categoría IGCCCG. Los pacientes con metástasis muy limitadas en los ganglios linfáticos abdominales de hasta aprox. 2 cm pueden ser irradiados alternativamente o, en el caso de metástasis de hasta un máximo de 5 cm, incluidos en el ensayo SAKK 01/10 en curso para este estadio [3].
Las pacientes con no seminomas metastásicos reciben tres (“buen riesgo”) o cuatro (“riesgo intermedio” y “pobre”) ciclos de PEB, según la categoría IGCCCG. Un descenso inadecuado del marcador tras el primer ciclo de terapia es un factor pronóstico negativo adicional en pacientes de “bajo riesgo”. Estos pacientes pueden beneficiarse de una terapia combinada compleja y “densa en dosis” del grupo de trabajo francés GETUG [4].
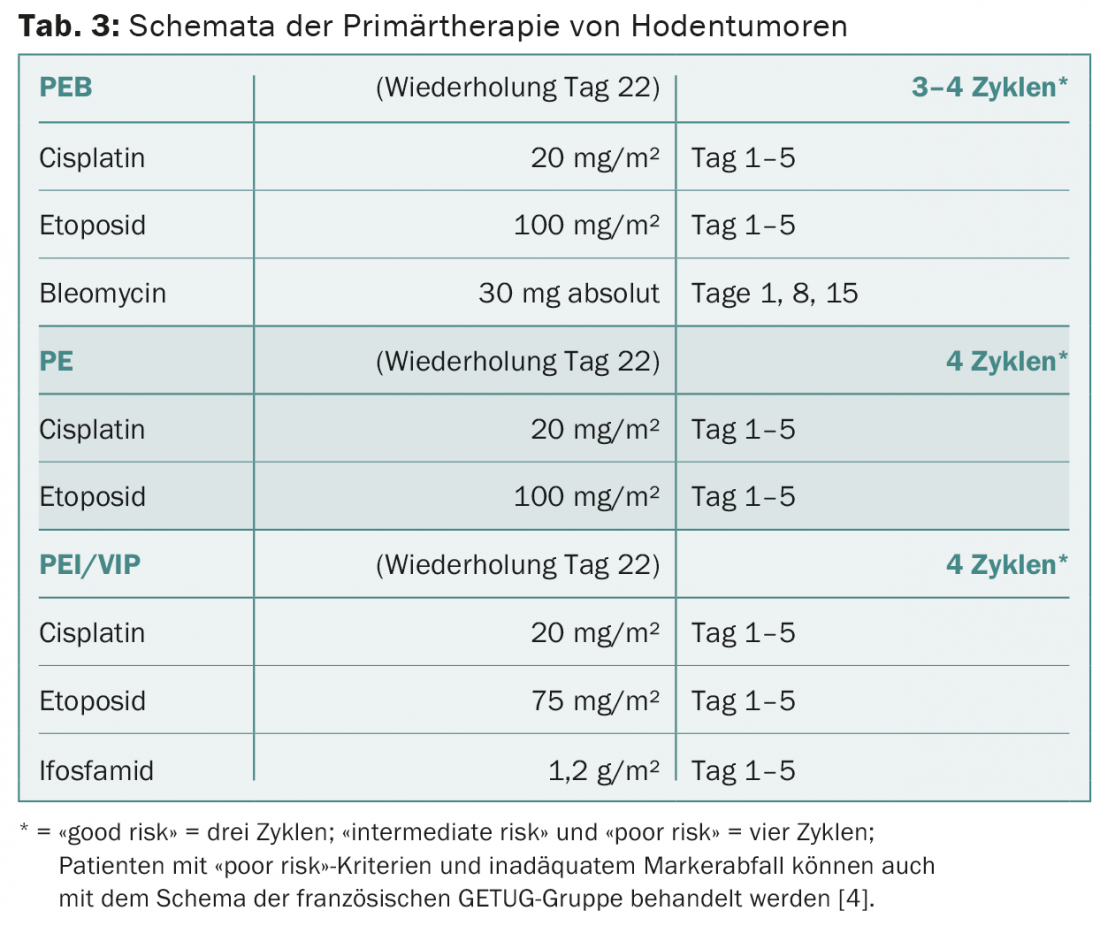
La PEB se aplica a seminomas y no seminomas exclusivamente según el régimen estándar (tab. 3) . Deben respetarse los intervalos de terapia de tres semanas. La bleomicina debe omitirse en pacientes de edad avanzada y en pacientes con una función pulmonar o renal deficiente. En pacientes con un pronóstico favorable, la terapia puede ser igualmente eficaz con cuatro ciclos de cisplatino y etopósido sin bleomicina en lugar de tres ciclos de PEB. En los pacientes con un pronóstico intermedio o desfavorable, la bleomicina debe sustituirse por ifosfamida. La decisión de utilizar quimioterapia primaria a dosis altas se toma de forma individual para los pacientes de alto riesgo con no seminomas mediastínicos primarios y para los pacientes con metástasis hepáticas, óseas o en el SNC.
Evaluación terapéutica y resección de tumores residuales
En todos los pacientes con seminomas y no seminomas, los exámenes diagnósticos primarios se repiten aproximadamente tres semanas después del inicio del último ciclo terapéutico. La estadificación intermedia no suele ser necesaria y la PET-TC no tiene valor en la evaluación terapéutica, excepto en pacientes con seminoma puro y tumor residual tras la quimioterapia primaria.
Los pacientes con seminoma puro sin remisión completa tras la quimioterapia no reciben una resección del tumor residual, sino una PET-TC como muy pronto doce semanas después del inicio de la última quimioterapia. La decisión terapéutica posterior se toma individualmente en función de los resultados de la PET.
Los pacientes con no seminomas sin remisión completa reciben resección de todos los residuos detectables radiológicamente como muy tarde entre cuatro y ocho semanas después del inicio del último ciclo de quimioterapia. La decisión terapéutica posterior se toma individualmente en función de los hallazgos histológicos.
Terapia recurrente
El tratamiento de los pacientes con seminoma y no seminoma y recidiva tras la terapia del estadio I es análogo a los algoritmos de tratamiento de los pacientes con enfermedad metastásica primaria, independientemente de la elección del tratamiento primario. Por regla general, en estos pacientes se utilizan de tres a cuatro ciclos de PEB, en función del estadio tumoral. Como resultado, la mayoría de estos pacientes quedan libres de la enfermedad de forma permanente.
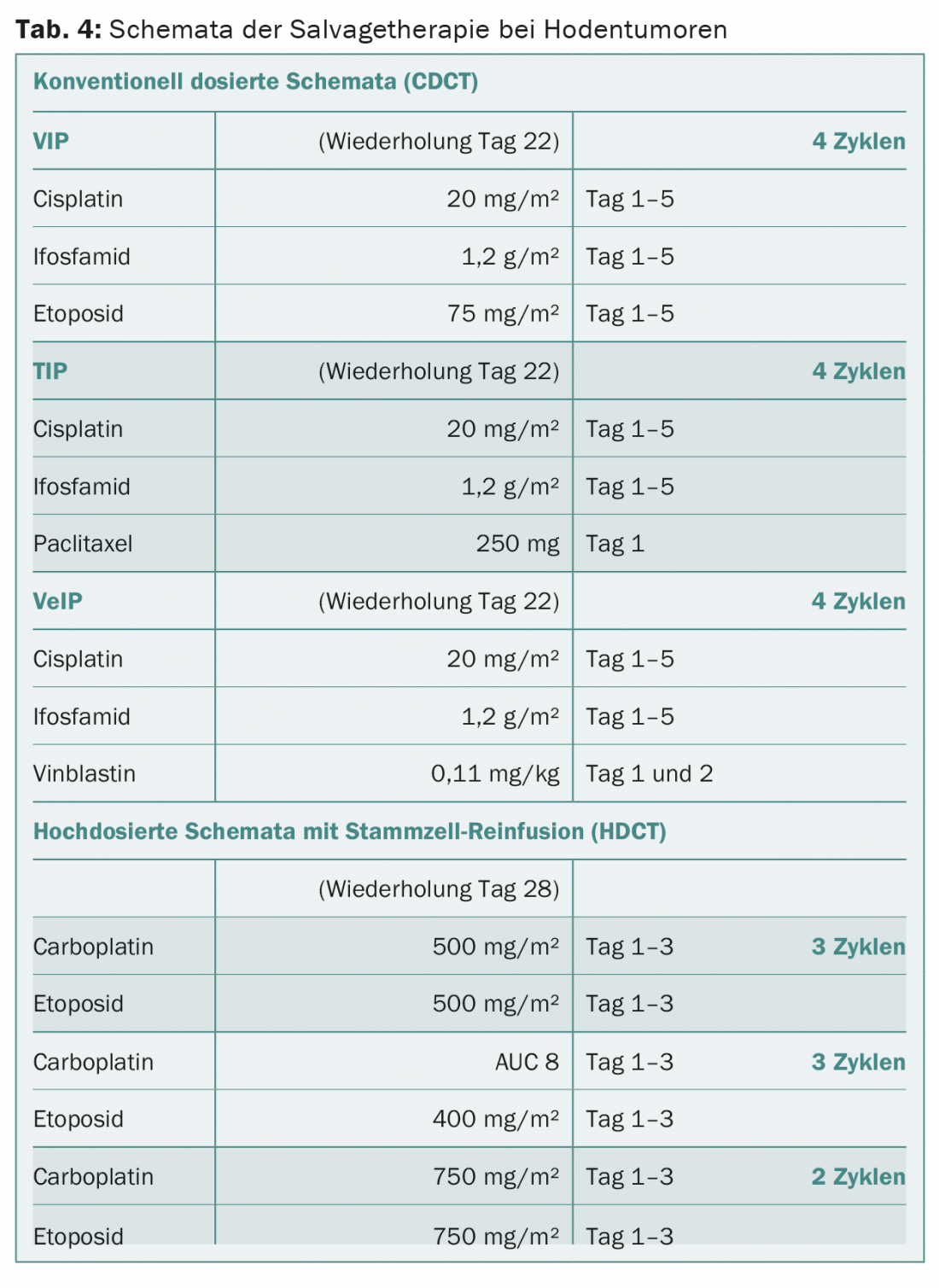
La quimioterapia de recidiva mucho más intensiva (sinónimo de “quimioterapia de rescate”) sigue estando limitada a los pacientes con metástasis que responden mal a la quimioterapia primaria y no consiguen una remisión completa de su enfermedad o que recaen de una remisión completa tras la quimioterapia primaria. Existen dos estrategias de tratamiento principales: dosis convencionales de quimioterapia o altas dosis de quimioterapia (Tab. 4) . La mejor estrategia de salvamento se determina de forma individual.
Recaídas tardías
Las recaídas tardías más de dos años después de la quimioterapia primaria son raras. Siempre que sea posible, debe realizarse principalmente la resección completa de la recidiva tardía. El procedimiento posterior depende del resultado quirúrgico y de los hallazgos histológicos.
Terapia paliativa
La terapia paliativa sólo es necesaria en un pequeño número de pacientes. Los fármacos citostáticos bien documentados y eficaces en la situación paliativa son la gemcitabina, el oxaliplatino y el paclitaxel, tanto como sustancias únicas como formando parte de terapias combinadas. La radioterapia paliativa o la “cirugía desesperada” pueden estar indicadas para pacientes individuales.
Plan de cuidados de supervivencia
Los pacientes con remisión completa reciben una última consulta tras el final de la terapia, durante la cual se elabora un plan de cuidados de supervivencia que incluye los puntos enumerados en la tabla 5.

Los cuidados de seguimiento se proporcionan de acuerdo con las directrices elaboradas por Cathomas et al. esquemas de seguimiento publicados [5]. Con el consentimiento de las personas afectadas, los resultados de los exámenes se incluyen en el registro de seguimiento. Esto implica que el diagnóstico por TC ya no se realiza en el seguimiento rutinario de los pacientes dos años después de finalizar el tratamiento.
Para más información: www.hodenkrebs.de
Literatura:
- Beyer J, et al: Mantener el éxito, reducir la carga del tratamiento, centrarse en la supervivencia: aspectos destacados de la tercera conferencia europea de consenso sobre el diagnóstico y el tratamiento del cáncer de células germinales. Anales de Oncología 2013; 24: 878-888.
- Clasificación Internacional del Consenso de Células Germinales: Un sistema de estadificación basado en factores pronósticos para los cánceres metastásicos de células germinales. Grupo de colaboración internacional sobre el cáncer de células germinales. J Clin Oncol 1997; 15: 594-603.
- www.sakk.ch
- Fizazi K, et al: Quimioterapia personalizada basada en la disminución de marcadores tumorales en tumores de células germinales de mal pronóstico (GETUG 13): ensayo aleatorizado multicéntrico de fase 3. Lancet Oncol 2014; 15: 1442-1450.
- Cathomas R, et al.: Recomendaciones interdisciplinarias basadas en la evidencia para el seguimiento de pacientes con cáncer testicular: un esfuerzo conjunto. Swiss Medical Weekly 2010; 140: 356-369.
InFo ONCOLOGÍA Y HEMATOLOGÍA 2016; 4(1): 34-37











