Durante mucho tiempo, el tratamiento del lupus se caracterizó por el estancamiento. Sin embargo, tras 20 años de frustración, por fin vuelve a haber movimiento en el desarrollo de nuevas opciones terapéuticas. Los estudios han arrojado resultados prometedores para tres agentes específicos para el tratamiento de la nefritis lúpica. El viejo principio de inducción y conservación ha tenido por fin su momento.
Como ocurre con todas las enfermedades genéticas, existen formas monogenéticas de lupus eritematoso sistémico (LES). Pero por cada paciente que tiene una mutación tan mala, hay otros 1000 que tienen variantes menores. Por ejemplo, no carecen de toda la proteína, sino de un solo dominio, lo que significa que tienen un curso mucho más leve de la enfermedad. Los pacientes con lupus suelen tener variantes genéticas no sólo en un gen, sino en muchos, y entonces en última instancia es la suma de las pequeñas cosas lo que define esta enfermedad.
Esta constelación es diferente para cada paciente individual. En cuanto a la nefritis lúpica (NL), las variantes genéticas también afectan al riñón, lo que puede provocar, por ejemplo, debilidad de la membrana basal (los pacientes desarrollan rápidamente hematuria), debilidad endotelial (que da lugar a complicaciones vasculares) o debilidad podocitaria (proteinuria, síndrome nefrótico). El inicio, la clase y el pronóstico de la NL están determinados genéticamente. El diagnóstico genético es especialmente útil en casos con antecedentes familiares, LES infantil y casos atípicos/sindrómicos.
La suposición generalizada de que el lupus es una enfermedad que se presenta en recaídas puede rechazarse, al menos en el caso de la nefritis lúpica, explicó el Prof. Dr. Hans-Joachim Anders, del Centro de Nefrología de la LMU de Múnich [1]: “No hay recaídas de la NL, siempre hay sólo personas que no cumplen su terapia o lo hacen de forma inadecuada. O cuando el médico y el paciente han decidido reducir la dosis – y entonces la enfermedad vuelve a empezar en algún momento porque la terapia no ha sido suficiente. Pero es una enfermedad crónica que persiste permanentemente”. Por lo tanto, hay que encontrar la dosis de medicación que sea suficiente y atenerse a ella.
No LN sin ERC
La proteinuria es siempre también un indicio de enfermedad renal, recordó el nefrólogo. “Si tiene proteína positiva en la tira reactiva, casi siempre significa que hay daño podocitario”. Los podocitos son las células de la barrera de filtración en los glomérulos que son especialmente sensibles, y cuando se dañan (inmunológica, tóxica o genéticamente) se produce proteinuria. Por este motivo, la detección de proteinuria en la tira reactiva de orina es siempre un signo de enfermedad renal. “No es necesario enviar al paciente a un urólogo, no hay ninguna enfermedad en urología que explique la proteinuria”. Más bien, el nefrólogo es la persona de contacto adecuada en tal caso. La hematuria, por su parte, puede producirse a veces en enfermedades urológicas, pero por supuesto también se da en enfermedades renales. En concreto, la combinación de hematuria y proteinuria en realidad sólo puede explicarse por una enfermedad renal. “A esto se le suele llamar entonces síndrome nefrítico, y es especialmente frecuente en el lupus”.
Sin embargo, la hematuria permite concluir que debe haberse roto una membrana basal, porque de lo contrario los eritrocitos no la atravesarían. A este respecto, la sangre en la orina es siempre un signo de rotura de la membrana basal, y si se produce junto con proteinuria, probablemente de los glomérulos, lo que hace probable un fondo inmunológico en el lupus. Las directrices establecen que los pacientes con proteinuria superior a 500 miligramos al día deben someterse a una biopsia renal. A continuación, la biopsia se evalúa mediante una puntuación que ya tiene casi 20 años, y que el Prof. Anders criticó. Existen iniciativas para una actualización, pero aún no hay nada concreto.

Importante: Todo paciente que padezca nefritis lúpica tiene, por definición, una enfermedad renal crónica (ERC). “Es entonces cuando el nefrólogo debe intervenir en algún momento y no sólo cuando pasa a diálisis”. La NL siempre está presente durante más de tres meses, lo que la convierte en crónica. Existen 5 estadios diferentes: Si la función renal sigue estando bien, es muy posible que la NL se encuentre en el estadio 1, pero en cualquier caso sigue siendo una enfermedad renal crónica. La enfermedad renal también significa que las nefronas se pierden más rápidamente que a través del proceso normal de envejecimiento. Esto acorta la vida útil de los riñones. “Y como todos mis pacientes quieren vivir al menos hasta los 90 años, ya les aprieta la espalda”, advirtió el experto. También recordó que aunque las tasas a 10 ó 15 años suenan bien para la profesión médica, no interesan a las mujeres de 25 años, que no quieren someterse a diálisis ni siquiera a los 40 años. En este sentido, hay que luchar por las nefronas de los pacientes mucho antes de que suba la creatinina. Cuando esto ocurre, ya se ha perdido la mitad de las nefronas.
Mantenga la cortisona a fuego lento
El profesor Anders se refirió al término “nefritis lúpica refractaria” como un cuento de viejas. Es cierto que ya hay pacientes que tienen un lupus difícil de controlar inmunológicamente. Sin embargo, su recomendación fue utilizar la terapia estándar (pulsos de esteroides más terapia IS de primera línea) en estos casos, a la que responden la mayoría de los pacientes. Las directrices dicen que primero se utilice ciclofosfamida o MMF para la NL y si eso no funciona se cambie, pero “eso no tiene ningún sentido”. El experto lo comparó con la administración de un antibiótico en caso de infección, que no se sustituye por ningún otro antibiótico si no hay respuesta. Aquí, como allí, hay que plantearse un nuevo diagnóstico, quizá una citología. “Así que si el paciente no responde a la terapia de primera línea, hable con un centro o haga una biopsia, un diagnóstico genético, un perfil inmunológico”. Y sobre todo: compruebe la falta de adherencia ahora que el MMF se utiliza cada vez más por vía oral.
Cómo aumentar la adherencia – en general, como médico debe hablar mucho con el paciente (al menos 1 asesoramiento Std.): La patogénesis (infección, herencia), la toma de la píldora, las vacunas, los factores de riesgo cardiovascular, la reducción de la ansiedad y la evitación de “abracadabras” como los médicos alternativos o el uso de piedras calientes deben discutirse en detalle y explicarse. La adherencia también puede garantizarse a través de la autorresponsabilidad y la autoprotección: la protección solar (al menos de fuerza 50) ya en abril forma definitivamente parte de ello. La hidroxicloroquina puede utilizarse en todos los pacientes, pero no la cortisona oral >5 mg (o el belimumab). La llamada “recaída” -que, como ya se ha explicado, no existe- ya no se trata por vía oral con 20 mg de cortisona, como se hacía antes. En su lugar, hoy en día sólo se administra 3 veces 250 mg de terapia de pulso con metilprednisolona durante un periodo de 3 días. Después, se continúa con la dosis normal de mantenimiento, de lo contrario la exposición a la cortisona es demasiado elevada. Sin embargo, no debe suspenderse el último mg de cortisona, aconsejó el experto. “De lo contrario, un tercio de los pacientes recaerán. El lupus es una enfermedad permanente, lo que significa que hay que aplicar una terapia de forma permanente. 2-4 mg de cortisona a largo plazo no suponen una gran diferencia.
La hidroxicloroquina debe reducirse en un 50% si la función renal se deteriora, pero afortunadamente sólo a partir de una TFGe de 20 ml/min (las directrices recomiendan a partir de 30 ml/min).
Crema solar para la autoprotección
Desde el punto de vista terapéutico, no se puede cambiar nada del problema de base, la constitución genética. Sólo la prevención de la muerte celular es posible. Ante todo, eso significa ponerse protección solar. Esto se debe a que las quemaduras solares provocan regularmente la liberación de grandes cantidades de material nuclear, lo que puede desencadenar una oleada. Por lo tanto, se recomienda una protección solar cuidadosa a todos los pacientes con lupus.
El rituximab no se ha impuesto realmente como opción para la inmunosupresión. Los estudios muestran que los pacientes gravemente enfermos parecen beneficiarse, pero en relación con todos los grupos de pacientes el valor p no es lo suficientemente bueno, por lo que todos los estudios hasta ahora son negativos. Por otro lado, un depletor de células B mucho más potente que el rituximab es el obinutuzumab (OBI), que elimina todas las células B en pocos días, por lo que es más potente. El obinutuzumab está aprobado para la esclerosis múltiple, y el ensayo de fase 2 NOBILITY ha demostrado ahora también su eficacia en la NL. Se demostró un tamaño del efecto del 22% en todos los pacientes con LN comprobado mediante biopsia, lo que correspondió a una duplicación del número de pacientes que lograron una respuesta completa. Fuera de etiqueta, el obinutuzumab ya puede utilizarse.
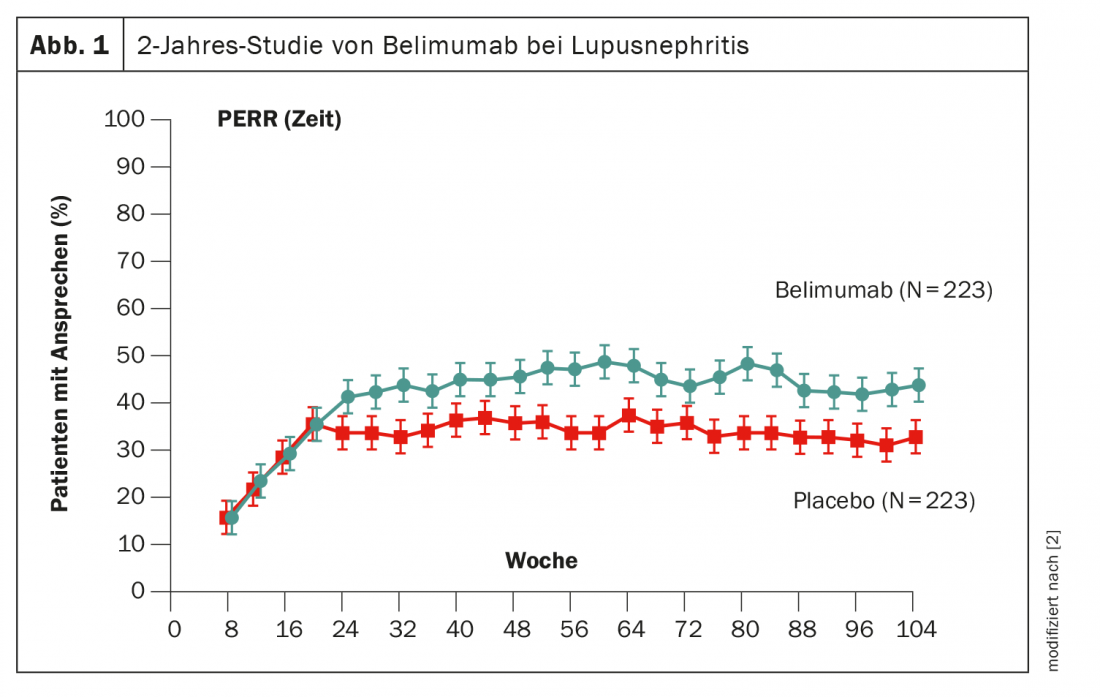
Otra forma de manipular las células B es el belimumab, cuyo uso ya ha sido probado. En el ensayo de fase 3 BLISS, los pacientes recibieron belimumab desde el principio durante 2 años [2]. Después de aproximadamente 6 meses, la ventaja sobre el placebo llegó a ser estadísticamente significativa, aunque el tamaño del efecto del 11% fue menor que con el obinutuzumab (Fig. 1). La sustancia activa ya está aprobada en Suiza.
El tacrolimus es uno de los inmunosupresores que afectan principalmente a la proliferación de las células T. El principio activo ya ha sido objeto de debate en los últimos años, ya que se utiliza en combinación con el MMF en Asia. Sin embargo, no se dispone de datos sobre los europeos. Para la voclosporina, similar al tacrolimus también un inhibidor de la calcineurina, el estudio de fase 3 AURORA ha demostrado su eficacia. El tamaño del efecto tras 52 semanas fue del 18%, el efecto estaba relacionado principalmente con la proteinuria. De nuevo, casi se duplicó el número de casos que lograron una respuesta completa.
Lo que todas estas nuevas opciones terapéuticas tienen en común es que ya no tienen como objetivo la inducción y el mantenimiento, sino que sugieren una terapia combinada a largo plazo desde el principio. “El lupus se reconoce así como una enfermedad autoinmune crónica que también requiere una terapia crónica”, afirmó el Prof. Anders. “Se administra una dosis alta de cortisona al principio y luego se continúa con una terapia permanente. Eso parece funcionar mucho mejor que las viejas ideas de inducción y mantenimiento”.
En el seguimiento, depende mucho de la protinuria: si baja por debajo de 0,8 en el plazo de un año, esto tiene un valor predictivo muy alto para el resultado a largo plazo, por lo que estos pacientes tienen un buen pronóstico a largo plazo. Los que no lo consigan pueden necesitar otro protocolo o una nueva biopsia al cabo de 12 meses. El consejo del Prof. Anders a sus colegas: “Con nosotros, explicamos a todos los pacientes en la primera biopsia que habrá una segunda dentro de un año, para poder ver si la terapia ha funcionado”.
Resumen
- El lupus es una enfermedad poligenética que provoca una pérdida de tolerancia al material nuclear.
- El pronóstico es individual.
- Segunda ronda de diagnósticos si no hay RC
- Terapéutica CYC/MMF y AZA/MMF, nuevas opciones terapéuticas llegarán/ya están disponibles (obinutuzumab, belimumab, voclosporina).
- Para el seguimiento de la nefrología basada en SCr/proteinuria, si el paciente no responde biopsia de control. Si no hay respuesta, considere la posibilidad de ponerse en contacto con un centro de lupus.
– FomF Reumatismo Nefro Actualización (en línea)
Fuentes:
- Conferencia “Síndromes antisintetasa” en el FomF Rheuma Nephro Refresher (en línea), 30.10.2020.
- Furie R, et al: Two-Year, Randomized, Controlled Trial of Belimumab in Lupus Nephritis. N Engl J Med 2020; 383: 1117-1128; doi: 10.1056/NEJMoa2001180.
InFo PAIN & GERIATURE 2020; 2(2): 28-30 (publicado el 7.12.20, antes de impresión).