Cada vez se conocen mejor los patomecanismos de la dermatitis atópica (DA). Un desequilibrio inmunológico determinado genéticamente se caracteriza por un aumento de la respuesta Th2 y se asocia a la producción de citoquinas inflamatorias como la interleucina (IL)-4 y la IL-13. También hay otras moléculas que desempeñan un papel importante en el proceso inflamatorio. El panorama terapéutico está cambiando. Dos productos biológicos y tres inhibidores de la cinasa Janus están autorizados actualmente en el área de indicación de la EA en Suiza y hay más en desarrollo.
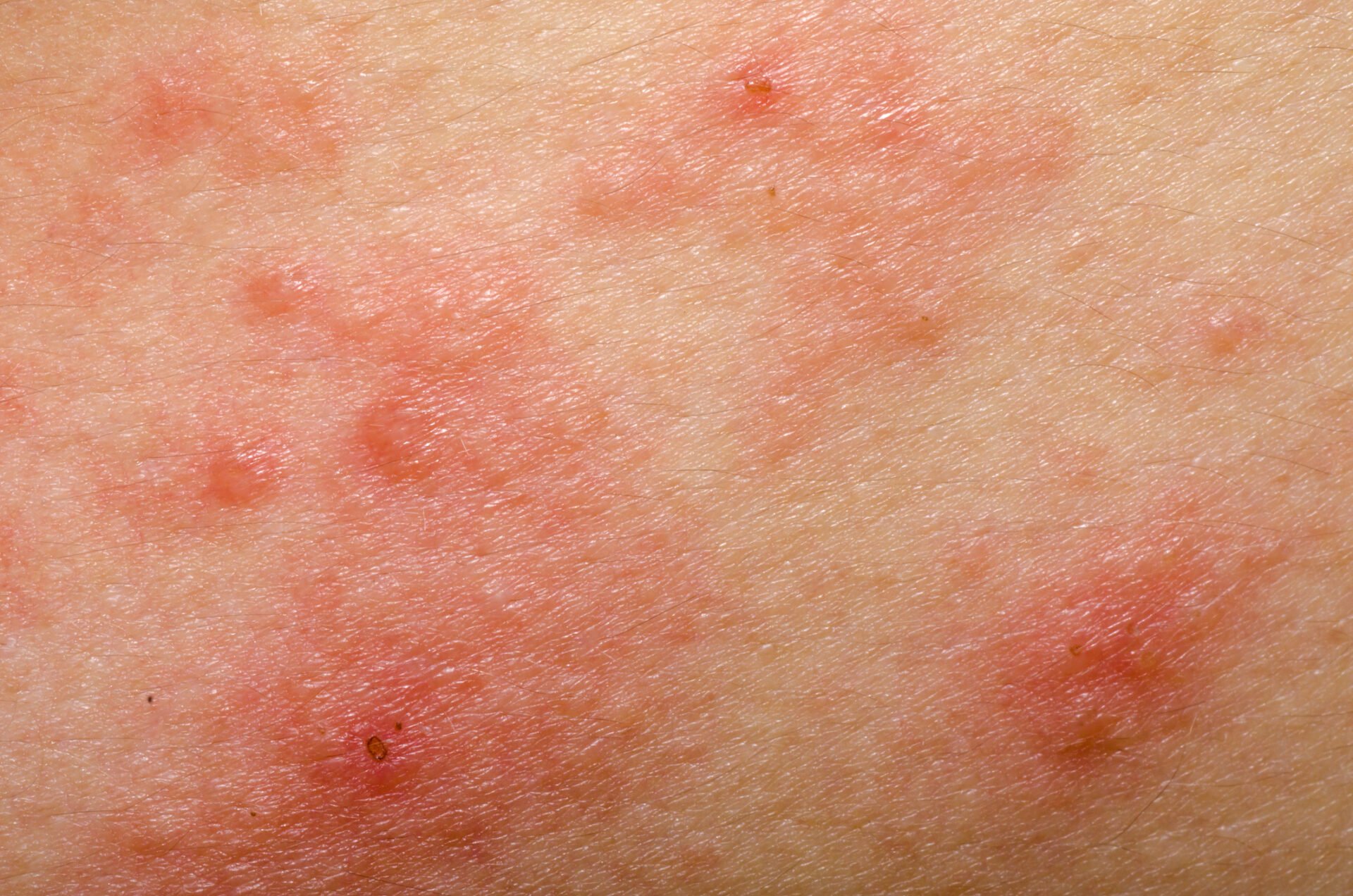
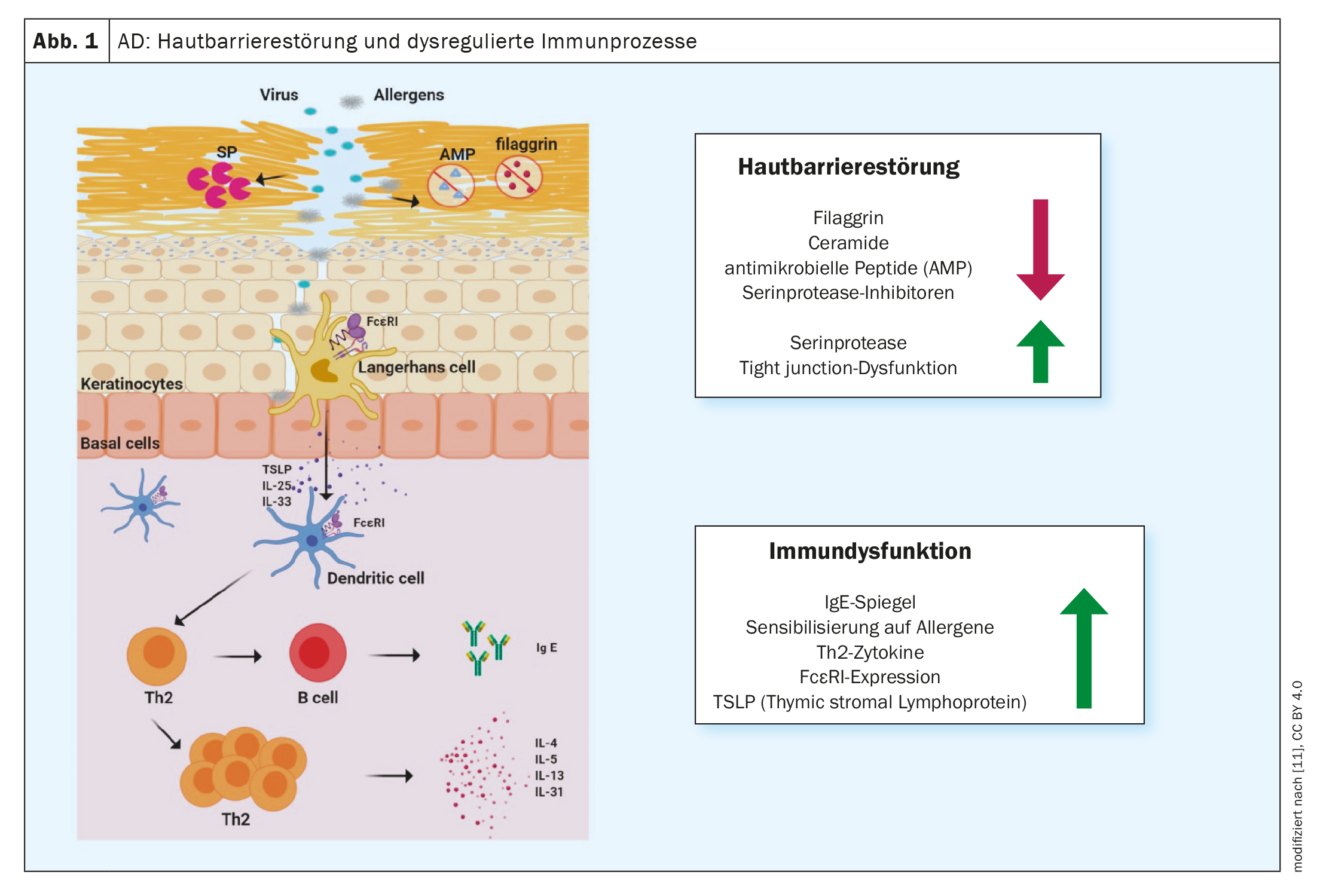
La inflamación de tipo 2 es una causa común de diversas enfermedades alérgicas, como la dermatitis atópica (DA), el asma bronquial, la rinosinusitis crónica, la esofagitis eosinofílica y la rinitis alérgica [1]. Cada vez se desarrollan métodos de tratamiento más eficaces en la lucha contra las enfermedades alérgicas. Los anticuerpos monoclonales y los inhibidores de la Janus quinasa (JAK) han contribuido significativamente a mejorar las opciones de tratamiento, destacó el Prof. Dr. Peter Schmid-Grendelmeier, experto en alergias de la Clínica Dermatológica del Hospital Universitario de Zúrich, en el congreso anual de la Sociedad Suiza de Alergología e Inmunología [2]. Este alentador desarrollo fue precedido por una intensa investigación de los procesos fisiopatológicos. Ahora se sabe que una respuesta inmunitaria dominante de T helper (TH)2 está asociada a la secreción de citoquinas como la interleucina (IL)-4, la IL-5 y la IL-13 (Fig. 1). Este entorno inflamatorio no sólo promueve la generación, maduración y activación de los granulocitos eosinófilos y basófilos, sino también la activación de los mastocitos [3].
Base molecular de las reacciones inmunitarias de tipo 2
En algunos casos, las enfermedades alérgicas también se presentan de forma comórbida; por ejemplo, hay pacientes que padecen asma grave o DA y también sufren rinitis alérgica. Estas comorbilidades pueden aumentar aún más la carga de la enfermedad. La inflamación de tipo 2 está mantenida por TH2, células linfoides innatas de tipo 2 (ILC2) y mediadores del sistema inmunitario innato y adaptativo [1]. Los estudios empíricos demuestran que el 58-79% de todos los pacientes adultos con EA padecen al menos otra enfermedad atópica, independientemente de su gravedad [4–6].
Las respuestas inmunitarias de tipo 2 son el correlato celular de la inflamación cutánea en la EA y también influyen significativamente en la función de barrera y la disbiosis microbiana [7]. “Ahora sabemos mucho sobre la dermatitis atópica”, resumió el ponente. Hace unos años esto era simplemente “bueno saberlo”, pero entretanto la creciente comprensión de las relaciones fisiopatológicas ha dado lugar a varias opciones terapéuticas inmunomoduladoras innovadoras. A diferencia de los biológicos, los inhibidores de la Janus quinasa (JAK) no interceptan las señales de las citocinas en el espacio extracelular, sino intracelularmente.
Biológicos e inhibidores de JAK en aumento
El primer biológico aprobado en la indicación de la EA fue el dupilumab (Dupixent®) en 2019. Se trata de un anticuerpo monoclonal dirigido contra la subunidad α del receptor de la IL-4, que bloquea la señalización de los mediadores inflamatorios IL-4 e IL-13 [8,9]. Este enfoque terapéutico ha demostrado ser muy eficaz, según la profesora Schmid-Grendelmeier. El tralokinumab (Adtralza®), otro biológico que neutraliza específicamente la IL-13, está disponible para los pacientes con EA desde 2022 [8]. Aunque actualmente se dispone de menos pruebas en el mundo real en comparación con el dupilumab, las pruebas de eficacia hasta la fecha han sido muy convincentes.
Los inhibidores de JAK representan otro enfoque terapéutico prometedor. En Suiza, tres inhibidores de JAK -baricitinib (Olumiant®), abrocitinib (Cibinqo®) y upadacitinib (Rinvoq®)- han superado recientemente los obstáculos de autorización en la indicación de EA [8]. Los inhibidores de JAK ejercen su efecto a través del mecanismo intracelular JAK-STAT.
| Como anticuerpos o proteínas de fusión, los biológicos bloquean una única citocina extracelularmente o un receptor de citocina o una molécula de superficie de la célula, mientras que las JAK-i actúan intracelularmente y modulan varias citocinas. A diferencia de los biológicos, el objetivo del JAK-i es reducir de forma reversible la actividad de una o más isoformas JAK, de forma similar a como se baja un termostato. El efecto es, por tanto, más amplio y menos específico. |
| a [12] |
Decisión terapéutica basada en criterios
“Un biológico se dirige a una o dos citocinas y las bloquea más o menos completamente. Un JAK-i, en cambio, reduce varias citocinas con afinidades diferentes. Ambos enfoques tienen sus pros y sus contras”, explicó la profesora Schmid-Grendelmeier [2]. La elección de la opción de tratamiento debe adaptarse individualmente al paciente, teniendo en cuenta aspectos como las enfermedades concomitantes, el estado de la infección y la edad. Los factores situacionales también pueden desempeñar un papel en estas consideraciones; por ejemplo, el JAK-i tiende a tener un inicio de acción más rápido pero, a diferencia de los biológicos, requiere un cribado y un seguimiento de laboratorio relativamente amplios en paralelo a la terapia [10]. Otra diferencia importante para la vida cotidiana de los pacientes se refiere a la forma de administración: el baricitinib, el abrocitinib y el upadacitinib se toman por vía oral en forma de comprimidos una vez al día, mientras que los biológicos dupilumab y tralokinumab se administran como inyecciones a intervalos de unas semanas o meses. La ampliación del espectro terapéutico de la EA se refleja ahora también en la versión actualizada de la directriz S3. Aunque el dupilumab ya estaba incluido en la versión anterior de la directriz, ahora también lo están el tralokinumab, el abrocitinib, el baricitinib y el upadacitinib [9].
Conclusión y perspectivas
Para los pacientes con un alto grado de gravedad de la EA, las nuevas opciones de tratamiento representan un gran avance, según el ponente [2]. Pero aún queda mucho por investigar. En Suiza, el dupilumab es hasta ahora el único representante del grupo de terapéuticos sistémicos más recientes (biológicos, JAK-i) que ha recibido una ampliación de indicación para pacientes pediátricos con EA a partir de 6 años. El tralokinumab está autorizado en Suiza a partir de los 18 años y en la UE a partir de los 12 años. En el caso del JAK-i, la autorización se ha limitado hasta ahora a pacientes adultos. Pero esto podría cambiar en un futuro no muy lejano, sobre todo porque actualmente se está investigando el uso de varios biológicos y JAK-i en pacientes pediátricos con EA.
Además, actualmente se están investigando otras sustancias activas con nuevos objetivos. El lebrikizumab, el nemolizumab, el tezelumab y el Ox-40-Ak han demostrado hasta ahora ser fármacos candidatos prometedores [2]. El lebrikizumab se une específicamente a la IL-13 que circula libremente y el nemolizumab bloquea la subunidad α del receptor de la IL-31. El tezelumab es un anticuerpo contra la TSLP (linfoproteína del estroma tímico) y el Ox-40 es un receptor costimulador de las células T activadas.
Para los pacientes con EA de moderada a grave, la ampliación de las opciones de tratamiento ofrece mejores posibilidades de recuperación, siempre que se disponga de acceso a las terapias. Los cuidados básicos con emolientes y la educación del paciente siguen siendo pilares importantes del tratamiento de la EA de cualquier gravedad [2]. Los pacientes reciben mucha información valiosa y consejos sobre el manejo de la enfermedad durante las sesiones de formación sobre dermatitis atópica.
Congreso: Sociedad Suiza de Alergología e Inmunología (SSAI), Congreso anual
Literatura:
- Klimek L, et al: Inflamación tipo 2: el valor de los diferentes biológicos en la práctica. Dtsch Arztebl 2021; 118(50): [20]; DOI: 10.3238/PersPneumo.2021.12.17.05
- “Nuevos conceptos en alergia”, Prof. Dr. Peter Schmid-Grendelmeier, Congreso anual de la SSAI, 24-25 de agosto de 2023.
- Kühn M, et al: Respuesta inmunitaria TH2: significado e influencia terapéutica. Swiss Med Forum 2021; 21(0102): 13-17.
- Weidinger S, et al: Dermatitis atópica. Nat Rev Dis Primers 2018; 4(1): 2.
- Chiesa Fuxench ZC, Ong P: Póster presentado en la AAD 2018. Póster 6236.
- Drucker AM, et al: La carga de la dermatitis atópica: resumen de un informe para la National Eczema Association. J Invest Dermatol 2017; 137(1): 26-30.
- Lauffer F, Biedermann T: Eccema atópico: Un fuego inquietante para una relación triangular. Dtsch Arztebl 2021; 118(24): [24]; DOI: 10.3238/PersDerma.2021.06.18.04
- Swissmedic: Información sobre medicamentos, www.swissmedicinfo.ch,(último acceso 15.11.2023)
- Directriz S3 “Dermatitis atópica”, nº de registro AWMF: 013-027, a 17/06/2023.
- Worm M, et al: Terapia moderna de la dermatitis atópica: fármacos biológicos y de moléculas pequeñas. JDDG 2020; 18(10): 1085-1093.
- Yang G, et al: Anomalías de la barrera cutánea y disfunción inmunitaria en la dermatitis atópica. Revista Internacional de Ciencias Moleculares 2020; 21(8): 2867.
www.mdpi.com/1422-0067/21/8/2867,(última consulta: 15 de noviembre de 2023) - Choy EH: Importancia clínica de la selectividad de los inhibidores de la cinasa Janus. Reumatología (Oxford) 2019; 58(6): 953-962.
DERMATOLOGIE PRAXIS 2023; 33(6): 22-23 (publicado el 12.12.23, antes de impresión)