El intestino humano alberga todo un ecosistema de bacterias, hongos, virus y otros microorganismos. Con un peso de hasta dos kilogramos, esta biocoenosis es prácticamente un órgano dentro de un órgano – y como tal es capaz de influir en la salud de “su” ser humano. Nuevas investigaciones asignan también un papel al microbioma en el desarrollo de las enfermedades reumáticas inflamatorias, según la Sociedad Alemana de Reumatología (DGRh).
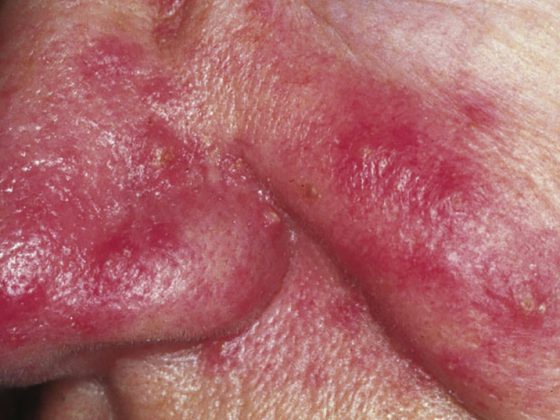
Una de las enfermedades en las que se ha estudiado con más detalle el papel del microbioma es el lupus eritematoso sistémico (LES). “Se trata de una enfermedad reumática inflamatoria autoinmune en la que el sistema inmunitario del organismo se vuelve contra los componentes del núcleo celular en particular”, explica el profesor Andreas Krause, MD, presidente de la DGRh y médico jefe del Hospital Immanuel de Berlín. Dado que estos componentes básicos se encuentran en todo el organismo, la inflamación típica del LES puede manifestarse en todos los órganos. La piel, las articulaciones y los riñones se ven afectados con especial frecuencia. Sin embargo, los síntomas y los patrones de infestación difieren de un paciente a otro y también pueden cambiar a lo largo de la enfermedad crónica.
¿El microbioma como factor desencadenante del LES?
Aunque existen factores genéticos que aumentan la susceptibilidad al LES, éstos no son suficientes para explicar la enfermedad. “No todas las personas con la predisposición genética correspondiente desarrollan también LES”, afirma Krause. Aquí, la composición individual del microbioma podría entrar en juego como un factor que ayuda a decidir el inicio y el curso de la enfermedad. En los últimos años, se han identificado una serie de posibles patógenos, bacterias nocivas que podrían ser responsables de la influencia negativa del microbioma en el desarrollo y la progresión de las enfermedades. Entre ellos se incluyen ciertos enterococos y lactobacilos que pueden atravesar la pared intestinal en pacientes con una barrera mucosa dañada, migrar a otros órganos y causar inflamación en ellos. Las llamadas clostridiales aparentemente contrarrestan esto. Estas bacterias del colon parecen ser indispensables para un buen funcionamiento de la barrera mucosa. Producen importantes ácidos grasos de cadena corta que ayudan a las células mucosas del intestino a producir mucosidad, refuerzan la barrera intestinal y contribuyen a crear un entorno ácido favorable. “En un subgrupo de pacientes con LES, ya se ha demostrado que se pierden clostridiales mientras que proliferan los lactobacilos”, afirma el profesor Martin A. Kriegel, del Departamento de Reumatología e Inmunología Traslacional del Instituto de Medicina Musculoesquelética (IMM) del Hospital Universitario de Münster, que investiga en este campo.
Otro mecanismo que podría desencadenar los procesos autoinmunes típicos de las enfermedades reumáticas inflamatorias es la llamada reactividad cruzada: los anticuerpos que se formaron originalmente contra las bacterias también reconocen antígenos que se encuentran en los propios tejidos del organismo. Ésta se convierte entonces también en el objetivo de la defensa inmunitaria. Dicha reactividad cruzada se ha demostrado para el autoantígeno Ro60, por ejemplo, contra el que se dirigen los ataques autoinmunes en muchos pacientes con LES. Esto se debe a que el Ro60 también es producido por toda una serie de bacterias que se encuentran en el intestino, en la piel y en la boca.
Enfoques terapéuticos a partir de la investigación del microbioma
“Estos mecanismos están ahora bien respaldados por los resultados de la investigación”, afirma Kriegel. En futuros estudios deberá aclararse si los nuevos hallazgos pueden utilizarse también con fines terapéuticos. Los posibles puntos de partida son, por un lado, las vacunas o los fármacos contra los patógenos nocivos, pero también una influencia dirigida sobre el microbioma a través de la nutrición. “En el caso concreto del lupus, una dieta rica en fibra parece proteger la barrera intestinal, impidiendo que las bacterias nocivas se propaguen a otros órganos”, afirma Krause. Estos efectos, que hasta ahora sólo se han observado en ratones, hacen albergar la esperanza de que los procesos autoinmunes también puedan verse influidos favorablemente en los seres humanos mediante una nutrición adecuada.
Publicación original:
Redanz, S., Kriegel, M.A. El papel del microbioma en el lupus y el síndrome antifosfolípido. Z Rheumatol (2022). https://doi.org/10.1007/s00393-022-01184-7