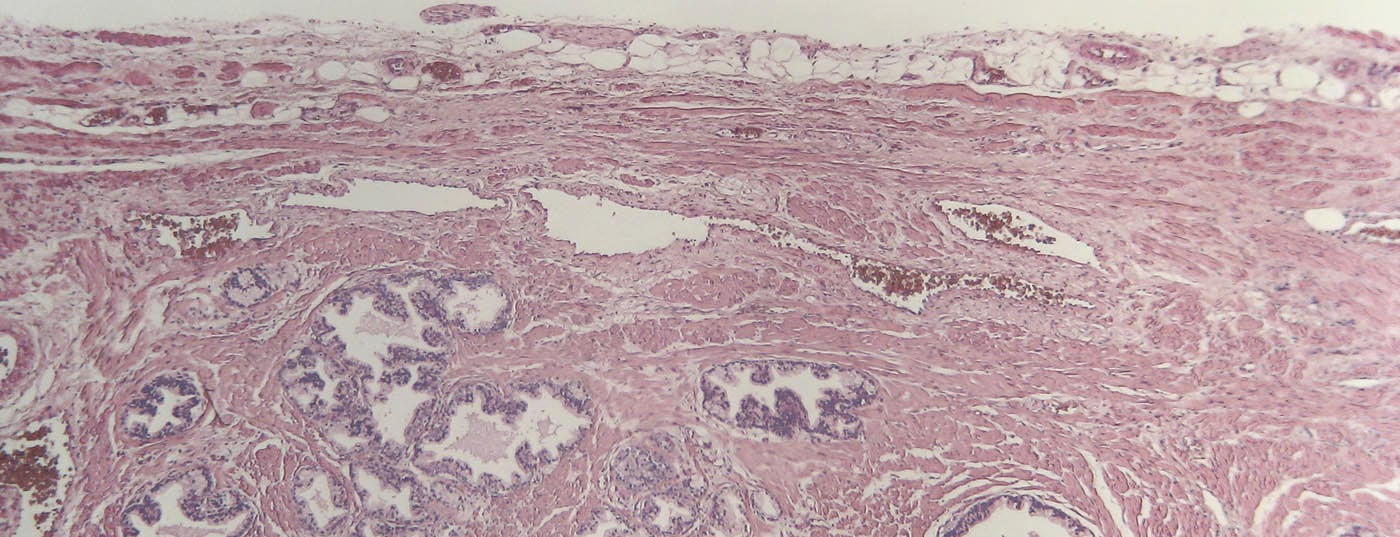
El aumento significativo de agentes terapéuticos disponibles para el CPRC es alentador. El objetivo de cualquier terapia debe ser mantener la calidad de vida con una reducción de las complicaciones específicas del tumor. Debido a la complejidad y a la falta de datos comparativos, las directrices actuales de la EAU recomiendan en general un enfoque multidisciplinar para los pacientes con CPRCm y, por tanto, su presentación ante una junta tumoral.
El carcinoma de próstata (CaP) es una entidad tumoral heterogénea que subsume tanto los tumores que no ponen en peligro la vida como aquellos con cursos altamente agresivos y letales. Mientras que los tumores insignificantes se observan mediante vigilancia activa, para las formas localizadas se lleva a cabo un procedimiento activo como la cirugía radical o la radioterapia [1,2]. Más problemáticos desde el punto de vista terapéutico son los tumores agresivos (recidivantes), que cambian dinámicamente desde el momento del diagnóstico hasta la muerte tumoral en función de la clínica (localizado frente a localmente avanzado), el estado hormonal (sensible a la castración frente a -refractario) y la presencia de metástasis (M0 frente a M+) [3].
Del CaP hormonal al CPRC
Entre uno y tres años después del inicio de la terapia antihormonal (TAD), la resistencia a la terapia se desarrolla con la progresión del tumor. En este punto, el eje hormonal sigue teniendo una importancia central [4], razón por la cual se realizó un cambio de nombre: “refractario a las hormonas” se convirtió en CaP “refractario a la castración” (CPRC) [1]. Según la Asociación Europea de Urología, existe CPRC si el nivel de testosterona está al nivel de castración, el nivel de PSA aumenta tres veces con un intervalo de al menos una semana, con dos niveles al menos un 50% por encima del nadir, y el nivel máximo es de >2 ng/ml – o en caso de aparición de más de dos nuevas lesiones óseas y la progresión de una lesión de tejidos blandos [2].
El CPRC se considera una enfermedad terminal altamente agresiva y no curable, con un alto riesgo de complicaciones tumorales específicas y de muerte relacionada con el tumor. El reto terapéutico reside en los complejos cambios moleculares que se producen cuando se pasa de un tumor sensible a la castración a un tumor refractario, incluidos los cambios dependientes e independientes del receptor de andrógenos (RA).
Cambios dependientes del RA
Hipersensibilidad a los andrógenos/amplificación del AR: El aumento de las tasas de transcripción del ARNm y la mejora de la estabilización del ARNm y de las proteínas conducen a una mayor amplificación del AR y, por tanto, a una ventaja de supervivencia por selección [5,6].
Síntesis intracrina de andrógenos: Autoabastecimiento de andrógenos mediante el aumento de la conversión de testosterona en DHT (a través del aumento de la concentración de 5-α-reductasa). Las líneas celulares de CPRC son capaces de sintetizar andrógenos a partir, por ejemplo, del colesterol mediante una mayor expresión de todos los genes de síntesis [7,8].
Activación del RA independiente del ligando: Las mutaciones aumentan la capacidad de activar los andrógenos suprarrenales, el estrógeno, el cortisol e incluso los antagonistas del RA. Las mutaciones del sitio de unión de los correguladores y las variantes de empalme del RA (RA 3, 4 y 5) pueden incluso conducir a la activación del RA sin ningún ligando en absoluto [9–11].
Activación del RA por factores de crecimiento, citoquinas y tirosina quinasas receptoras: Los factores de crecimiento (IGF-1, EGF) o las citoquinas (IL6) activan el RA y otras vías oncogénicas como RAS, RAF o MAPK y, por tanto, el crecimiento tumoral. Las tirosina quinasas como ERBB2 también activan el RA a través de MAPK y PI3K/AKT [12].
Cambios independientes de AR
Sobreexpresión y activación de proteínas antiapoptóticas: BCL2, Clusterin, Hsp27 y TP53INP1 bloquean y eluden los estímulos apoptóticos generados por la privación de andrógenos [12–15].
Mutación/desactivación de genes supresores de tumores (PTEN, RB, p53): La pérdida de PTEN conduce a la activación del RA a través de la vía PI3K/AKT y a través de ésta también a efectos independientes del RA como la reducción de la apoptosis y del crecimiento celular. Las mutaciones de RB1/p53 provocan una proliferación celular ab- e independientemente del RA [12,16,17].
MicroARNs (miARNs): Para los OncomiRs miR-221/222, se describió una regulación al alza que se correlaciona inversamente con la expresión del inhibidor del ciclo celular p27. Se ha demostrado que miR-21, -141 y -221/222 regulan directa e indirectamente el RA, como lo demuestra su efecto sobre el ciclo celular, la apoptosis y la metástasis. La expresión del anti-OncomiR-34 depende del supresor tumoral p53 y provoca la detención del ciclo celular y la apoptosis a través de la regulación a la baja de BCl2 y CyclinD1 [18–21].
Nuevos principios activos para la terapia del CPRC
El objetivo de cualquier terapia en esta fase paliativa es reducir las complicaciones relacionadas con el tumor al tiempo que se mantiene la calidad de vida y se prolonga la supervivencia global. Hasta hace unos años, la quimioterapia con docetaxel era el principal tratamiento disponible. Sin embargo, basándose en los mecanismos de resistencia mencionados, hasta la fecha se han desarrollado varias sustancias nuevas con diferentes objetivos (Fig. 1).
Nuevas sustancias antiandrogénicas
Enzalutamida: La enzalutamida (Xtandi®) es un antagonista oral selectivo del RA que inhibe la activación del RA, la translocación nuclear y la interacción con los genes dependientes de andrógenos. En el ensayo AFFIRM, 1199 pacientes con CPRC con progresión tras docetaxel fueron aleatorizados a tratamiento con enzalutamida (160 mg) o placebo. La supervivencia global mostró un beneficio de 18,4 frente a 13,6 meses (HR 0,63; p<0,0001), lo que corresponde a una reducción del riesgo de mortalidad del 37% [22]. En el ensayo PREVAIL de 1717 pacientes con CPRCm antes de docetaxel, se realizó un análisis provisional tras 540 muertes, que mostró una reducción del 29% de la mortalidad con enzalutamida (HR 0,71; p<0,0001) – así como una reducción del 81% del riesgo de progresión radiográfica o muerte, ambos frente a placebo. Los efectos secundarios fueron principalmente fatiga, diarrea y sofocos [23].
Abiraterona: Como inhibidor del CYP17, la abiraterona (Zytiga®) inhibe la biosíntesis de andrógenos en las glándulas suprarrenales, los testículos y también en las propias células tumorales. El efecto se demostró en dos ensayos de fase III en los que se probó la abiraterona frente al placebo tanto después (COU-AA-301) [24] como antes (COU-AA-302) [25] de la terapia con docetaxel. Tras la quimioterapia, los pacientes con abiraterona mostraron una supervivencia significativamente prolongada de 4,6 meses (HR 0,74). Antes de la quimioterapia, se demostró una mejora significativa de la SLP. El estudio se interrumpió antes de tiempo debido a los datos positivos. Tras un seguimiento de más de cuatro años, se produjo una reducción del riesgo de mortalidad del 19% (34,7 frente a 30,3 meses; HR 0,81; p=0,0033) para el grupo de abiraterona [26].
Quimioterapia
Docetaxel: Docetaxel (Taxotere®) 75 mg/m2 cada tres semanas ha sido el tratamiento estándar para el CPRCm desde el ensayo Tax327. El docetaxel 50 mg/m2 cada quince días tiene menos efectos secundarios, sin ser inferior a la administración cada tres semanas en cuanto al tiempo hasta el fracaso del tratamiento [27,28].
Cabazitaxel: El cabazitaxel (Jevtana®) es un taxano de unión a la tubulina con baja afinidad por la p-glicoproteína (eflujo de fármacos). En el estudio TROPIC se estudiaron 755 hombres con una progresión tras el docetaxel. El cabazitaxel con prednisona (10 mg/día) mostró una prolongación significativa de la supervivencia global de 2,4 meses en comparación con la mitoxantrona. Los principales efectos secundarios son la supresión del mieloma y la diarrea [29].
Radioterapia
Alfaradina, radio223: La alfaradina, radio223, es un emisor alfa con una baja profundidad de penetración (<100 μm) y una vida media de 11,4 días. Se almacena en lugar del calcio y provoca roturas de la doble cadena del ADN en las metástasis óseas. En el ensayo de fase III ALSYMPCA, más de 900 pacientes con CPRCm óseo sintomático que ya habían recibido tratamiento con docetaxel o no eran aptos para recibirlo recibieron seis inyecciones i.v. de Ra223 a intervalos de cuatro semanas o placebo. Esto resultó en un beneficio de supervivencia global para Ra223 del 30%, (HR 0,699; p=0,0022) y un tiempo prolongado hasta el primer SRE del 34% (HR 0,66; p<0,001 [30]).
Inmunoterapia
Sipuleucel-T: Se utiliza la leucoféresis para aislar las células mononucleares sanguíneas, que luego se incuban y se reinfunden con una proteína recombinante que contiene fosfatasa ácida específica de la próstata y GM-CSF. En el ensayo pivotal IMPACT, el sipuleucel-T mostró una reducción del 22,5% en el riesgo de mortalidad (HR 0,78; p=0,03) y un aumento significativo de 4,1 meses en la supervivencia [31]. Aunque está aprobado en EE.UU., hay que señalar en este estudio que en el grupo de control no se reinfundieron las células mononucleares de la sangre, lo que posiblemente provocó un debilitamiento del sistema inmunitario.
Terapia ósea
En caso de metástasis ósea, debe administrarse una terapia preventiva con denosumab o bifosfonato. Si es necesario, deben iniciarse terapias adicionales que van desde los analgésicos hasta intervenciones como la radioterapia paliativa o la cirugía para evitar una reducción de la calidad de vida [1].
Secuencia terapéutica
La agresividad del tratamiento debe adaptarse a la situación general individual del paciente, entre otras cosas con el objetivo de mejorar su calidad de vida. La mejor secuencia de las nuevas modalidades terapéuticas no está clara.
Terapia de primera línea del CPRC
El momento óptimo para iniciar la terapia no está claro. El tratamiento está indicado en el CPRCm sintomático, la duplicación rápida de los niveles de PSA (<2 meses) y en presencia de (nuevas) metástasis viscerales [32].
CaP sensible a las hormonas y con metástasis: cabe mencionar brevemente el estudio CHAARTED ( Ensayo aleatorizadode quimioterapia hormonalfrente a ablación androgénicapara la enfermedad extensaen el cáncer de próstata). Actualmente, la ADT es el tratamiento estándar para el cáncer de próstata metastásico pero sensible a las hormonas. Esta norma se comparó en el ensayo CHAARTED con la combinación de ADT más un máximo de seis ciclos de quimioterapia con docetaxel (75 mg/m2, tres veces por semana). Los resultados muestran un beneficio de supervivencia estadísticamente significativo de 17 meses para la SLP y la SG a favor de la quimioterapia-hormonoterapia combinada [33,34].
CPRC asintomático sin metástasis (M0) con aumento del PSA: Se trata de un estadio tumoral poco frecuente (aprox. 5%), lo que plantea la cuestión de si simplemente no se detectaron metástasis con el diagnóstico por imagen actual. En consecuencia, debería realizarse una nueva estadificación; el inicio óptimo de la terapia no está claro. Si es posible, estos pacientes deberían ser incluidos en ensayos actualmente activos.
CPRCm asintomático o mínimamente sintomático sin metástasis viscerales: Pueden considerarse tanto la abiraterona como la enzalutamida (además de la ADT). No existen datos comparativos directos ni recomendaciones para ninguna de las dos sustancias. Se ha observado que los pacientes con una respuesta baja a la ADT (menos de doce meses) presentan una respuesta más pobre a otras terapias antihormonales y, por lo tanto, se recomienda el docetaxel de primera línea en lugar de la abiraterona [35,36].
CPRCm sintomático sin y con metástasis viscerales: La terapia con docetaxel debe iniciarse en pacientes sintomáticos sin metástasis viscerales. En el caso de metástasis predominantemente óseas, puede proseguirse la terapia con alfaradina. Si hay metástasis viscerales, se recomienda la quimioterapia con docetaxel [36].
Secuencia terapéutica/terapia de segunda línea del CPRC
No existen datos claros sobre la secuencia óptima de las distintas sustancias, pero hay hallazgos orientativos que deben tenerse en cuenta.
No existe ningún estudio que compare directamente la abiraterona antes y después de la terapia con docetaxel. Los datos sólo pueden interpolarse a partir de COU-AA-301 y COU-AA-302 y sugieren una mayor eficacia en términos de descenso del valor del PSA para la abiraterona antes de la quimioterapia. Por el contrario, existen datos indirectos de que la terapia previa con abiraterona afecta negativamente a la terapia posterior con docetaxel en términos de descenso del nivel de PSA, pero también de SG. El beneficio para la supervivencia observado en el COU-AA-302 se produjo principalmente en pacientes con poco dolor y PSA ≤114 ng/mL, lo que sugiere una iniciación precoz. Merseburger et al. concluyen que los pacientes sin estas variables deberían empezar más bien con quimioterapia precoz [37]. Para los pacientes con progresión rápida durante o poco después (menos de tres meses) de la terapia con docetaxel, Cathomas et al. recomiendan. más probabilidades de iniciar la quimioterapia de segunda línea con cabazitaxel [32]. Complican las cosas los indicios de resistencia cruzada en el uso de abiraterona y enzalutamida, que implican una respuesta clínicamente más pobre de la administración secundaria respectiva, así como los indicios de resistencia cruzada entre estas sustancias y los taxanos [38].
Biomarcadores, seguimiento y cambio de terapia
En la actualidad, no existen biomarcadores que puedan predecir si los pacientes con CPRCm responderán mejor a la quimioterapia con taxanos o a la terapia hormonal. Queda por ver con emoción hasta qué punto los enfoques actuales, como las células tumorales circulantes, podrían ser útiles. Datos recientes muestran que, por ejemplo, la variante 7 del RA en CTC se asocia con la resistencia a la abiraterona y la enzalutamida [39]. El seguimiento de la terapia mediante el control del valor del PSA es difícil debido a las fluctuaciones descritas del PSA con la medicación moderna o incluso a la falta de respuesta a la alfaradina o a la inmunoterapia. En principio, no debe realizarse un cambio de terapia basándose únicamente en un valor de PSA en aumento, sino sólo si, por ejemplo, se añade una progresión radiológica y/o un empeoramiento de la enfermedad por AZ [35].
Nuevas sustancias
Experimentalmente, se están probando muchas sustancias nuevas que abordan los cambios dependientes e independientes del RA mencionados anteriormente. Su descripción va más allá del alcance de esta revisión, por lo que se remite al resumen “Targeting the adaptive molecular landscape of castration-resistant prostate cancer” [40].
Literatura:
- Heidenreich A, et al: Directrices de la EAU sobre el cáncer de próstata. Parte II: Tratamiento del cáncer de próstata avanzado, recidivante y resistente a la castración. Urología europea 2014; 65(2): 467-479.
- Heidenreich A, et al: EAU guidelines on prostate cancer. part 1: screening, diagnosis, and local treatment with curative intent-update 2013. European Urology 2014; 65(1): 124-137.
- Penning TM: Mecanismos de resistencia a los fármacos dirigidos al eje androgénico en el cáncer de próstata resistente a la castración (CPRC). Revista de bioquímica de esteroides y biología molecular 2015; 153; 105-113.
- Chen CD, et al.: Determinantes moleculares de la resistencia a la terapia antiandrógena. Medicina natural 2004; 10(1): 33-39.
- Edwards J, et al: Amplificaciones genéticas asociadas al desarrollo del cáncer de próstata resistente a las hormonas. Clinical cancer research: an official journal of the American Association for Cancer Research 2003; 9(14): 5271-5281.
- Gregory CW, et al: La estabilización del receptor de andrógenos en el cáncer de próstata recurrente se asocia con hipersensibilidad al andrógeno bajo. Investigación sobre el cáncer 2001; 61(7): 2892-2898.
- Montgomery RB, et al: Mantenimiento de andrógenos intratumorales en el cáncer de próstata metastásico: un mecanismo para el crecimiento tumoral resistente a la castración. Cancer Res 2008; 68(11): 4447-4454.
- Locke JA, et al: Los niveles de andrógenos aumentan por esteroidogénesis de novo intratumoral durante la progresión del cáncer de próstata resistente a la castración. Cancer Res 2008; 68(15): 6407-6415.
- Brooke GN, Bevan CL: El papel de las mutaciones del receptor androgénico en la progresión del cáncer de próstata. Genómica actual 2009; 10(1): 18-25.
- Steinkamp MP, et al.: Las mutaciones del receptor de andrógenos dependientes del tratamiento en el cáncer de próstata explotan múltiples mecanismos para evadir la terapia. Cancer Res 2009; 69(10): 4434-4442.
- Hornberg E, et al.: La expresión de variantes de empalme del receptor de andrógenos en las metástasis óseas del cáncer de próstata se asocia con la resistencia a la castración y la corta supervivencia. PloS one 2011; 6(4): e19059.
- Katsogiannou M, et al: Los rasgos distintivos de los cánceres de próstata resistentes a la castración. Revisiones sobre el tratamiento del cáncer 2015; 41(7): 588-597.
- McDonnell TJ, et al: Expresión del protooncogén bcl-2 en la próstata y su asociación con la aparición del cáncer de próstata independiente de andrógenos. Cancer Res 1992; 52(24): 6940-6944.
- July LV, et al: La expresión de clusterina aumenta significativamente en las células de cáncer de próstata tras la terapia de retirada de andrógenos. La próstata 2002; 50(3): 179-188.
- Rocchi P, et al: El aumento de Hsp27 tras la ablación androgénica facilita la progresión independiente de andrógenos en el cáncer de próstata a través de la supresión de la apoptosis mediada por los transductores de señales y activadores de la transcripción 3. Cancer Res 2005; 65(23): 11083-11093.
- Sarker D, et al.: Dirigirse a la vía PI3K/AKT para el tratamiento del cáncer de próstata. Clinical cancer research: an official journal of the American Association for Cancer Research 2009; 15(15): 4799-4805.
- Burchardt M, et al.: La reducción de la función p53 de tipo salvaje confiere un fenotipo resistente a las hormonas a las células de cáncer de próstata LNCaP. La próstata 2001; 48(4): 225-230.
- Galardi S, et al.: La expresión de miR-221 y miR-222 afecta al potencial de proliferación de las líneas celulares de carcinoma de próstata humano al dirigirse a p27Kip1. The Journal of biological chemistry 2007; 282(32): 23716-23724.
- Mercatelli N, et al.: La inhibición de los altamente expresados miR-221 y miR-222 impide el crecimiento de xenoinjertos de carcinoma de próstata en ratones. PloS one 2008; 3(12): e4029.
- Liu C, et al.: El microARN miR-34a inhibe las células madre del cáncer de próstata y la metástasis mediante la represión directa de CD44. Nature medicine 2011; 17(2): 211-215.
- Spahn M, et al.: La expresión del microARN-221 se reduce progresivamente en el cáncer de próstata agresivo y la metástasis y predice la recurrencia clínica. Revista Internacional del Cáncer 2010; 127(2): 394-403.
- Sternberg CN, et al: Mejora de los resultados en pacientes ancianos con cáncer de próstata metastásico resistente a la castración tratados con el inhibidor del receptor androgénico enzalutamida: resultados del ensayo de fase III AFFIRM. Anales de Oncología: revista oficial de la Sociedad Europea de Oncología Médica/ESMO 2014; 25(2): 429-434.
- Beer TM, et al: Enzalutamida en el cáncer de próstata metastásico antes de la quimioterapia. The New England Journal of Medicine 2014; 371(5): 424-433.
- de Bono JS, et al: Abiraterona y aumento de la supervivencia en el cáncer de próstata metastásico. The New England Journal of Medicine 2011; 364(21): 1995-2005.
- Ryan CJ, et al: Abiraterona en el cáncer de próstata metastásico sin quimioterapia previa. The New England Journal of Medicine 2013; 368(2): 138-148.
- Ryan CJ, et al: Abiraterone acetate plus prednisone versus placebo plus prednisone in chemotherapy-naive men with metastatic castration-resistant prostate cancer (COU-AA-302): final overall survival analysis of a randomised, double-blind, placebo-controlled phase 3 study. The Lancet Oncology 2015; 16(2): 152-160.
- Tannock IF, et al: Docetaxel más prednisona o mitoxantrona más prednisona para el cáncer de próstata avanzado. The New England Journal of Medicine 2004; 351(15): 1502-1512.
- Kellokumpu-Lehtinen PL, et al: Docetaxel cada 2 semanas frente a 3 semanas para tratar el cáncer de próstata avanzado resistente a la castración: un ensayo aleatorizado de fase 3. The Lancet Oncology 2013; 14(2): 117-124.
- de Bono JS, et al: Prednisona más cabazitaxel o mitoxantrona para el cáncer de próstata metastásico resistente a la castración que progresa tras el tratamiento con docetaxel: un ensayo aleatorizado abierto. Lancet 2010; 376(9747): 1147-1154.
- Parker C, et al: El emisor alfa radio-223 y la supervivencia en el cáncer de próstata metastásico. The New England Journal of Medicine 2013; 369(3): 213-223.
- Kantoff PW, et al: Inmunoterapia con sipuleucel-T para el cáncer de próstata resistente a la castración. The New England Journal of Medicine 2010; 363(5): 411-422.
- Cathomas R, Steuber T, Gillessen S: Carcinoma metastásico de próstata: fundamentos de la terapia en 2013. Viena Clin Mag 2013; 16(6): 20-25.
- Fizazi K, Jenkins C, Tannock IF: ¿Debe ser el docetaxel el tratamiento estándar para los pacientes con cáncer de próstata metastásico hormonosensible? A favor y en contra. Anales de Oncología : revista oficial de la Sociedad Europea de Oncología Médica/ESMO 2015; 26(8): 1660-1667.
- Sweeney CJ, Chamberlain D: Perspectivas del E3805: el ensayo CHAARTED. Oncología del futuro 2015; 11(6): 897-899.
- Gillessen S, et al: Manejo de los pacientes con cáncer de próstata avanzado: recomendaciones de la Conferencia de Consenso sobre Cáncer de Próstata Avanzado de St Gallen (APCCC) 2015. Anales de Oncología: revista oficial de la Sociedad Europea de Oncología Médica/ESMO 2015; 26(8): 1589-1604.
- Parker C, et al: Cáncer de próstata: Guías de práctica clínica de la ESMO para el diagnóstico, tratamiento y seguimiento. Anales de Oncología: revista oficial de la Sociedad Europea de Oncología Médica/ESMO 2015.
- Merseburger AS, et al: [Castration resistant prostate cancer 2015]. Urología actual 2015; 46(1): 59-65.
- van Soest RJ, et al: La resistencia cruzada entre los taxanos y los nuevos agentes hormonales abiraterona y enzalutamida puede afectar a la elección de la secuencia de fármacos en el cáncer de próstata metastásico resistente a la castración. Revista Europea del Cáncer 2013; 49(18): 3821-3830.
- Antonarakis ES, et al: AR-V7 y resistencia a la enzalutamida y la abiraterona en el cáncer de próstata. The New England Journal of Medicine 2014; 371(11): 1028-1038.
- Wyatt AW, Gleave ME: Dirigirse al paisaje molecular adaptativo del cáncer de próstata resistente a la castración. Medicina molecular EMBO 2015; 7(7): 878-894.
InFo ONCOLOGÍA Y HEMATOLOGÍA 2015; 3(11-12): 14-19