Las técnicas quirúrgicas utilizadas para tratar la enfermedad arterial periférica (EAP) son la tromboendarterectomía y el injerto de bypass. ¿Qué procedimiento se utiliza cuándo, cómo se desarrolla la operación y qué hay que tener en cuenta?
La enfermedad arterial periférica (EAP) es una enfermedad sistémica que provoca una remodelación estructural y funcional de los vasos arteriales [1]. Esto provoca una reducción del flujo sanguíneo, que puede ser asintomática durante mucho tiempo o manifestarse con síntomas como claudicación intermitente, dolor isquémico en reposo o gangrena. El correlato fisiopatológico de la PAVD es la aterosclerosis, una inflamación crónica de la pared vascular en la que se deposita subendotelialmente una placa formada por lípidos, células musculares lisas y macrófagos. En el curso posterior, esta placa puede provocar la estenosis de la luz vascular o inducir la formación local de trombos a través de la rotura [2].
Al tratarse de una enfermedad sistémica, la PAVD suele asociarse a la enfermedad arterial coronaria (EAC) y a la enfermedad cerebrovascular oclusiva (ECV). Un índice tobillo-brazo (ITB) reducido se asocia a una mayor mortalidad cardiovascular [3]. Según los informes, la prevalencia de la PAVD es del 7-15% [4,5]. El abuso de nicotina, la diabetes mellitus, la hipertensión arterial y la hipercolesterolemia son los factores de riesgo más relevantes [6].
La clasificación según Fontaine ha demostrado su utilidad en la práctica clínica diaria. Basándose en los síntomas y en las mediciones del ABI y la oscilografía, se distinguen cuatro estadios. Los estadios I (asintomático, estado tras revascularización intervencionista o quirúrgica) y II (claudicación intermitente) son situaciones no críticas. En cambio, en los estadios III (dolor en reposo) y IV (gangrena) existe un trastorno crítico de la perfusión que puede provocar la pérdida de la extremidad si no se trata.
Diagnóstico
En la anamnesis, se pregunta por la distancia caminada sin dolor y por cualquier factor de riesgo y concomitante. Además, se pregunta por el tipo, la localización y la hora del dolor (¿dolor de reposo nocturno?). El examen clínico incluye el estado del pulso ipsi y contralateral, la función sensoriomotora, el color de la piel y las lesiones (acrales). El ITB, la medición de la presión de oclusión y la oscilografía pueden utilizarse, por un lado, para confirmar la sospecha diagnóstica y, por otro, para clasificar un trastorno de la perfusión crítico y no crítico. Por último, la ecografía dúplex permite una localización precisa de la estenosis y su evaluación en términos de extensión y grado. La angiografía complementaria se utiliza para confirmar los hallazgos del dúplex y para evaluar los vasos de entrada y salida con vistas a una reparación con catéter o quirúrgica.
¿Rehabilitación endovascular o quirúrgica?
En la fase no crítica, la terapia consiste en modificar el perfil de riesgo (abandono de la nicotina, control de la diabetes), terapia farmacológica en el sentido del “mejor tratamiento médico” (inhibición de la agregación plaquetaria y estabilización de la placa) y entrenamiento supervisado de la marcha. La decisión de un tratamiento quirúrgico o endovascular depende de los síntomas, la localización anatómica, la extensión de la lesión y el estado general del paciente. En los pacientes asintomáticos o que sólo presentan síntomas leves de claudicación, no debe realizarse ninguna intervención invasiva. La intervención percutánea o quirúrgica está indicada para:
- Síntomas de claudicación con reducción significativa de la calidad de vida,
- isquemia crítica con pérdida inminente de extremidades,
- Revascularización quirúrgica previa y nueva estenosis y/u oclusión en la zona operada y en los vasos de entrada y salida.
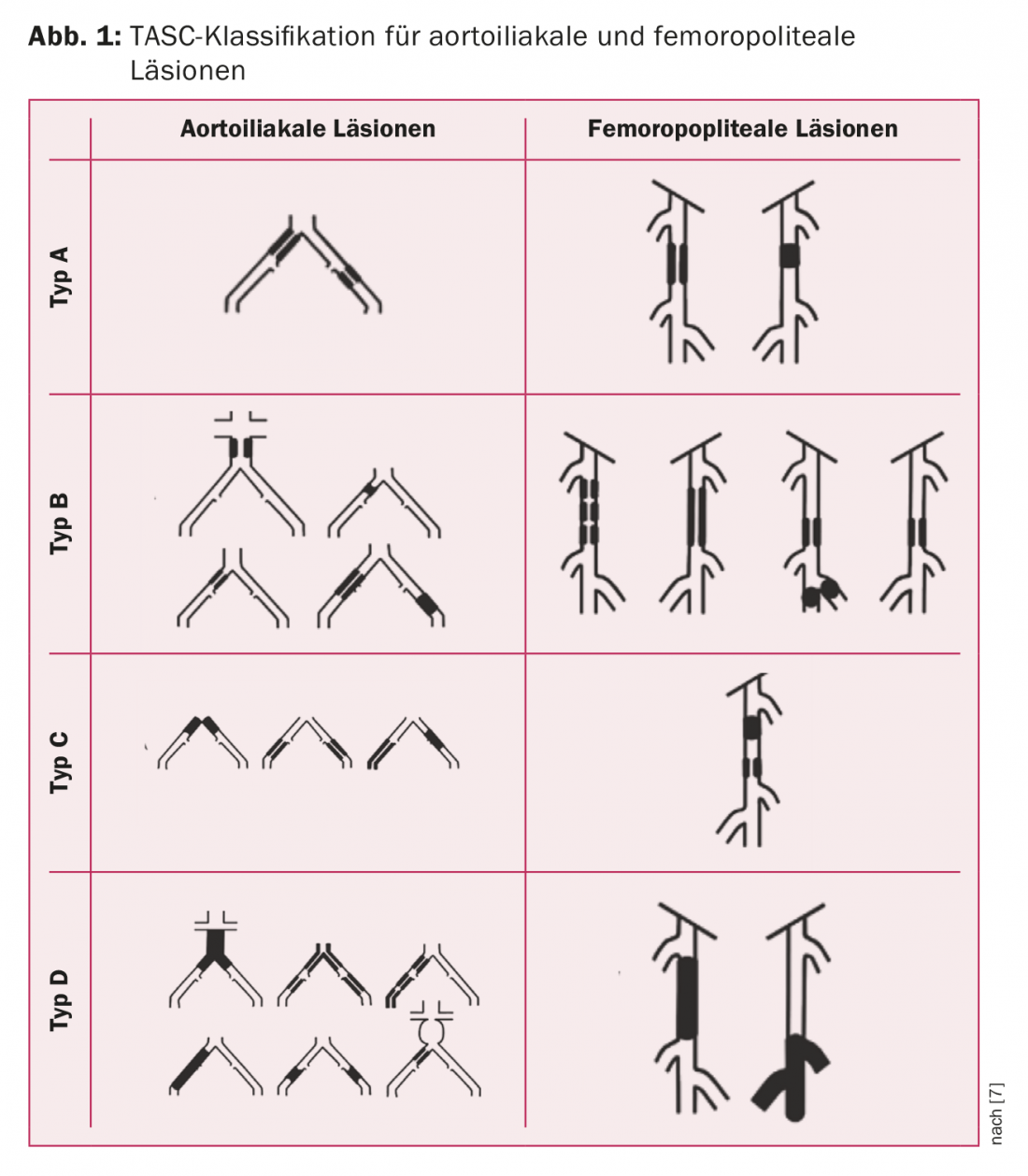
La decisión terapéutica debe tomarse en un debate interdisciplinar entre las disciplinas tratantes de angiología, radiología intervencionista y cirugía vascular. La base para la toma de decisiones es la clasificación TASC [7]. Como “regla general”, las lesiones de tipo A y B deben repararse principalmente por vía endovascular y las de tipo C y D principalmente por vía quirúrgica (Fig. 1) . Otros criterios son la edad y las comorbilidades del paciente y la presencia de una vena de buena calidad para el bypass. La tabla 1 resume el procedimiento recomendado en las directrices de la ESC.

En las estenosis sintomáticas aisladas de la bifurcación femoral, que a menudo se presentan como síntomas de claudicación, la terapia endovascular tiene poco valor, ya que el resultado es significativamente mejor tras la reparación quirúrgica. En presencia de enfermedad oclusiva ilíaca adicional, se realiza un procedimiento híbrido para reparar abiertamente la bifurcación femoral y la recanalización endovascular retrógrada del eje ilíaco.
La tromboendarterectomía y el injerto de bypass, o una combinación de ambos, son los procedimientos quirúrgicos utilizados para tratar la PAVD.
Tromboendarterectomía (TEA)
La localización típica es la bifurcación femoral. Tanto la arteria femoral común (AFC) como las ramas de la femoral profunda (APF) y la femoral superficial (AFS) se ven afectadas con frecuencia. Tras un abordaje longitudinal ligeramente curvado, se prepara el eje vascular con movilización del paquete ganglionar en dirección medial. La AFC se abre longitudinalmente y la incisión se pasa a la AFP si es necesario. En la endarterectomía que se realiza a continuación, la placa aterosclerótica se despega de modo que sólo queda la adventicia como pared del vaso. Un escalón de íntima-media en desarrollo distal se fija mediante sutura para evitar la disección tras la liberación del flujo sanguíneo. El cierre de la arteriotomía longitudinal se realiza con la inserción de un parche para evitar la estenosis mediante una sutura directa. Si es necesaria una TEA de las salidas APF y AFS, puede realizarse una transposición de la horquilla femoral si la anatomía es favorable. En la misma sesión, las estenosis hemodinámicamente relevantes de los vasos de entrada y salida se reparan por vía retrógrada (eje ilíaco) o anterógrada (eje femoropoplíteo) a través del abordaje inguinal mediante ATP o endoprótesis.
Operación de derivación
La cirugía de bypass se reserva, con pocas excepciones, a los pacientes con PAVD en estadio III y IV y es el tratamiento de elección para las oclusiones femoropoplíteas e infrageniculares de largo recorrido. Los siguientes pasos forman parte de la realización de una operación de derivación:
Imágenes preoperatorias: Debe disponerse de una angiografía (convencional, TC o RM) para evaluar los vasos de entrada y salida y planificar la anastomosis proximal y distal. La localización más común de la anastomosis proximal del bypass femoropoplíteo es la AFC. Si la anastomosis es distal al tronco tibiofibular, se utiliza la mejor conexión “de pie”. Esto significa utilizar las imágenes preoperatorias para decidir qué arteria de la parte inferior de la pierna se extiende hasta el pie sin estenosis u oclusión relevantes. En consecuencia, se realiza un abordaje medial o lateral en la parte inferior de la pierna.
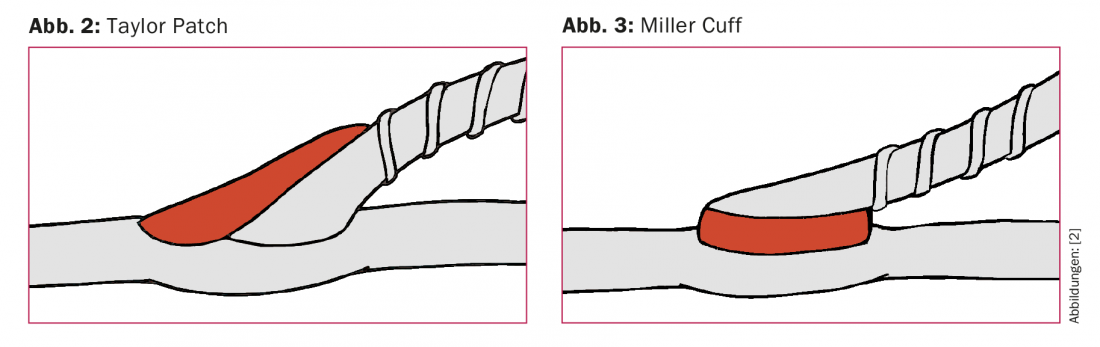
Planificación del material de bypass: El conducto de elección es la vena safena mayor autóloga ipsilateral (VSM). Si su calibre es demasiado bajo o ya se ha utilizado para otro procedimiento, pueden utilizarse como alternativas la VSM contralateral, la vena safena (VSP) o las venas del brazo. Si es necesario, pueden combinarse varios segmentos venosos para formar un bypass compuesto. En caso de derivación femoropoplítea con conexión supragenicular al segmento P1, se recomienda el uso de una prótesis en ausencia de VSM [10]. Si la prótesis es el único material de derivación posible y la conexión es infragenicular, debe interponerse un segmento corto de vena a modo de parche o manguito en la zona de la anastomosis distal para mejorar la tasa de apertura [11] (Fig. 2 y 3).
Recogida de la vena: Preoperatoriamente, se marca sonográficamente el curso de la vena. Si el VSM es ipsilateral, la incisión para la extracción de la vena también se utiliza para acceder al segmento poplíteo supra o infragenicular para la anastomosis.
“Invertido” frente a “No invertido”: Si se decide utilizar la vena “invertida”, el segmento extraído se gira y la apertura de la válvula tiene lugar ahora en la dirección del flujo arterial. La ventaja en este caso es que no es necesario resecar las válvulas venosas. El inconveniente, sin embargo, es que el extremo distal más estrecho de la vena se anastomosa proximalmente a la arteria de gran calibre y viceversa.
Si se opta por un bypass “sin inversión”, las válvulas se valvulotomizan tras la extracción de las venas. Esto puede hacerse angioscópicamente para evaluar simultáneamente la vena endoluminalmente (acumulación de trombos, esclerosis de la pared).
Existe una situación especial con la derivación in situ. Aquí el VSM se deja en su duplicación fascial y las ramas laterales marcadas preoperatoriamente se ligan a través de pequeñas incisiones. Los extremos proximal y distal de la vena se movilizan lo suficiente para la conexión arterial. También en este caso es necesaria una valvulotomía.
No existe una preferencia clara en la literatura por ninguna de las técnicas descritas. En nuestro hospital, el bypass suele realizarse con una técnica “sin inversión” tras una valvulotomía previa controlada angioscópicamente a lo largo del eje del vaso.
Recorrido del bypass: Se distingue entre el recorrido del bypass anatómico (ortotópico) y el extraanatómico. El bypass femoropoplíteo debe, si es posible, situarse ortotópicamente en el curso del eje del vaso nativo. Es importante evitar la torsión o el retorcimiento de la vena dirigida distalmente. Los bypass extraanatómicos suelen discurrir por vía subcutánea y alejados del eje real del vaso. Ejemplos de ello son el bypass axilofemoral o el bypass cruzado para procesos de oclusión aortoilíaca. Suele tratarse de pacientes con un alto riesgo perioperatorio, una situación infecciosa no saneada en el curso del eje vascular o múltiples operaciones previas.
Anastomosis: Normalmente, las anastomosis proximal y distal se crean en una configuración de extremo a extremo (E/S). Aquí, el extremo de la vena se cose en la arteria que se ha arteriotomizado longitudinalmente. La ventaja es que se sigue manteniendo la perfusión anterógrada y retrógrada de las colaterales proximales y distales.
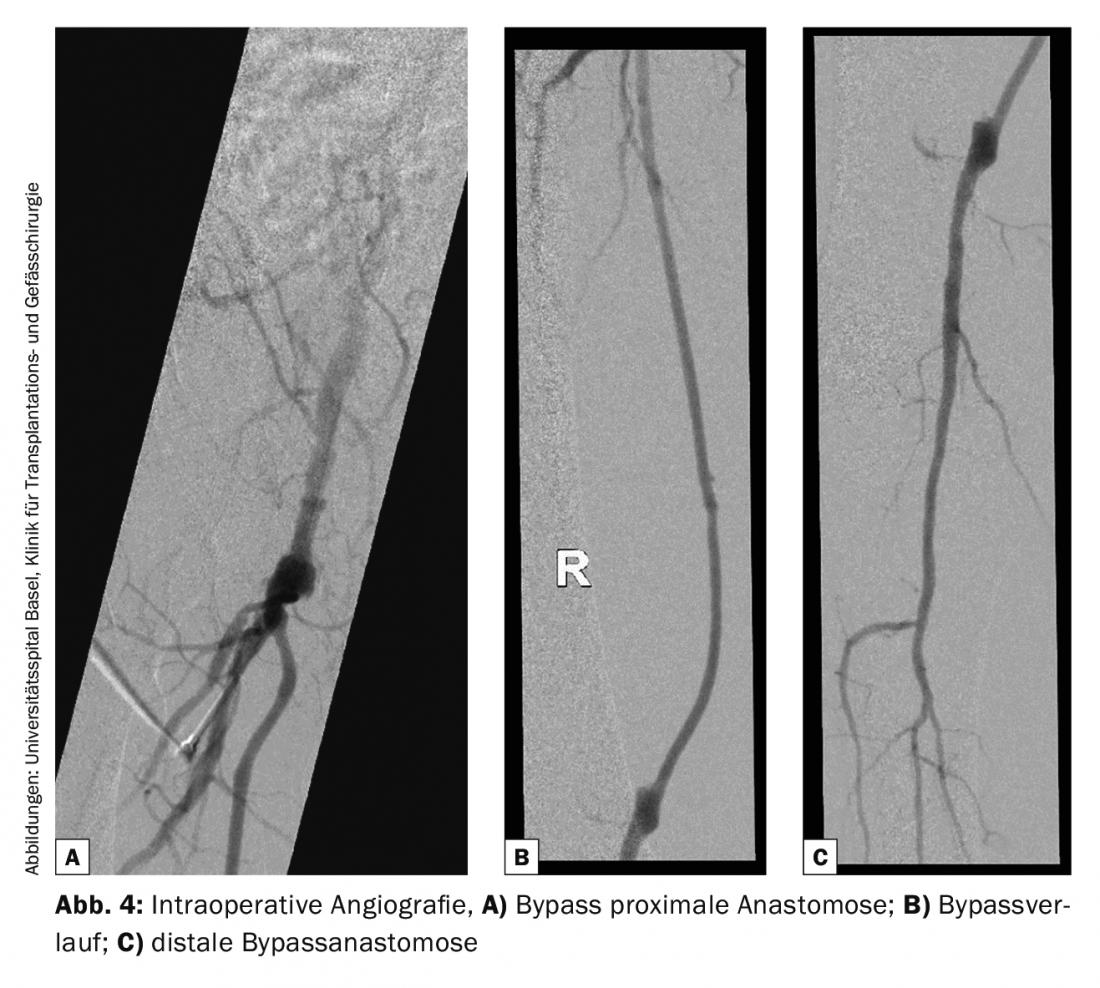
Control del bypass: El control intraoperatorio del bypass se lleva a cabo, por un lado, con el dispositivo Doppler y, por otro, angiográficamente para evaluar las anastomosis, así como el curso del bypass y la situación del escurrimiento en la parte inferior de la pierna. La angiografía no es estándar en todas las clínicas (Fig. 4).
Control postoperatorio: El control postoperatorio del bypass se realiza mediante ecografía dúplex a los tres, seis y doce meses, anualmente si la función del bypass es buena. Con respecto a la inhibición plaquetaria y la anticoagulación oral tras el bypass, existen diferentes enfoques de tratamiento. El estudio holandés BOA demostró que no existían diferencias significativas entre Aspirina® y Marcoumar® en la tasa de derivación infrarrenal. Sin embargo, en un análisis de subgrupos, los pacientes con un conducto venoso mostraron una mejor tasa de apertura bajo anticoagulación oral, mientras que los pacientes con bypass protésico tuvieron un mejor resultado bajo terapia antiplaquetaria [12].
En nuestra clínica, los pacientes con una conexión de bypass distal hasta el tronco tibiofibular incluido suelen recibir Aspirina®, a menos que ya exista anticoagulación oral debido a otra indicación. Cuando se crea un bypass venoso con una conexión distal crural o pedal, se anticoagula a los pacientes por vía oral. Todos los pacientes con bypass protésico reciben Aspirina® o Plavix®, si es necesario, además de la anticoagulación preexistente.
Mensajes para llevarse a casa
- La PAVD se asocia a menudo con la CHD y la CVI. La disminución del ITB se asocia a un aumento de la mortalidad cardiovascular.
- Mientras que los estadios I y II representan una situación circulatoria no crítica, los estadios III y IV pueden conducir a la pérdida de la extremidad si no se tratan.
- La realización de un tratamiento endovascular primario o quirúrgico primario depende de la localización y extensión de la lesión, el estado general, el riesgo perioperatorio, la esperanza de vida del paciente y la presencia de una vena de buena calidad (dispositivo de derivación).
- Las técnicas quirúrgicas para tratar la PAVD incluyen la tromboendarterectomía (TEA) y el injerto de bypass en casos de oclusión de segmento largo y perfusión crítica. Si es necesario, se combinan los dos procedimientos. Si es necesario, la revascularización con catéter de los vasos de entrada y salida se realiza en la misma sesión.
- Los pacientes con bypass venoso crural o pedal deben recibir anticoagulación oral en el postoperatorio, y los pacientes con bypass protésico deben recibir terapia antiplaquetaria simple o doble.
Literatura:
- Donnelly R, Powell J: Epidemiología y gestión de los factores de riesgo de la enfermedad arterial periférica. En: Cirugía vascular y endovascular, 5ª edición. Edimburgo: Saunders Elsevier, 2014: 1-15.
- Owens C: Aterosclerosis. En: Cirugía vascular de Rutherford, volumen 1, 8ª edición. Filadelfia: Saunders Elsevier 2014: 66-77.
- McKenna M, Wolfson S, Kuller L: La relación entre la presión arterial del tobillo y la del brazo como predictor independiente de la mortalidad. Aterosclerosis 1991; 87: 119-128.
- Fowkes F, et al: Estudio arterial de Edimburgo: Prevalencia de la enfermedad arterial periférica asintomática y sintomática en la población general. Int J Epidemiol 1991; 20: 384-392.
- Newman AB, et al: Índice tobillo-brazo como marcador de aterosclerosis en el Estudio de Salud Cardiovascular. Grupo de Investigación Colaborativa del Estudio Cardiovascular del Corazón (CHS). Circulation 1993; 88: 837-845.
- Bhatt DL, et al: Prevalencia internacional, reconocimiento y tratamiento de los factores de riesgo cardiovascular en pacientes ambulatorios con aterotrombosis. JAMA 2006; 295: 180-189.
- Norgren L, et al: Consenso intersocietario para el tratamiento de la enfermedad arterial periférica (TASC II). J Vasc Surg 2007; 45: 5-67.
- Aboyans V, et al: 2017 ECS Guidelines on the Diagnosis and Treatment of Peripheral Arterial Diseases, en colaboración con la Sociedad Europea de Cirugía Vascular (ESVS). Revista Europea del Corazón 2018; 39: 763-816.
- Adam AJ, et al: Bypass frente a angioplastia en la isquemia grave de la pierna (BASIL): ensayo controlado aleatorizado multicéntrico. Lancet 2005; 366: 1925-1934.
- Klinkert P, et al: Vena safena frente a PTFE para el bypass femoropoplíteo por encima de la rodilla. Una revisión de la literatura. Eur J Vasc Endovasc Surg 2004; 27: 357-362.
- Griffiths GD, et al: Ensayo clínico aleatorizado del manguito de interposición venosa anastomótica distal en el injerto de bypass infrainguinal de politetrafluoroetileno. Br J Surg 2004; 91: 560-562.
- Ensayo BOA holandés: Eficacia de los anticoagulantes orales en comparación con la aspirina tras la cirugía de bypass infrainguinal (The Dutch Bypass Oral Anticoagulants or Aspirin Study): un ensayo aleatorizado. Lancet 2000; 355: 346-351.
CARDIOVASC 2018; 17(5): 22-25