Los tres pilares básicos de la terapia para pacientes con fibrilación auricular (FA) son reducir el riesgo de ictus, prevenir la taquicardiomiopatía y mejorar la calidad de vida mediante el alivio de los síntomas. La ablación con catéter de la fibrilación auricular es superior a la terapia antiarrítmica en términos de control del ritmo y calidad de vida [1,2]. Las directrices actuales dejan relativamente mucho margen de maniobra en la indicación del aislamiento de las venas pulmonares. Los pacientes sin cardiopatía estructural con FA paroxística sintomática o FA persistente durante menos de un año tienen las mejores probabilidades de éxito. Cuanto más temprano en el curso de la enfermedad tenga lugar el tratamiento, mayores serán las tasas de éxito de la ablación con catéter. Gracias a los grandes avances tecnológicos, las tasas de complicaciones en los centros experimentados son muy bajas, por lo que se puede hablar de un procedimiento muy seguro.
Con una prevalencia del 1,5-2%, la fibrilación auricular es la arritmia cardiaca más común en la práctica clínica. La prevalencia aumenta con la edad. Entre las personas de 80 años, más del 8% están afectadas [3,4], los hombres ligeramente más a menudo que las mujeres. Según los informes, la fibrilación auricular idiopática no asociada a cardiopatía estructural tiene una prevalencia de hasta el 30% [5].
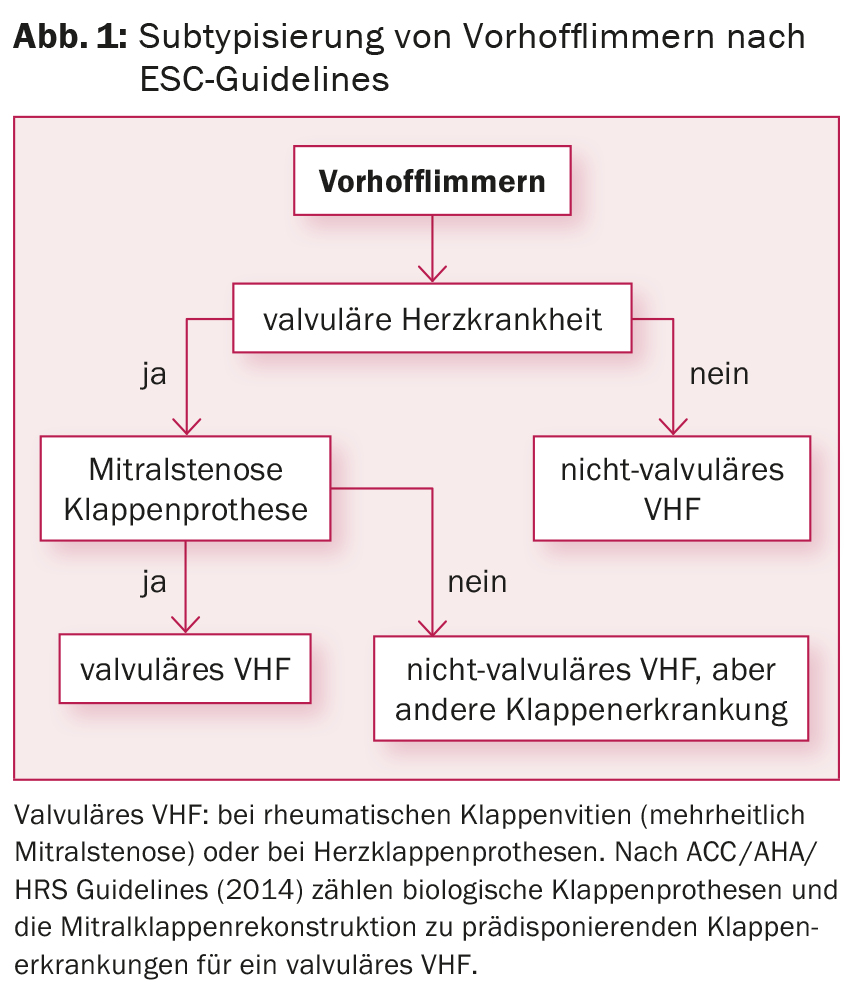
Según su duración, la fibrilación auricular se divide en paroxística (≤48 horas), persistente (>7 días), persistente larga (>1 año) y fibrilación auricular permanente. En este último caso, se acepta la alteración del ritmo y ya no se busca el control del ritmo. De forma similar a la puntuación de la NYHA, la carga de arritmia se asigna a una puntuación de síntomas (EHRA I-IV).
La mortalidad de los pacientes con fibrilación auricular se multiplica aproximadamente por 1,5 en los hombres y por 1,9 en las mujeres. Este fue el resultado de los análisis del estudio Framingham. Por un lado, hay un mayor riesgo de insuficiencia cardiaca con un riesgo tres veces mayor de descompensación cardiaca; por otro, hay un riesgo cinco veces mayor de insulto cerebrovascular o embolia sistémica. Utilizando la puntuación CHA2DS2-VASc, el riesgo de ictus puede estimarse de forma individual y algo más precisa.
Opciones de tratamiento e indicación del control del ritmo
Teniendo en cuenta la estratificación del riesgo mediante la puntuación CHA2DS2-VASc, debe iniciarse la anticoagulación oral (ACO) con Marcoumar® o, en caso de fibrilación auricular no valvular (fig. 1), con uno de los nuevos anticoagulantes (conocidos como “anticoagulantes”) en todos los pacientes con ≥1 punto, independientemente del subtipo de fibrilación auricular y también en caso de control del ritmo. anticoagulantes orales directos [DOAK], por ejemplo, rivaroxaban, dabigatran, apixaban, edoxaban). Para reducir los síntomas y prevenir la taquicardiomiopatía (con frecuencias sostenidas >120 lpm), también debe buscarse el control de la frecuencia. Los estudios realizados hasta la fecha no han mostrado diferencias en la morbilidad y la mortalidad al comparar el control de la frecuencia frente al control del ritmo [6]. Si la terapia farmacológica no tiene éxito, la ablación del nodo AV con inserción de marcapasos permanente es una posible opción para el control de la frecuencia, especialmente si existen comorbilidades.
El control del ritmo es esencial en la FA paroxística y persistente, especialmente en pacientes sintomáticos a pesar de un control estricto de la frecuencia. Se pueden utilizar dos métodos básicos: la terapia farmacológica a largo plazo con fármacos antiarrítmicos y el enfoque invasivo mediante procedimientos de ablación. En la situación aguda con inestabilidad hemodinámica, esto también puede lograrse mediante electroconversión (ECV). Si se prefiere el tratamiento rítmico al control de la frecuencia, debe iniciarse lo antes posible tras el diagnóstico, ya que resulta más difícil mantener el ritmo sinusal a medida que aumenta la duración de la FA [7,8].
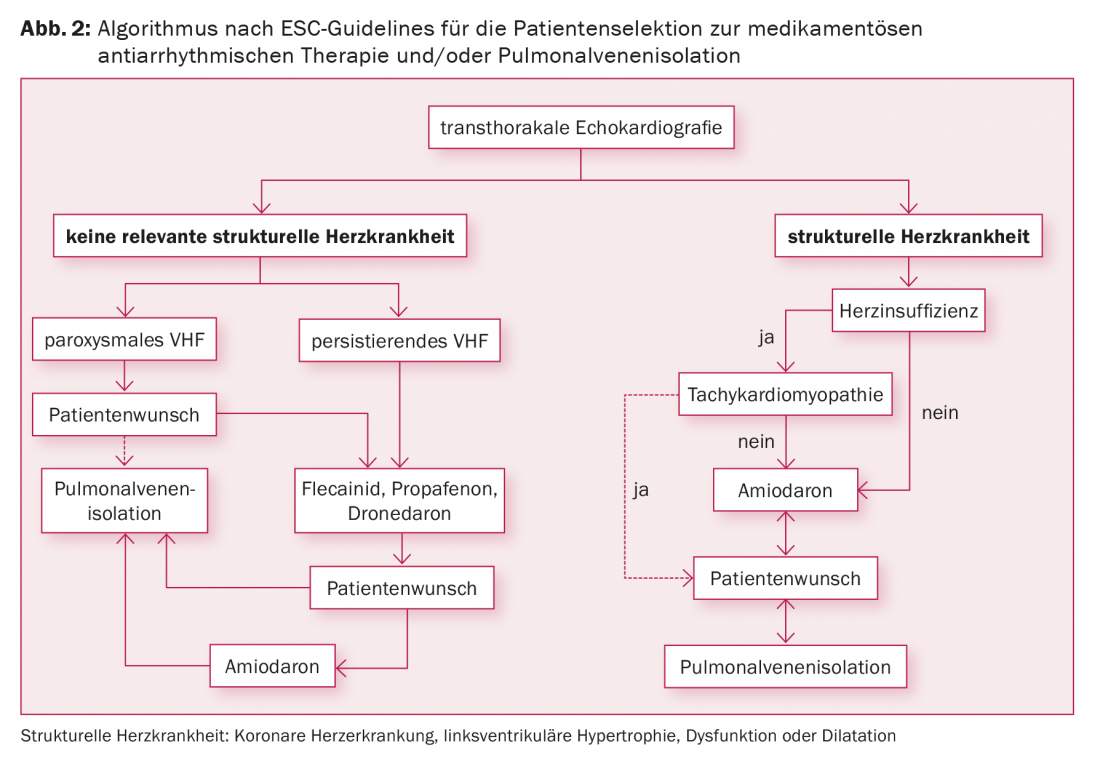
Las indicaciones para el aislamiento de las venas pulmonares incluyen la fibrilación auricular sintomática a pesar de la terapia antiarrítmica, la fibrilación auricular sintomática y el deseo del paciente de no tener que tomar fármacos antiarrítmicos, y la fibrilación auricular sintomática en combinación con contraindicaciones para los fármacos antiarrítmicos (Fig. 2) . En la actualidad se carece de datos que demuestren la prevención de acontecimientos cardioembólicos mediante la ablación con catéter. Por lo tanto, el deseo de suspender la ACO no es una indicación para el aislamiento de las venas pulmonares según los estudios actuales, ya que la ACO debe continuarse incluso después de una ablación con éxito en función de la puntuación CHA2DS2 VASc.
Aislamiento de la vena pulmonar
Desde finales de los años 90, se sabe que más del 90% de los focos ectópicos (los llamados desencadenantes) para el desarrollo de la fibrilación auricular se localizan en las venas pulmonares. Inicialmente, se intentó eliminar estos focos activos mediante ablación local directa. Sin embargo, esto condujo no pocas veces a una estenosis de la vena pulmonar. Hoy se sabe que el aislamiento de las venas en la región donde se unen a la aurícula izquierda (antro) es suficiente y más suave. Basándose en estos hallazgos, el aislamiento de las venas pulmonares se ha establecido como una estrategia terapéutica invasiva gracias al éxito del desarrollo de diversas técnicas de ablación y mapeo con mejoras consecutivas en términos de eficacia y seguridad durante los últimos 10-15 años.
Por regla general, los pacientes ingresan en el hospital el día anterior al examen. El mismo día se realiza una ecocardiografía transesofágica y, si es necesario, una tomografía computarizada o una resonancia magnética del corazón. Estas imágenes pueden facilitar una reconstrucción tridimensional de la aurícula izquierda.
Bajo analgesia (la anestesia general no es obligatoria), se introducen varios catéteres por un acceso venoso en la ingle hasta la aurícula derecha a través de la vena cava inferior y finalmente se colocan en la aurícula izquierda mediante una punción transeptal (Fig. 3) .
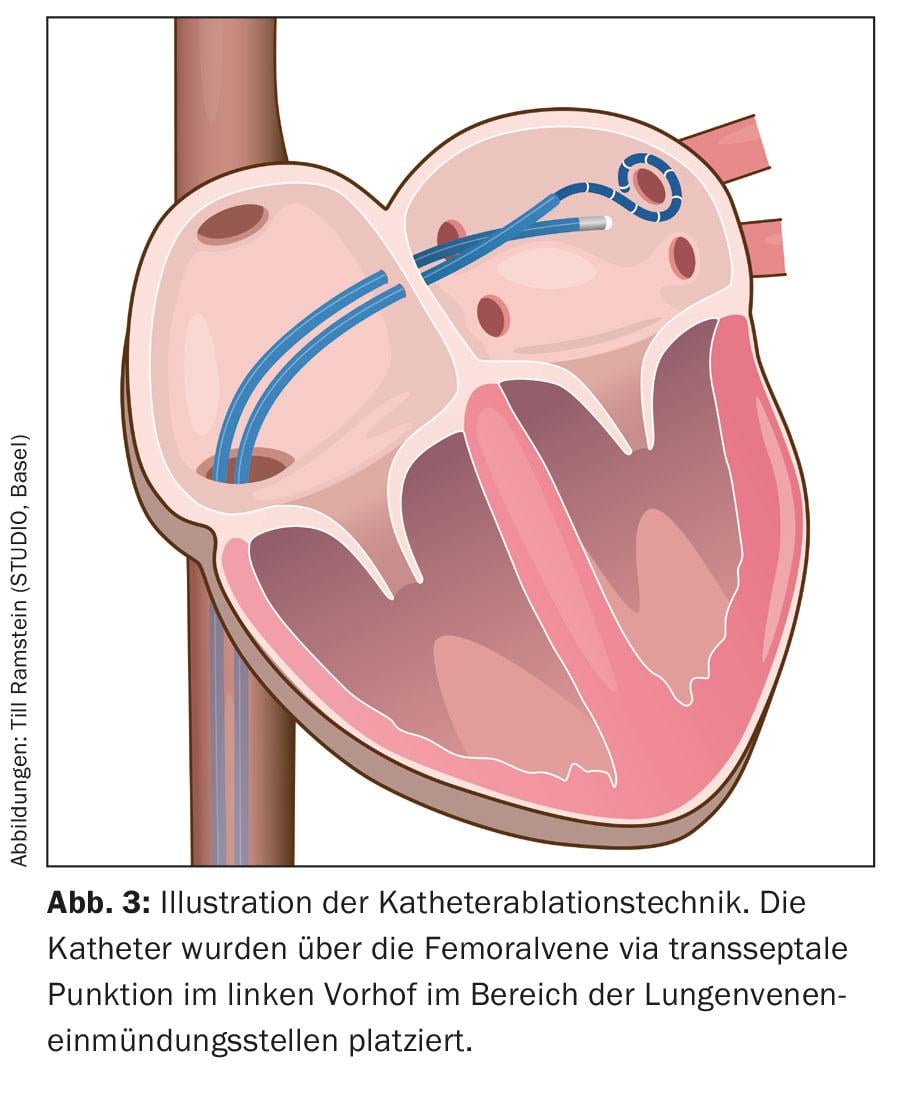
Estos catéteres se utilizan para una reconstrucción tridimensional de la zona de ablación, el llamado mapeo 3D (Fig. 4). Además de los métodos basados en rayos X que utilizan catéteres cartográficos puros para visualizar la conexión entre las venas pulmonares y la aurícula izquierda, se han integrado en el procedimiento los llamados “métodos de cartografía electroanatómica”, que utilizan un sistema tridimensional y no basado principalmente en rayos X.
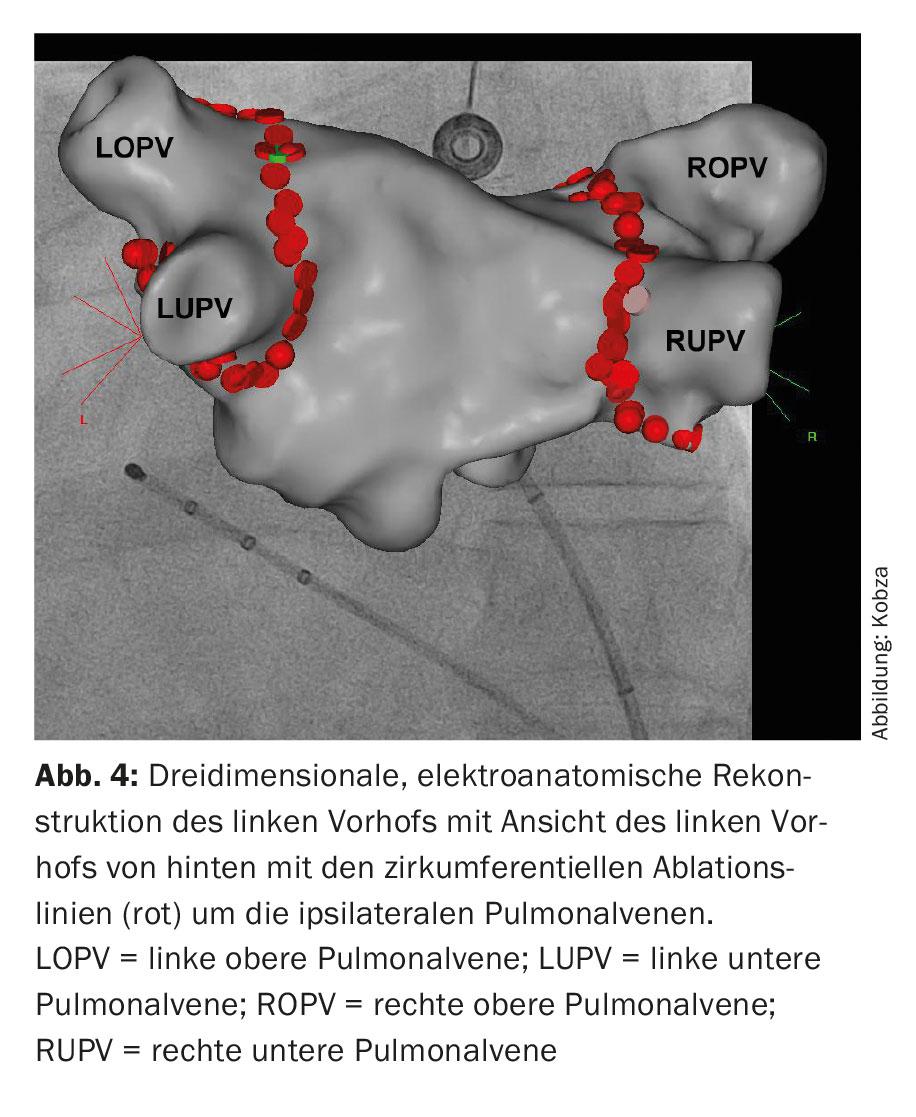
Aquí es posible la integración de imágenes de la anatomía de la aurícula izquierda reconstruida mediante TC y RM. Posteriormente, se realiza la ablación. Esto implica la ablación circunferencial punto a punto en pares alrededor de los ostia de la vena pulmonar ipsilateral utilizando energía de radiofrecuencia, una corriente alterna de alta frecuencia (“ablación circunferencial de área amplia con catéter de radiofrecuencia”, WACA) (Fig. 4). Alternativamente, el aislamiento se consigue mediante la formación de hielo, la llamada ablación por criobalón (Fig. 5). También se utilizan nuevos catéteres de ablación circulares y multipolares. Los procedimientos con láser, que también se realizan a través de un catéter con balón, también son cada vez más frecuentes. Sin embargo, la posible asimetría y variabilidad de tamaño de los orificios de las venas pulmonares y sus variaciones anatómicas pueden complicar el diseño único de los catéteres de ablación asistida por balón. La ablación por radiofrecuencia sigue siendo la más común. Se utiliza un catéter de mapeo circular para controlar el aislamiento eléctrico conseguido. El aislamiento de las cuatro venas pulmonares es el principio fundamental y el objetivo primario del procedimiento, ya que de lo contrario pueden producirse recidivas de la FA, lo que conduciría al fracaso del tratamiento.
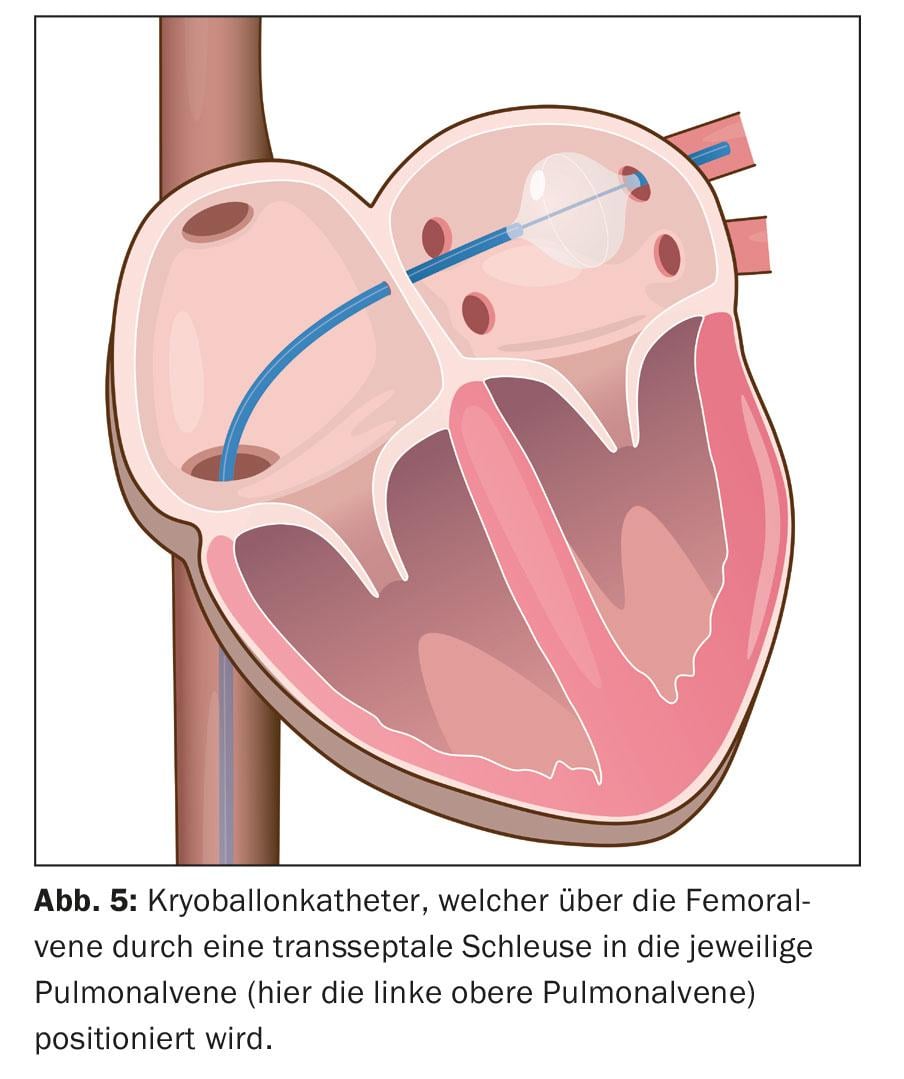
La intervención suele durar entre 90 y 180 minutos. Tras retirar todos los catéteres, se aplica un vendaje de presión. En la mayoría de los casos, los pacientes pueden ser dados de alta al día siguiente.
La OAK no se interrumpe periintervencionistamente, ya que esta estrategia se asocia a menos complicaciones [9]. Tras la intervención, se continúa con la OAK durante al menos tres meses (debido a la cicatrización en la zona de ablación) y después se ajusta en función del riesgo individual según la puntuación CHA2DS2-VASc.
Éxito del tratamiento
Aún no se ha establecido un método óptimo como patrón oro para diagnosticar posibles recidivas de la fibrilación auricular. Dependiendo del centro, los controles de ECG a largo plazo (de 24 horas a 7 días) se realizan tras la intervención a diferentes intervalos, normalmente a los tres, seis y doce meses, y después anualmente.
El éxito depende en gran medida de la experiencia del centro de ejecución. En los tres primeros meses, a veces se siguen observando arritmias cardiacas (extrasístoles auriculares y fibrilación auricular), que no deben considerarse una recidiva (“periodo de blanqueo”). Si después hay un ritmo sinusal continuo, el procedimiento puede calificarse de exitoso. La tasa de éxito es del 80-90% en pacientes con fibrilación auricular paroxística sin cardiopatía estructural, con un 20-30% que requiere repetir el procedimiento. En la fibrilación auricular persistente o en presencia de cardiopatía estructural, la tasa de éxito es del 60-70%. Por ello, la terapia de ablación ha adquirido una gran importancia, ya que incluso el fármaco antiarrítmico más eficaz, la amiodarona, consigue un mantenimiento del ritmo de aproximadamente el 40-50% a largo plazo.
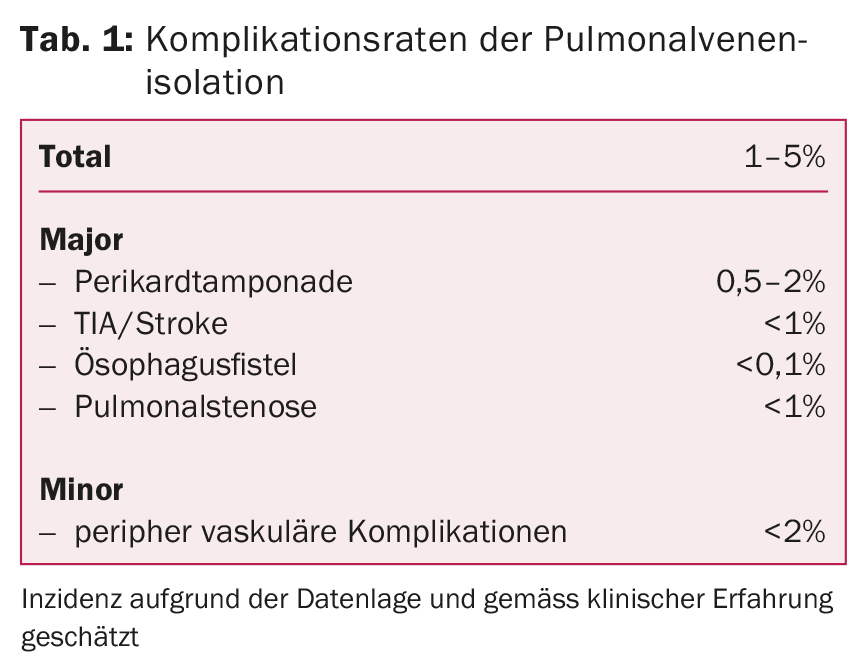
En los centros experimentados, este tratamiento es muy seguro y se asocia a pocas complicaciones. Las complicaciones más peligrosas son los acontecimientos tromboembólicos (AIT, ictus), el taponamiento pericárdico, la estenosis de la vena pulmonar o las fístulas esofagoatriales. Pueden producirse con mayor frecuencia complicaciones en la zona del punto de inyección, como hemorragias secundarias, hematomas o lesiones vasculares (tab. 1).
Agradecimientos: Muchas gracias a Till Ramstein (STUDIO, Basilea) por preparar las figuras 3 y 5.
Literatura:
- Cosedis Nielsen J, et al: Ablación por radiofrecuencia como terapia inicial en la fibrilación auricular paroxística. N Engl J Med 2012; 367(17): 1587-1595.
- Wazni OM, et al: Ablación por radiofrecuencia frente a fármacos antiarrítmicos como tratamiento de primera línea de la fibrilación auricular sintomática: Un ensayo aleatorizado. JAMA 2005; 293: 2634-2640.
- Feinberg WM, et al: Prevalencia, distribución por edad y sexo de los pacientes con fibrilación auricular. Análisis e implicaciones. Arch Intern Med 1995; 155: 469-473.
- Heeringa J, et al: Prevalencia, incidencia y riesgo de fibrilación auricular a lo largo de la vida: el estudio de Rotterdam. Eur Heart J 2006; 27: 949-953.
- Sankaranarayanan R, et al: Comparación de la fibrilación auricular en los jóvenes frente a la de los ancianos: una revisión. Cardiol Res Pract 2013; 2013: 976976.
- The Atrial Fibrillation Follow-up Investigation of Rhythm Management (AFFIRM) Investigators: A comparison of rate control and rhythm control in patients with atrial fibrillation. N Engl J Med 2002; 347: 1825-1833.
- Cosio FG, et al: El retraso en el control del ritmo de la fibrilación auricular puede ser una causa de fracaso en la prevención de las recurrencias: razones para cambiar a un tratamiento antiarrítmico activo en el momento o el primer episodio detectado. Europace 2008; 10: 21-27.
- Kirchhof P: ¿Podemos mejorar los resultados en pacientes con fibrilación auricular mediante una terapia precoz? BMC Med 2009; 7: 72.
- Cappato R, et al: Rivaroxaban ininterrumpido frente a antagonistas de la vitamina K ininterrumpidos para la ablación con catéter en fibrilación auricular no valvular. Eur Heart J 2015 Jul 21; 36(28): 1805-1811.
CARDIOVASC 2015; 14(5): 3-6