La carencia de hierro es la enfermedad carencial más común en todo el mundo. En Europa, la prevalencia es del 5-10% y es una de las causas más comunes de anemia, con alrededor del 50%. Un desequilibrio entre la demanda y la ingesta conduce inicialmente a una deficiencia de hierro de almacenamiento; si hay un suministro insuficiente de los precursores eritropoyéticos, se produce una eritropoyesis deficiente en hierro, mientras que la hemoglobina sigue siendo normal. Sólo cuando los valores caen por debajo de los valores normales de hemoglobina se habla de anemia ferropénica.
La carencia de hierro es la enfermedad carencial más común en todo el mundo. En Europa, la prevalencia es del 5-10% y es una de las causas más comunes de anemia, con alrededor del 50%. La carencia de hierro se divide en tres etapas. Un desequilibrio entre la demanda y la ingesta conduce inicialmente a una deficiencia de hierro de almacenamiento (etapa I), si hay un aporte insuficiente de los precursores eritropoyéticos, se produce una eritropoyesis deficiente en hierro (estadio II), con la hemoglobina aún normal. Sólo cuando la hemoglobina desciende por debajo de los valores normales (hombres adultos: 13 g/dl, mujeres: 12 g/dl) se habla de anemia ferropénica (estadio III). Esta puesta en escena se centra principalmente en la eritropoyesis, pero cada una de nuestras células necesita hierro. La eritropoyesis se abastece preferentemente en caso de carencia de hierro, pero esto también significa que el hierro ya falta en otros sistemas antes de que se presente la anemia. Los trastornos relacionados con la carencia de hierro pueden aparecer ya en las fases I y II.
Fisiología y fisiopatología del metabolismo del hierro
El cuerpo de un adulto sano contiene 3 -5 g de hierro, la mayor parte en forma de hierro hemoglobínico, otra proporción como hierro de almacenamiento (hombres adultos 500 -1000 mg, mujeres premenopáusicas 200 – 400 mg) y sólo una proporción muy pequeña en forma de hierro plasmático. Nuestro organismo obtiene la mayor parte de sus necesidades diarias de hierro mediante el reciclaje a partir de las reservas internas de hierro, pero depende de la absorción enteral para evitar un balance negativo. En una dieta normal y equilibrada, la absorción media de 1-2 mg/día (alrededor del 5 -10% del hierro contenido en los alimentos en una dieta mixta normal) compensa la pérdida fisiológica. En las mujeres durante el periodo menstrual, el balance de hierro a menudo se vuelve negativo con una pérdida diaria de hierro de hasta 3 mg. Para mantener la homeostasis del hierro, es necesaria una ingesta diaria de 8 mg (hombres) y 18 mg (mujeres en edad fértil) debido a que la absorción del hierro es sólo parcial [1]. La mayor parte del hierro alimentario se excreta en las heces.
Nuestra alimentación contiene hierro en diferentes formas. Mientras que el hierro de la carne consiste en gran parte en hierro hemo bivalente, está presente en las verduras y los cereales en forma trivalente. La absorción se produce predominantemente en el duodeno. El hierro hemo derivado de la carne es captado a través de un receptor (proteína hemo portadora 1) en la superficie de los enterocitos. Intracelularmente, el hierro es escindido por una hemoxigenasa y se une a la mobilferrina. Desde aquí, puede utilizarse para procesos celulares o liberarse a la sangre a través de la ferroportina 1 en la membrana basal de los enterocitos. La absorción del hierro hemo es menos susceptible a las alteraciones y más eficaz que la absorción del hierro procedente de verduras y productos de grano. El hierro trivalente debe ser convertido primero en hierro bivalente por el DCYTB (citocromo B duodenal). La captación en los enterocitos tiene lugar a través del DMT-1 (transportador de metales divalentes). 1), un transportador de hierro especial dependiente del pH. Este proceso puede verse obstaculizado por numerosas sustancias (incluidos los antiácidos, el calcio, los oxalatos, los fosfatos). Desde los enterocitos, el hierro divalente también entra en el torrente sanguíneo a través de la ferroportina 1-. Antes de Liberado en la sangre portal, el hierro bivalente es oxidado en trivalente por la hefaestina o la coeruloplasmina y unido a la apo-transferrina formada en el hígado (apo-transferrina+2Fe3+ -> transferrina). En condiciones normales, entre el 16 y el 45% de las moléculas de transferrina del plasma están saturadas de hierro. La captación en las células diana se produce a través de los receptores de transferrina (TfR), cuyo número en la superficie celular está regulado por la necesidad de hierro de la célula respectiva.
El almacenamiento de hierro se realiza predominantemente a través de la ferritina, que se encuentra en todas las células y fluidos corporales. Representa una reserva disponible muy rápidamente, y su concentración sérica se correlaciona bien con las reservas de hierro disponibles en individuos sanos. La regulación de la absorción de hierro de los alimentos tiene lugar a través de una hormona peptídica producida en el hígado, la hepcidina. Conduce a la regulación a la baja de la DMT-1 y a la degradación de la ferroportina 1. La elevación de la hepcidina provoca una disminución de la absorción de los alimentos, así como de la liberación de los enterocitos a la sangre portal.
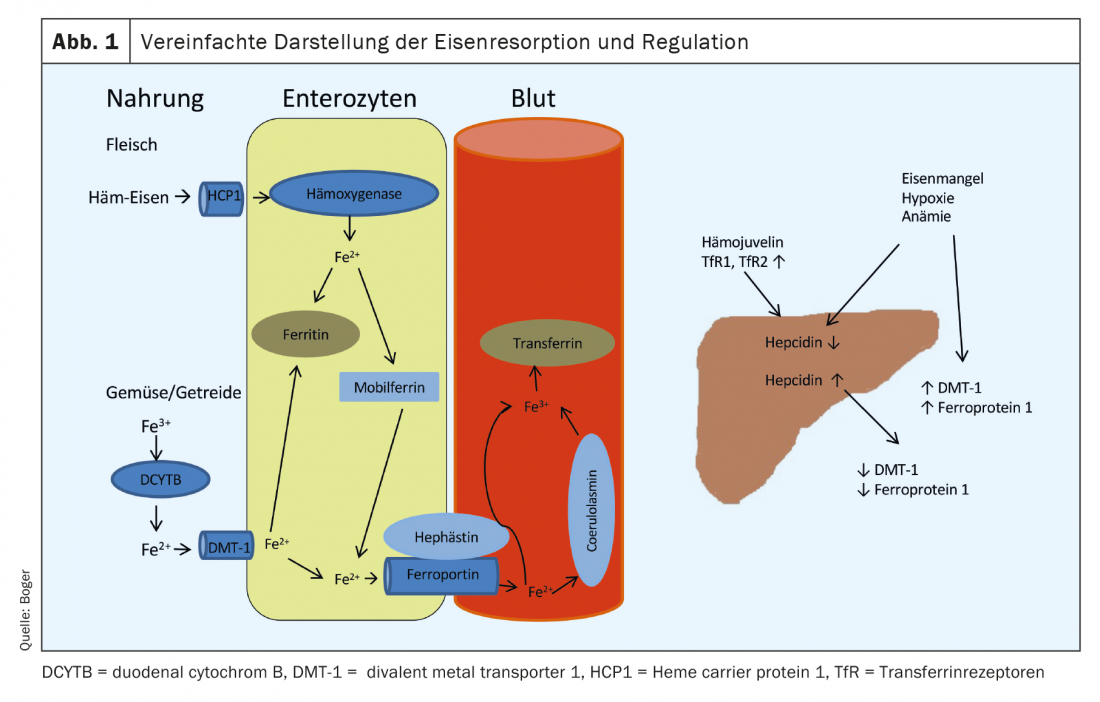
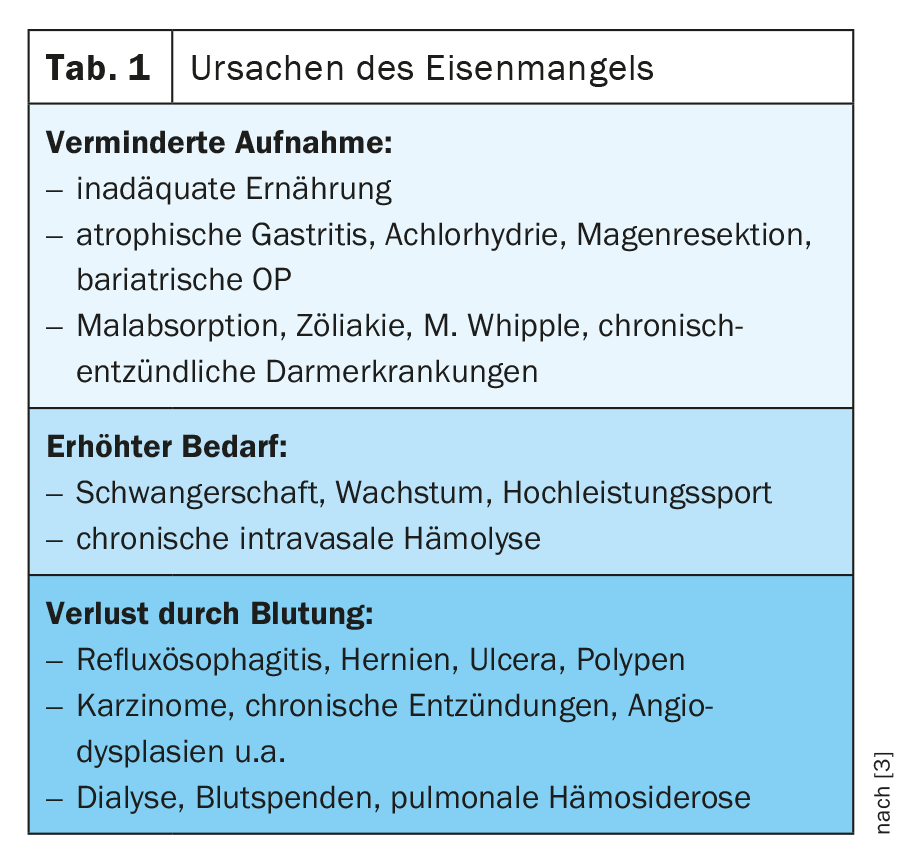
En caso de anemia, carencia de hierro o hipoxia, se reduce la producción de hepcidina en el hígado y aumenta la expresión de DMT-1, DCYTB, hefaestina, ferroportina 1 y HCP1 en los enterocitos [1] (Fig. 1). Enla tabla 1 se ofrece una visión general de las causas de la carencia de hierro.
Deficiencia funcional de hierro
Para el trastorno intrínseco de la utilización del hierro, se ha establecido en los últimos años el término deficiencia funcional de hierro. El término se desarrolló por primera vez para la anemia renal, hoy en día el término también incluye la anemia en enfermedades crónicas (tumores, infecciones, enfermedades autoinmunes). Entre otras cosas, la liberación de citocinas inflamatorias (por ejemplo, interleucina-1α, interleucina-1β, interleucina-6, factor de necrosis tumoral-α) conduce a la inducción de hepcidina, lo que provoca una reducción de la reabsorción y un deterioro de la transferencia interna a la proteína transportadora transferrina y explica así la reducción dela saturación de transferrina (TSAT) como hallazgo de laboratorio diagnóstico indicativo.
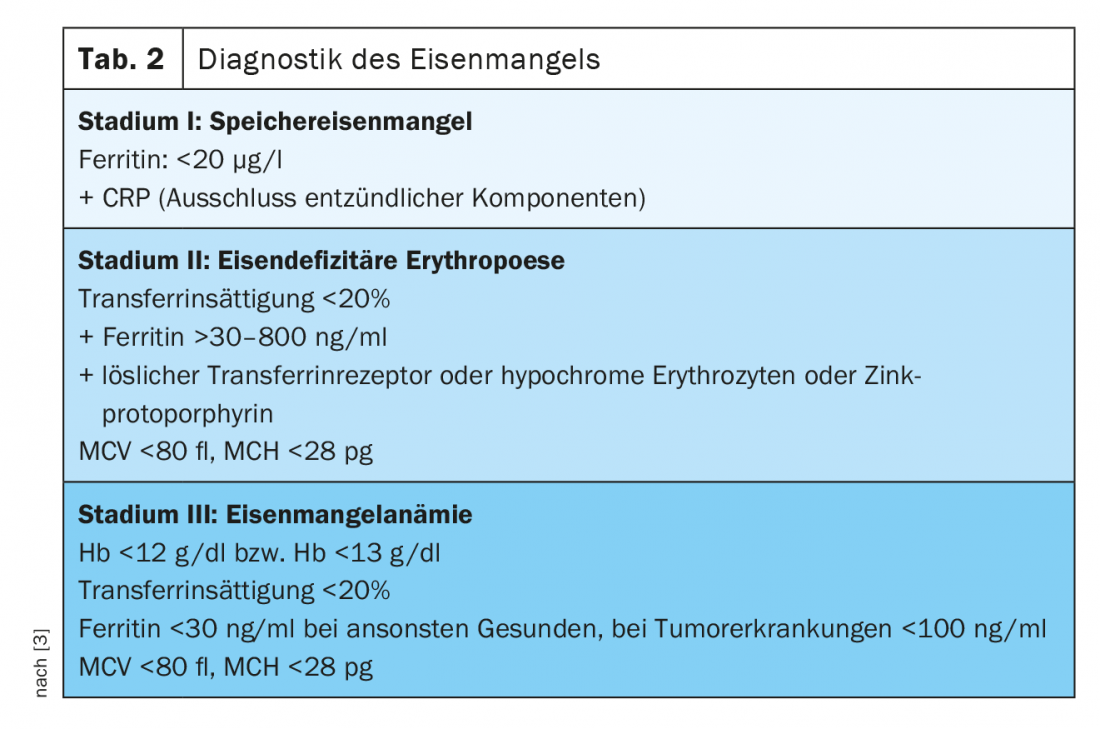
Diagnóstico de la carencia de hierro
Estadio I (carencia de hierro de almacenamiento)
La ferritina en suero se correlaciona con el estado de las reservas de hierro en individuos sanos y puede diagnosticar ya una carencia de hierro en -estado I. Mientras que hablamos de carencia de hierro en personas sanas cuando el nivel es inferior a 20 µg/l, sabemos que los pacientes con neoplasias sólidas y carencia de hierro demostrada pueden tener niveles de ferritina de 100 – 800 µg/l, y en una cuarta parte de los pacientes incluso superiores a 800 µg/l [2].
Aunque el color azul berlinés del El frotis de médula ósea permite una excelente evaluación del contenido de hierro basada en la proporción de sideroblastos (eritroblastos con evidencia de gránulos de hierro intracelular), este método de diagnóstico invasivo no es el método de elección para una simple deficiencia de hierro. Sin embargo, si se realiza una punción en pacientes oncológicos en particular debido a un problema diferente, también puede realizarse esta tinción si la causa de la anemia no está clara.
Estadio II (eritropoyesis deficiente en hierro)
El La saturación de transferrina (TSAT) como medida del hierro funcional disponible está sujeta a la fluctuación circadiana y puede reducirse en procesos inflamatorios a pesar de que los niveles de ferritina sean normales. Es un parámetro de la carencia funcional de hierro (TSAT [%]= hierro sérico [µg/dl]/transferrina sérica [mg/dl]×70,9). En condiciones fisiológicas, hasta el 45% de las moléculas de transferrina están cargadas de hierro. Si la proporción es inferior al 20%, debe suponerse una situación de carencia de hierro.
La concentración dereceptores solubles de transferrina (sTfR) en el suero depende de la actividad de la eritropoyesis y del estado del hierro. Si existe una deficiencia pura de hierro almacenado, se encuentra en el rango normal. En la eritropoyesis por deficiencia de hierro, los niveles séricos aumentan. Por lo tanto, sirven muy bien como parámetros para diferenciar la eritropoyesis deficiente en hierro y la deficiencia funcional de hierro. El denominado índice TfR-F puede calcularse a partir de los valores del receptor soluble de transferrina y de la ferritina sérica, lo que permite una mayor sensibilidad y especificidad con respecto a una declaración de eritropoyesis ferropénica. Otros parámetros para el diagnóstico de la eritropoyesis ferropénica es la proporción de reticulocitos hipocrómicos (HYPO). Con un aporte suficiente de hierro o una carencia de hierro en estadio I, la proporción de eritrocitos hipocrómicos es inferior al 2,5%. Si es superior al 10%, es una prueba de eritropoyesis deficiente en hierro. También la determinación del El contenido de hemoglobina de los reticulocitos (CHr) es un parámetro muy precoz de la eritropoyesis ferropénica.
Un parámetro que todavía no se ha utilizado mucho en la práctica diaria es el Protoporfirina de zinc (ZPP). Si no hay hierro disponible durante la síntesis de la hemoglobina, el zinc se metaboliza en su lugar y el resultado es Globina ZPP. ZPP surge de la fase II de la carencia de hierro. Una medición muy rentable mediante hematofluorometría, que puede utilizarse como diagnóstico en el punto de atención, permite diagnosticar y cuantificar la eritropoyesis ferropénica, aunque los diferentes métodos de medición y la falta de normalización dificultan una amplia aplicación [3]. También la medición de La hepcidina permite diferenciar la carencia absoluta de hierro de la carencia funcional de hierro en el contexto de las enfermedades crónicas. A falta de normalización, este parámetro tampoco se utiliza en la práctica clínica diaria.
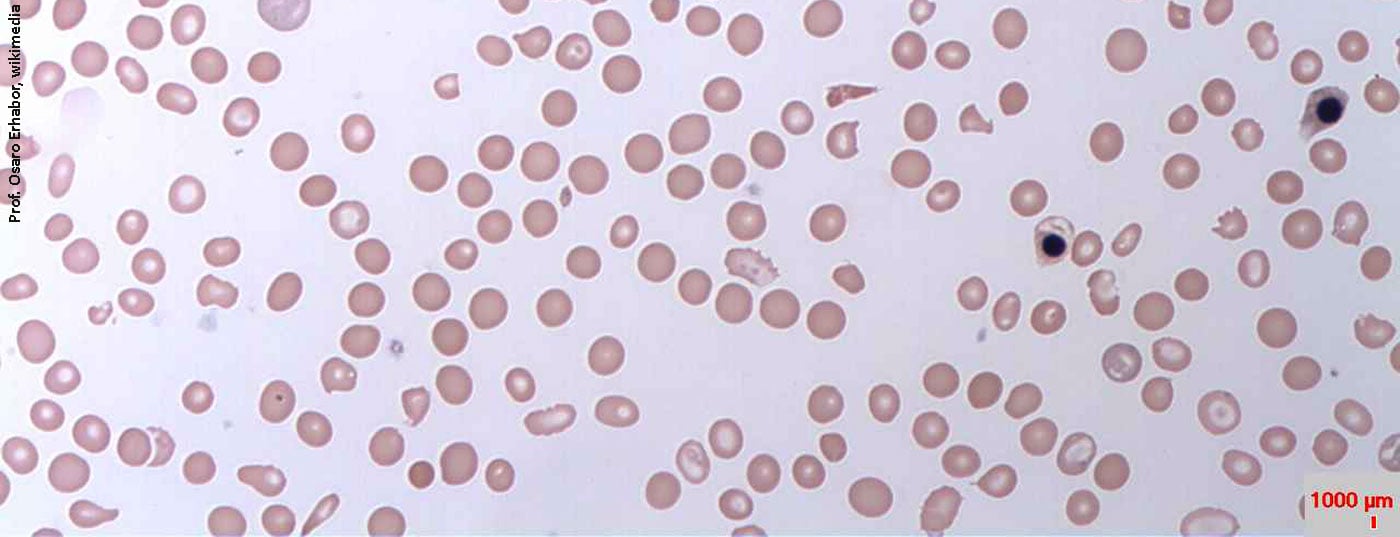
En Estadio III anemia manifiesta con eritrocitos hipocrómicos (MCH <28 pg) y microcíticos (MCV <80 fl) se produce con una concentración de Hb de <12 g/dl en las mujeres y <13 g/dl en los hombres. Como expresión de la reactividad cruzada de la trombopoyesis al aumento de los niveles de eritropoyetina, la trombocitosis reactiva no es infrecuente (para una visión general del diagnóstico de la deficiencia de hierro, véase Tabla 2).
Los aspectos específicos del paciente oncológico
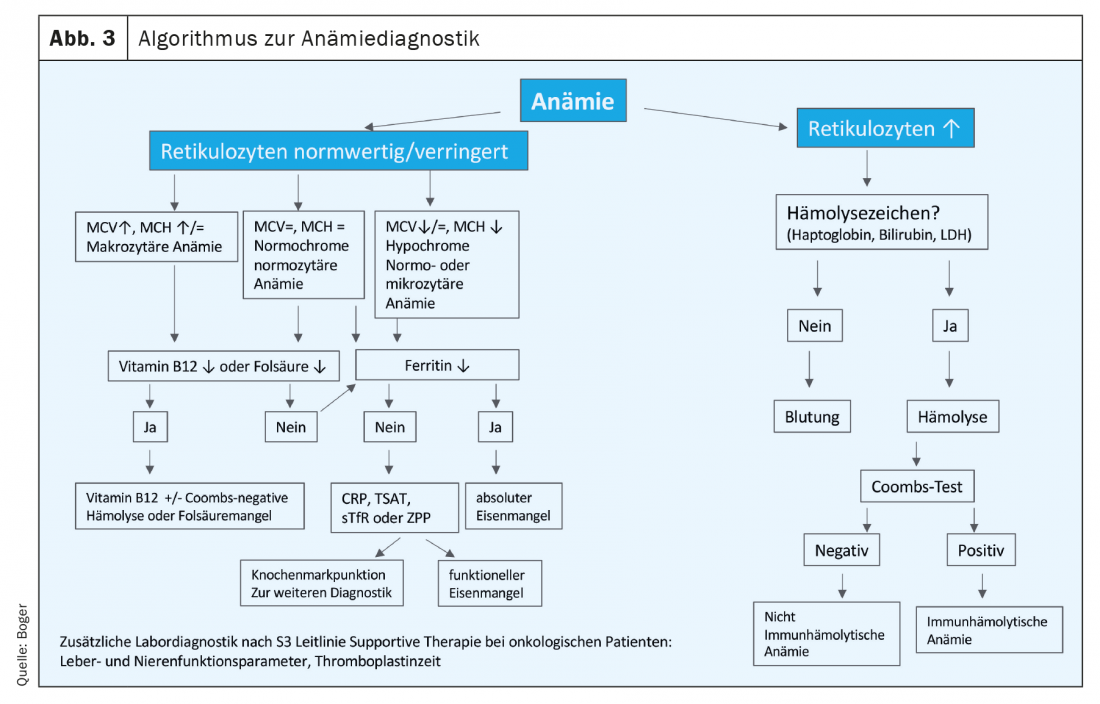
En los pacientes oncológicos, la deficiencia absoluta y funcional de hierro se encuentra a menudo debido a la inflamación, la alteración de la nutrición y la pérdida de sangre o el acortamiento del tiempo de supervivencia de los eritrocitos, superpuesto a (Fig. 2).En la directriz alemana S3 Terapia de apoyo en pacientes con cáncer, ya se recomiendan diagnósticos adecuados en el momento del diagnóstico inicial. También deben aclararse otras causas de anemia no específicas del tumor [4]. Un algoritmo para el diagnóstico de la anemia está disponible en Figura 3 compilado.
Ya en el momento del diagnóstico, la mitad de los pacientes con tumores presentan tanto anemia como carencia de hierro. Bajo terapia, las cifras aumentan significativamente. No todos los tumores provocan anemia o carencia de hierro en la misma medida. En La figura 4 ofrece una visión general de la prevalencia de las diferentes enfermedades tumorales [5,6].
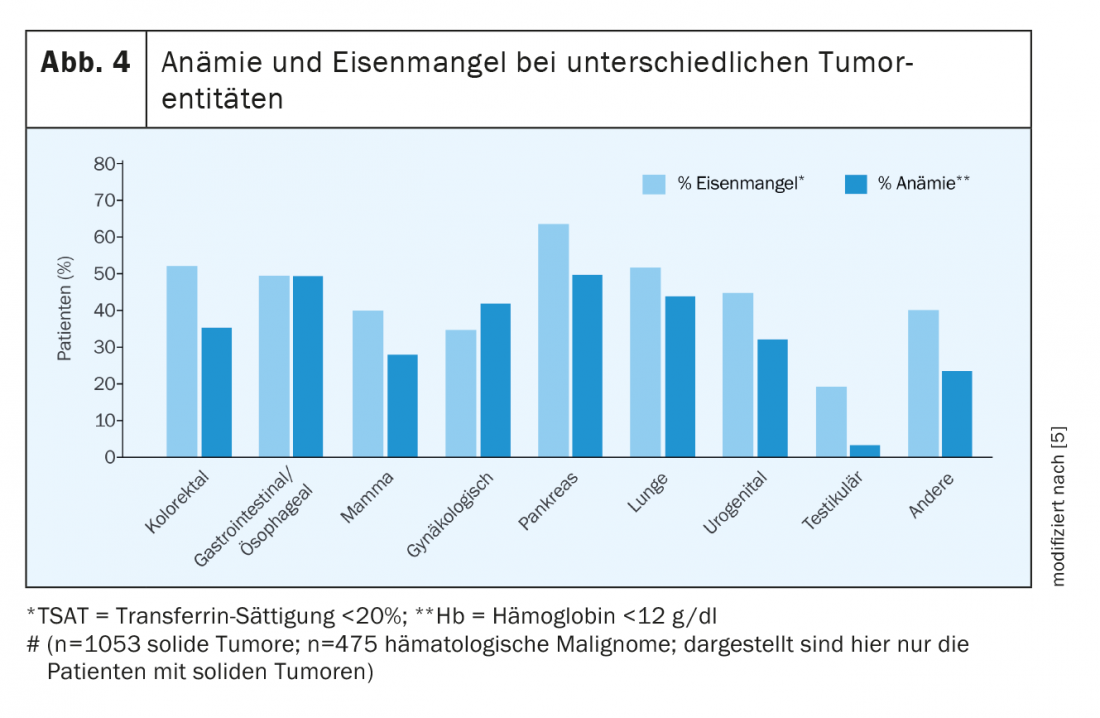
Las hemorragias crónicas se producen sobre todo en los tumores gastrointestinales o ginecológicos. La pérdida de sangre estimula la eritropoyesis hiperregenerativa a través de la inducción de eritropoyetina reactiva y, por tanto, requiere más hierro. Si, además, existe una carencia funcional de hierro en la inflamación crónica y la eritropoyesis también está inhibida por la terapia tumoral farmacológica o la radiación, la eritropoyetina suele elevarse en una función renal normal, pero el aumento no es suficiente para compensar la anemia multicausal.
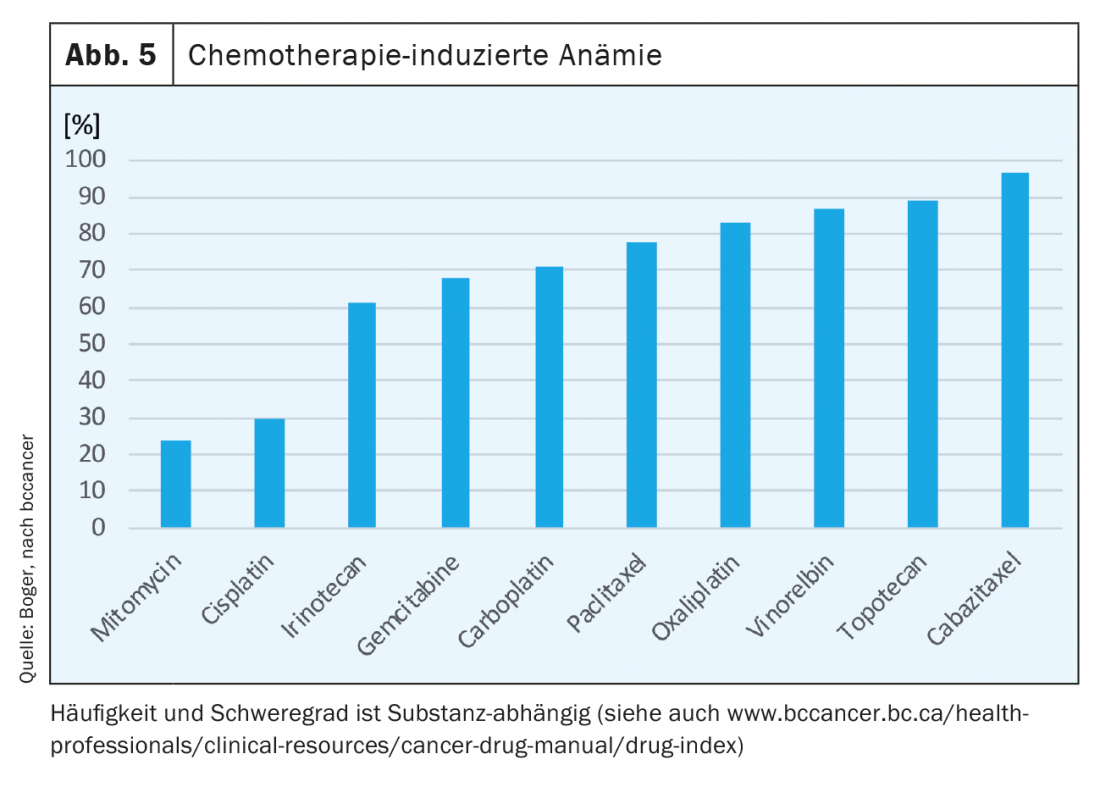
Hasta en un 75% de los pacientes oncológicos se produce anemia en el curso del tratamiento. Con radioterapia sola, dependiendo de la entidad tumoral, hasta en el 50% de los pacientes. Los agentes quimioterapéuticos suprimen la eritropoyesis y, dependiendo de la sustancia, provocan anemia (Fig. 5). En las terapias combinadas se observa un efecto aditivo y también con el número de ciclos suele producirse un aumento de la anemia [7].
Tratamiento de la ferropenia y la anemia ferropénica en pacientes tumorales
Sustitución del hierro
Una carencia absoluta de hierro es una indicación clara de sustitución. Para el cálculo de las necesidades de hierro, se ha establecido el cálculo según Ganzoni:
|
Déficit total de hierro (mg) = [Soll-Hb – Patienten Hb (g/dl)] × peso corporal (kg) × 2,4 + hierro de almacenamiento* (mg) * |
Sustitución oral
Para la sustitución oral, existen preparados con hierro tanto bivalente como trivalente. Las dosis varían hasta 200 mg diarios. Incluso con una tolerancia muy buena, el organismo puede tomar max. 10% de la cual es absorbida. Los pacientes oncológicos suelen tener una demanda muy elevada y generalmente una carencia funcional de hierro, por lo quela sustitución oral provocaefectos secundarios innecesarios (tolerancia gastrointestinal)si la absorción está alterada, sin reponer eficazmente las reservas de hierro. Antes de decidir sobre la terapia de sustitución oral, debe determinarse el estado de inflamación y las posibles contraindicaciones adicionales a la sustitución oral (por ejemplo, resección gástrica, trastornos de malabsorción, estreñimiento crónico, incumplimiento terapéutico). Estreñimiento, deterioro del cumplimiento terapéutico).
Las sustancias más utilizadas en la suplementación oral son el fumarato ferroso, el gluconato ferroso y el sulfato ferroso. Recientemente, han aparecido en el mercado sustancias alternativas con un potencial de absorción mejorado y un perfil de tolerabilidad más favorable (pero un perfil de costes menos favorable): complejos de polisacáridos de maltol férrico y formulaciones férricas liposomales [8].
Ya 14 días después del inicio de la sustitución, debe haber un aumento de la hemoglobina de ≥1 g/dl. Si no es así, debe cambiarse a un preparado intravenoso [9]. Tras la normalización de los niveles de hemoglobina, la sustitución oral debe continuarse durante al menos tres meses para reponer las reservas de hierro.
Sustitución intravenosa
La sustitución intravenosa debe preferirse en pacientes tumorales con trastornos probados de la utilización del hierro y eritropoyesis deficiente en hierro o anemia ferropénica. Especialmente en caso de terapia simultánea con sustancias estimulantes de la eritropoyesis, es aconsejable el uso preferente de formulaciones intravenosas para una suplementación eficaz [3].
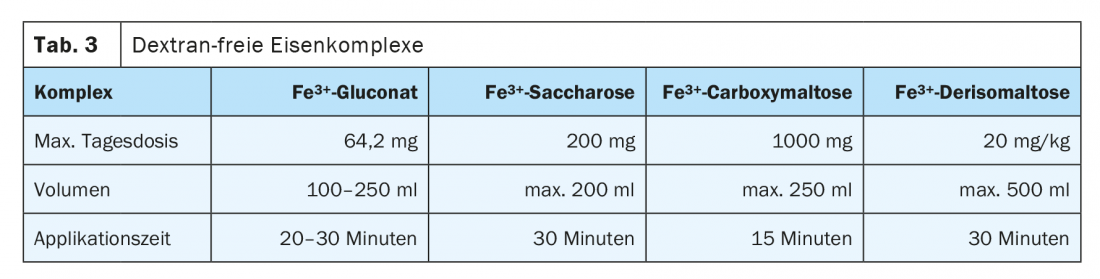
Existe un riesgo de reacción anafiláctica con todos los preparados parenterales de hierro debido a los compañeros que se unen al Fe, pero es muy bajo con las sustancias modernas. La Agencia Europea del Medicamento (EMA) ya determinó en 2013 en un procedimiento de evaluación de riesgos que los beneficios superan sus posibles riesgos. El riesgo es mayor con los preparados que contienen dextrano, por lo que deben preferirse los preparados sin dextrano. Existe un perfil de efectos secundarios significativamente más favorable para el gluconato férrico, el hidróxido férrico sacarosa y la carboximaltosa férrica. Se trata de nanopartículas disueltas coloidalmente. Estos son captados y descompuestos en el hígado y el bazo por el sistema reticuloendotelial. El hierro liberado es almacenado o distribuido en el organismo por la transferrina. La administración intravenosa debe realizarse preferentemente en infusión corta. Una aplicación demasiado rápida puede superar la capacidad de unión de la transferrina y provocar síntomas de enrojecimiento. El volumen de aplicación, la cantidad de hierro ligado en complejo por infusión y la dosificación única frente a la múltiple difieren significativamente y determinan la frecuencia de la terapia y los intervalos de control. En La tabla 3 enumera varios preparados sin dextrano que pueden administrarse por vía intravenosa.
Transfusión de concentrados de hematíes
La indicación de una transfusión se realiza en función del estado clínico, los factores de riesgo del paciente, la gravedad de los síntomas de la anemia, el valor de Hb (o hematocrito), el carácter agudo de la pérdida de sangre y las posibilidades de compensación [4]. En pacientes con pérdida aguda de sangre, tumor sólido o hemoblastosis, la indicación de transfusión debe comprobarse a partir de un valor de hemoglobina ≤8 g/dl. Los pacientes con anemia crónica tienen a veces valores de Hb entre 6 – 8 g/dl sin ningún síntoma y, por lo tanto, sin ninguna indicación convincente de transfusión. En los pacientes de con enfermedad cardiaca o pulmonar concomitante, el nivel de hemoglobina debe estabilizarse en 10 g/dl.
Terapia con agentes estimulantes de la eritropoyesis
Para la anemia inducida por la quimioterapia, agentes estimulantes de la eritropoyesis (AEE) están aprobados para la anemia sintomática con un valor de Hb -≤10 g/dl [4]. La combinación de AEE y suplementos de hierro intravenoso durante la quimioterapia puede reducir significativamente el número de transfusiones de sangre [10]. El momento de administrar los suplementos de hierro debe preceder a la terapia con AEE. Sin embargo, deben tenerse muy en cuenta los riesgos en términos de perfil de riesgo trombofílico y el beneficio individual de la terapia con AEE para el paciente [11].
Otros enfoques terapéuticos para la deficiencia funcional de hierro en pacientes tumorales, como la terapia androgénica o el uso de antagonistas de la hepcidina y de la proteína morfogenética ósea (BMP), son actualmente objeto de investigación clínica [12].
Resumen
La carencia de hierro y la anemia son difíciles de considerar por separado en los pacientes oncológicos. Tanto la anemia como la carencia de hierro suelen tener varias causas subyacentes. Por lo tanto, siempre es importante excluir o tratar otras causas no específicas del tumor. La mayoría de los pacientes oncológicos corren el riesgo de sufrir malnutrición, por lo que debería realizarse en una fase temprana un estudio cualificado del estado nutricional y un asesoramiento periódico sobre nutrición durante el tratamiento oncológico. Sin embargo, la mayoría de los pacientes desarrollan una deficiencia de hierro a pesar de una ingesta oral optimizada. En el caso de una carencia de hierro causada por una hemorragia crónica y una inflamación crónica, la mayor necesidad del organismo no puede ni debe satisfacerse mediante la sustitución oral.
La quimioterapia suprime la eritropoyesis y la secreción de eritropoyetina del propio organismo no es suficiente para satisfacer las necesidades de estimulación en equilibrio eritropoyético negativo permanente. La terapia de transfusión sólo debe utilizarse para la corrección inmediata de la anemia (hemorragia, riesgo cardiocirculatorio) debido a los efectos tóxicos y al potencial pronóstico negativo. La suplementación con hierro intravenoso es la terapia preferida para prevenir o corregir la anemia.
Mensajes para llevarse a casa
- Si se diagnostica una enfermedad maligna por primera vez, debe realizarse un análisis del sustrato de la eritropoyesis y un diagnóstico de la anemia.
- La Hb, el estado del hierro (TSAT, ferritina sérica) y la PCR deben determinarse al inicio y antes de cada ciclo de quimioterapia.
- La deficiencia funcional de hierro en pacientes con cáncer se caracteriza por una utilización deficiente de las reservas intrínsecas de hierro.
- El hierro oral sólo debe considerarse en pacientes con carencia absoluta de hierro (ferritina <30 ng/ml) y estado no inflamatorio (PCR <5 mg/l).
- La suplementación de hierro intravenoso es la terapia de hierro preferida en el paciente oncológico.
Literatura:
- Finberg KE: Regulación de la homeostasis sistémica del hierro. Opinión actual en hematología 2013; 20(3): 208-214.
- Ludwig HE, et al: Metabolismo del hierro y suplementos de hierro en pacientes con cáncer. Wien Klin Wochenschr 2015; 127(23-24): 907-919.
- Hastka J, et al: Carencia de hierro y anemia ferropénica. Onkopedia Leilinien 2020; www.onkopedia.com/de/onkopedia/guidelines/eisenmangel-und-eisenmangelanaemie/@@guideline/html/index.html, consultado el 29.06.2020.
- Jordan K, et al.: Richtlinienprogramm Onkologie (Deutsche Krebsgesellschaft, Deutsche Krebshilfe, AWMF): Supportive Therapie bei onkologischen PatientenInnen – Langversion 1.3.2020; www.leitlinienprogrammonkologie.de/leitlinien/supportive-therapie, consultado el 29.06.2020.
- Ludwig H, et al: Prevalencia de la deficiencia de hierro en diferentes tumores y su asociación con el mal estado funcional, el estado de la enfermedad y la anemia. Anales de oncología: revista oficial de la Sociedad Europea de Oncología Médica/ESMO 2013; 24(7): 1886-1892.
- Ludwig H, et al: The European Cancer Anaemia Survey (ECAS): a large, multinational, prospective survey defining the prevalence, incidence, and treatment of anaemia in cancer patients. Eur J Cancer 2004; 40(15): 2293-2306.
- Xu H, et al: Incidencia de la anemia en pacientes diagnosticados de tumores sólidos que reciben quimioterapia, 2010-2013. Clin Epidemiol 2016; 8: 61-71.
- Farrag K, et al: Nuevas opciones para la sustitución oral del hierro. Farmacoterapia 2019; 37(4): 105-112.
- Okam MM, et al: Suplementación con hierro, respuesta en la anemia ferropénica: análisis de cinco ensayos. The American journal of medicine 2017; 130(8): 991 e991-991 e998.
- Bastit L, et al: Ensayo aleatorizado, multicéntrico y controlado que compara la eficacia y la seguridad de la darbepoetina alfa administrada cada 3 semanas con o sin hierro intravenoso en pacientes con anemia inducida por la quimioterapia. Revista de oncología clínica: revista oficial de la Sociedad Americana de Oncología Clínica 2008; 26(10): 1611-1618.
- Aapro M, et al: Tratamiento de la anemia y la ferropenia en pacientes con cáncer: Guías de práctica clínica de la ESMO. Anales de oncología: revista oficial de la Sociedad Europea de Oncología Médica/ESMO 2018; 29(Suppl 4): iv96-iv110.
- Gilreath JA, Rodgers GM: Cómo tratar la anemia oncológica. Sangre 2020; doi: 10.1182/blood.2019004017.
InFo ONCOLOGÍA Y HEMATOLOGÍA 2020; 8(6): 10-15