Un equipo de investigación internacional en el que participaron los hospitales universitarios de Lausana y Zúrich comparó distintos métodos de diagnóstico en un estudio retrospectivo a gran escala. En consonancia con los resultados empíricos anteriores, la conclusión del estudio es que los métodos moleculares son superiores a los diagnósticos fúngicos convencionales cuando se sospecha una onicomicosis.
Con una prevalencia estimada del 4-9% en la población general, las onicomicosis son la causa más común de aspecto anormal del aparato ungueal [1,2]. La identificación rápida y fiable del patógeno es crucial para iniciar la terapia adecuada lo antes posible. En comparación con los métodos de diagnóstico convencionales, los métodos moleculares son más rápidos y tienen una mayor precisión en la identificación de especies. Las herramientas de diagnóstico molecular disponibles en la actualidad difieren principalmente en los métodos de extracción del ADN, los cebadores PCR utilizados y los productos del análisis PCR [3]. En comparación con los métodos de diagnóstico convencionales, los métodos moleculares son más rápidos (hallazgos en un día) y tienen una mayor precisión, lo que resulta muy atractivo para su aplicación en la práctica clínica [4].
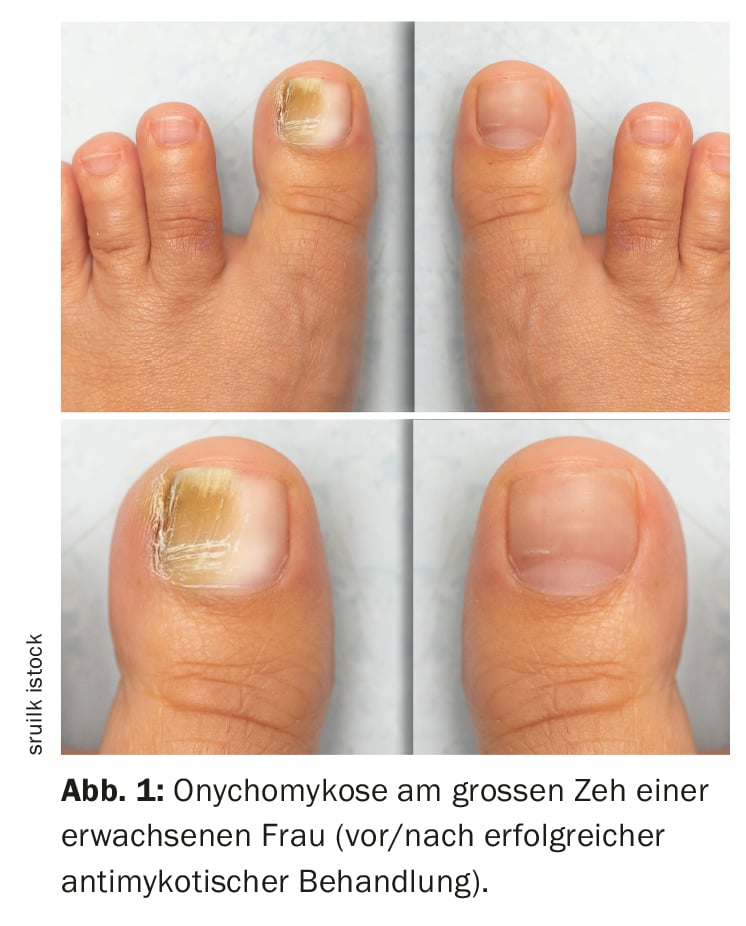
Microscopía de fluorescencia y cultivo de hongos frente a secuenciación PCR
Se examinaron un total de 16 094 muestras de uñas mediante microscopía de fluorescencia directa [1]. Además, se obtuvieron dos cultivos de hongos de cada muestra utilizando agar dextrosa Sabouraud con cloranfenicol (50 μg/mL) y cloranfenicol más cicloheximida (400 μg/mL). Por microscopía de fluorescencia directa, se detectaron elementos fúngicos en el 68,1% de las muestras de uñas; por cultivo fúngico, la tasa de detección fue del 28,7%. Los dos métodos mostraron una concordancia global del 58,4%. La mayoría de los resultados desviados procedían de muestras con resultados positivos en microscopía directa pero cultivo fúngico negativo. En un total del 59,5% de las muestras en las que se detectaron elementos fúngicos mediante microscopía de fluorescencia, el cultivo de hongos fue negativo. Entre los pacientes con un resultado positivo en el cultivo de hongos, los dermatofitos representaron la mayor proporción (47,9%), siendo el Trichophyton rubrum el patógeno más común, seguido de los “mohos no dermatofitos” (MND) (29,1%), las levaduras (21,8%) y las infecciones mixtas (1,2%). En 1148 casos, el diagnóstico fúngico convencional mediante microscopía de fluorescencia y cultivo fúngico resultó insuficiente, por lo que se recurrió a una aclaración adicional de diagnóstico molecular (Tab. 1) [1].
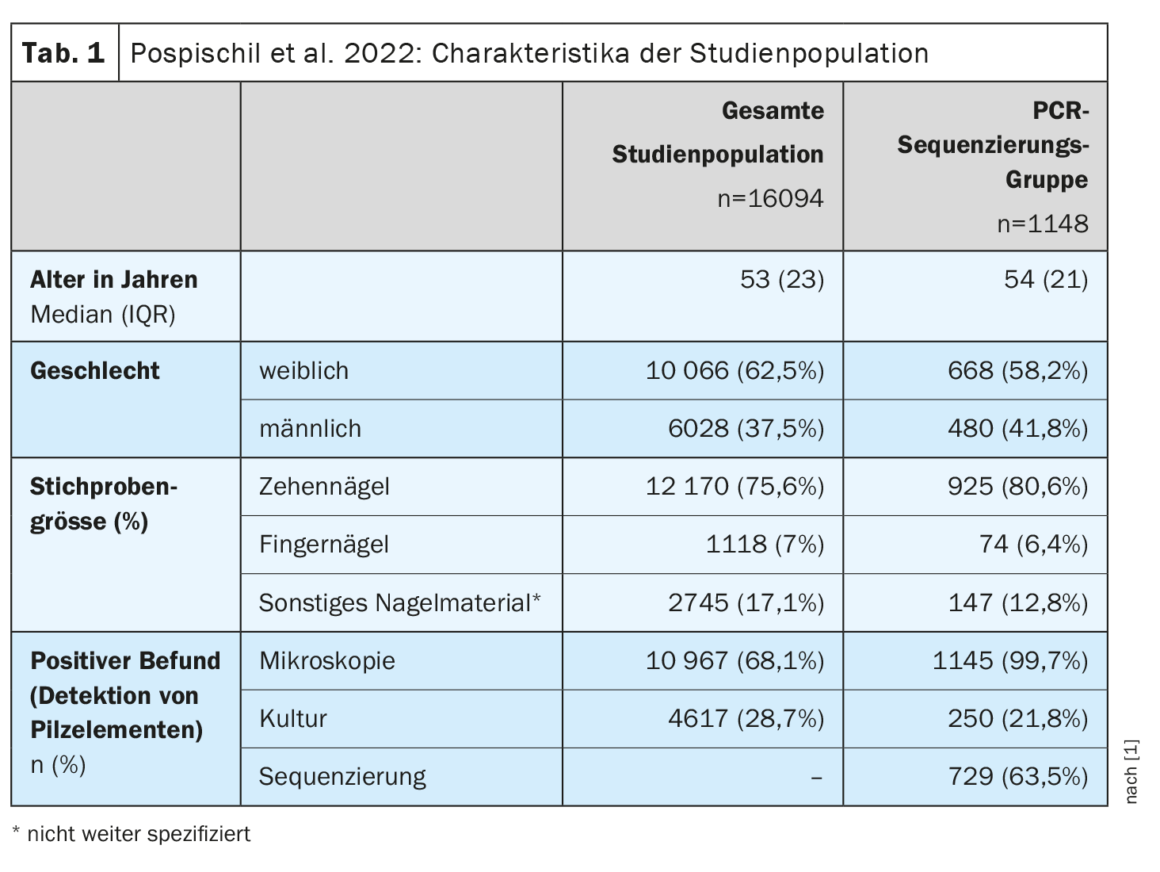
El cultivo de hongos sólo detectó hongos patógenos en el 21,8% de los casos, por lo que mostró una baja sensibilidad, mientras que la secuenciación por PCR demostró ser claramente superior con una tasa de detección del 63,5%. La distribución de frecuencias de los diferentes elementos fúngicos identificados mediante secuenciación PCR fue la siguiente: NDMs 67,6%, levaduras 26%, dermatofitos 4,8% e infecciones mixtas 1,6%.
| El estudio de cohortes retrospectivo incluyó muestras de uñas de pacientes que habían sido remitidos al laboratorio especializado en dermatomicología del departamento de dermatología del Hospital Universitario de Lausana (CHUV) en 2013-2018 debido a una sospecha clínica de onicomicosis. En todos los casos en los que los diagnósticos micológicos convencionales no arrojaron resultados claros, se llevó a cabo la secuenciación por PCR. según [1] |
Literatura:
- Pospischil I, et al.: Identification of Dermatophyte and Non-Dermatophyte Agents in Onychomycosis by PCR and DNA Sequencing-A Retrospective Comparison of Diagnostic Tools. Journal of Fungi 2022; 8(10): 1019.
- Sigurgeirsson B, Baran R: La prevalencia de la onicomicosis en la población mundial – Un estudio bibliográfico. JEADV 2014; 28: 1480-1491.
- Verrier J, Monod M: Diagnóstico de las dermatofitosis mediante biología molecular. Mycopathologia 2017; 182: 193-202.
- Petinataud D, et al: Diagnóstico molecular de la onicomicosis. J Mycol Med 2014; 24: 287-295.
PRÁCTICA DERMATOLÓGICA 2023; 33(1): 39