El aumento de la edad de la población y los gratificantes avances en la terapia oncológica hacen que los reumatólogos se enfrenten cada vez más a pacientes que padecen una enfermedad maligna previa pero que necesitan una terapia básica basada en directrices. Las terapias básicas suelen ser inmunosupresoras y una de las principales tareas del sistema inmunitario es reconocer y eliminar las células malignas. En consecuencia, a médicos y pacientes les preocupa que la terapia básica aumente el riesgo de recidiva tumoral.
El aumento de la edad de la población y los gratificantes avances en la terapia oncológica hacen que los reumatólogos se enfrenten cada vez más a pacientes que padecen una enfermedad maligna previa pero que necesitan una terapia básica basada en directrices. Las terapias básicas suelen ser inmunosupresoras y una de las principales tareas del sistema inmunitario es reconocer y eliminar las células malignas. En consecuencia, a médicos y pacientes les preocupa que la terapia básica aumente el riesgo de recidiva tumoral. Especialmente en el caso de los inhibidores del factor de necrosis tumoral, esta preocupación se ve alimentada por una denominación desafortunada.
Creciente abundancia de datos, difícil interpretación
Para poder tomar estas decisiones terapéuticas, suele ser de poca ayuda el impresionante y apasionante caudal de datos sobre experimentos in vitro o modelos animales sobre la interacción entre las células tumorales y el sistema inmunitario. Como ya se ha mencionado, la vigilancia de los tumores es una función importante del sistema inmunitario; los procesos inflamatorios conducen a la destrucción de las células degeneradas. Por otro lado, la inflamación también puede contribuir a la proliferación tumoral e inhibir la vigilancia tumoral. Se sabe que la inflamación crónica aumenta el riesgo de linfoma [1]. Existen observaciones similares para determinados tumores sólidos en función del estadio tumoral [2–4]. Dependiendo del microentorno, los mismos grupos celulares o citocinas pueden tener efectos muy diferentes, es decir, tanto inhibidores como promotores del tumor. Por ejemplo, el TNF-alfa, que por lo demás se conoce principalmente como una citocina inhibidora de tumores, puede estimular las células T reguladoras en el cáncer de ovario, que se asocian a un mayor riesgo de progresión porque probablemente suprimen la vigilancia del tumor [5].
Los estudios que, por lo demás, aportan las mejores pruebas en medicina, a saber, los ensayos controlados aleatorios, sólo son adecuados en una medida muy limitada, incluso tras el metaanálisis, para aclarar la cuestión de si el preparado respectivo aumenta el riesgo de recidiva tumoral. Hay varias razones para ello:
- El cálculo del número de casos y el diseño de los estudios de registro están orientados principalmente a la prueba de la eficacia. Como resultado, el número de casos es demasiado pequeño y el seguimiento demasiado corto para captar ciertos aspectos de la seguridad.
- Las enfermedades malignas son acontecimientos poco frecuentes que suelen aparecer tras un largo periodo de latencia. Bajo ciclofosfamida, estas latencias se sitúan entre 10 y 15 años.
- Las enfermedades previas malignas (a excepción de los cánceres de piel no melanocíticos) y, a menudo, la edad avanzada son criterios de exclusión. Tampoco es infrecuente que los pacientes mayores tengan comorbilidades o limitaciones logísticas, por lo que los pacientes con alto riesgo de cáncer suelen estar infrarrepresentados en los estudios.
Existen relativamente pocos estudios que se centren principalmente en el riesgo de recidiva tumoral durante la terapia inmunosupresora. Se trata de evaluaciones de registros nacionales o bases de datos de seguros. Sin embargo, dado que en estos estudios son los propios médicos participantes los que determinan qué terapia recibe un paciente con una enfermedad maligna previa, pueden producirse falsificaciones en el sentido de que los preparados que el médico considera que tienen un alto potencial promotor de tumores se utilicen con más precaución en pacientes con un alto riesgo de recidiva tumoral. En el análisis estadístico de estos estudios, se intenta contrarrestar este sesgo ajustando los factores de riesgo habituales de recidiva tumoral (por ejemplo, el estadio inicial del tumor). La ventaja de las bases de datos de seguros es el elevado número de casos, la desventaja es la falta de información detallada sobre el paciente individual, lo que dificulta considerablemente el ajuste.
A falta de pruebas directas sobre el riesgo de recidiva tumoral, para la mayoría de los preparados uno intenta orientarse por el riesgo de aparición de nuevas neoplasias malignas incidentes en ensayos aleatorios, registros y bases de datos de seguros y extrapola este riesgo al riesgo de recidiva.
En vista de estas limitaciones en la situación de los datos, también se presentan otras posibilidades para adquirir conocimientos:
- Uno de ellos se centra en los estudios sobre la terapia inmunosupresora en poblaciones de riesgo que tienen una mayor probabilidad de malignidad: por ejemplo, pacientes con afecciones precancerosas como la neoplasia intraepitelial cervical o las gammapatías monoclonales.
- En los estudios en los que se utilizan diferentes dosis, puede investigarse un efecto dosis.
- Los cánceres cutáneos no melanocíticos (CPNM) son neoplasias malignas que aparecen con mayor frecuencia y en las que se han observado diferencias incluso en estudios con un seguimiento más corto [6]. Estas entidades podrían servir como un sustituto limitado del riesgo general de cáncer, especialmente porque no suelen ser criterios de exclusión para los ensayos controlados aleatorios. Sin embargo, los CPNM a menudo no se recogen en su totalidad ni siquiera en los estudios, razón por la que suelen excluirse de las consideraciones de riesgo de malignidad.
Al examinar los estudios sobre la incidencia de enfermedades malignas, se presta especial atención al grupo de control correspondiente. Las comparaciones con la población normal son menos útiles, ya que las enfermedades inflamatorias reumatoides suelen presentar una mayor incidencia de ciertos tumores malignos independientemente de las influencias de la terapia, como el carcinoma bronquial en la artritis reumatoide [7], los linfomas en el síndrome de Sjögren [8] y el carcinoma cervical en el lupus eritematoso sistémico [9].
Declaraciones en directrices y recomendaciones
Existen numerosas directrices nacionales e internacionales para la terapia de la artritis reumatoide, que tratan el tema de la anamnesis maligna con mayor o menor detalle [10]. Las recomendaciones más claras a este respecto fueron formuladas por el Colegio Americano de Reumatología en 2012 y 2015 [11,12]. En las recomendaciones más antiguas, de 2012, se seguía distinguiendo -como en la mayoría de las demás directrices- si el intervalo entre el final de la terapia tumoral curativa y el inicio de la terapia básica era de más o de 5 años como máximo. En aquel momento, sólo se podía hacer referencia al momento habitual de mayor probabilidad de recidiva tumoral y a los datos del campo del trasplante de órganos [13]. Más allá de los 5 años, cualquier terapia biológica (principalmente los inhibidores del TNF en ese momento) se consideraba segura. Dentro de los 5 años, se dio preferencia al rituximab sin que los estudios pudieran justificarlo en ese momento, con la excepción de las neoplasias de células B CD20+. El único estudio publicado hasta la fecha del campo de la hematooncología, incluso con todos los problemas metodológicos, tendía a indicar que los pacientes que recibieron rituximab además de un trasplante autólogo de células madre tenían un mayor riesgo de neoplasias malignas secundarias que los pacientes sin tratamiento con rituximab [14]. Sólo posteriormente se publicaron análisis de registros que muestran realmente que el rituximab es relativamente poco problemático, como se explica a continuación.
Sin embargo, en la versión más reciente de las recomendaciones del ACR, de 2015, se abandonó la distinción entre terapia tumoral y reumatoide en función del intervalo. Por lo tanto, en los pacientes con una neoplasia maligna sólida, la terapia básica puede tratarse sin restricciones como en los pacientes con AR sin antecedentes de neoplasia maligna. Por lo demás, se realizaron priorizaciones de DMARD para el cáncer de piel y las enfermedades linfoproliferativas tan carentes de pruebas o tan contrarias a las pruebas no citadas disponibles en ese momento que no se reproducirán aquí. Sin embargo, a continuación se expondrá el hecho de que estos dos grupos de enfermedades malignas requieren una atención especial.
Pruebas directas sobre el riesgo de recidiva tumoral bajo terapia reumatológica
En los registros nacionales de pacientes con AR, los pacientes con antecedentes de neoplasia maligna se compararon en términos de estudios de casos y controles con pacientes que tenían terapias de base similares y sin antecedentes de neoplasia maligna. En la mayoría de los casos, se intentó ajustar los factores de riesgo de recidiva tumoral, como la actividad de la enfermedad o la obesidad. Los primeros datos significativos proceden del registro alemán RABBIT [15] y del Registro Biológico del Reino Unido [16]. Además, cabe mencionar los análisis del registro estadounidense CORRONA [17], el registro danés DANBIO [18] y -de reciente publicación- el registro sueco ARTIS [19]. Recientemente, Xie y sus colegas publicaron un metaanálisis de 11 estudios, que incluye los registros mencionados [20]. Los datos sólo son utilizables para los inhibidores del TNF y el rituximab. Afortunadamente, no se observó un mayor riesgo de recaída con los inhibidores del TNF o el rituximab en comparación con los pacientes que recibieron terapias básicas sintéticas convencionales (csDMARD). Cabe señalar que en la mayoría de los estudios el intervalo entre la terapia oncológica y la reumatológica fue por término medio significativamente superior a 5 años, con dos excepciones: El rituximab se utilizó antes en el registro alemán, siguiendo la recomendación más antigua del ACR, y el registro danés permitió comparar pacientes con un intervalo a la terapia con inhibidores del TNF de más o menos de 5 años. Aquí, numéricamente, hubo incluso un riesgo ligeramente inferior de recidiva tumoral con un intervalo más corto, incluso tras el ajuste por estadios tumorales iniciales. Sin embargo, aquí se demostró que los médicos participantes en el registro utilizaban en realidad más los biológicos para estadios tumorales inicialmente más bajos. Un metaanálisis de 16 estudios en diferentes enfermedades autoinmunes (AR, enfermedad inflamatoria intestinal y psoriasis) tampoco logró demostrar una diferencia estadísticamente significativa en la recurrencia de tumores a intervalos superiores o inferiores a 6 años. El análisis se refería principalmente a los inhibidores del TNF, las tiopurinas y el metotrexato [21]. Sin embargo, dado que la mayoría de los datos de los registros muestran intervalos largos entre la terapia oncológica y la reumatológica por término medio y que los estudios de registro pueden estar sujetos a un sesgo considerable, la duración del intervalo debe incluirse de todos modos en la decisión sobre la terapia reumatológica.
Probablemente, el estudio más informativo sobre el riesgo de recidiva tumoral con un intervalo corto es el análisis de los datos del seguro estadounidense con un número muy elevado de casos realizado por Mamtani y sus colegas [22]. Se trataba de pacientes con artritis reumatoide (>90%) o enfermedad inflamatoria intestinal que recibieron metotrexato, tiopurinas, inhibidores del TNF, combinaciones de éstos o ninguna terapia básica tras la cirugía curativa del carcinoma de mama. En más del 90% de las pacientes, los inhibidores del TNF se reiniciaron en el plazo de un año tras la cirugía e incluso con la administración continua de inhibidores del TNF no se observó un aumento del riesgo de recidiva del cáncer de mama. Sin embargo, el seguimiento fue sólo de 3,4 años. Dado que las recidivas del carcinoma de mama pueden producirse mucho más tarde de 5 años después de la cirugía, hasta ahora se ha aconsejado especial precaución y un enfoque de espera para iniciar la terapia básica. Este estudio puede utilizarse hasta cierto punto como argumento en contra de esta valoración. El registro del Reino Unido tampoco mostró una mayor incidencia de nuevos carcinomas de mama con los TNFIs en comparación con los csDMARDs en un número relativamente grande de casos [23].
Datos sobre sustancias individuales
Una descripción detallada de los datos sobre todas las sustancias utilizadas habitualmente en reumatología excedería el ámbito de este artículo de revisión. Por lo tanto, a continuación se evaluará la situación de los datos de forma resumida según la tabla 1 y el riesgo tumoral de las sustancias individuales o grupos de sustancias. Sólo se cita bibliografía actual. Para una lectura más profunda, remitimos aquí a reseñas significativas [24–27].

Debe mencionarse desde el principio que sólo en el caso de la ciclofosfamida existe una señal clara de un aumento del riesgo tumoral o del riesgo de recidiva tumoral, y eso sólo a dosis acumuladas más altas. Es probable que las terapias inmunomoduladoras o inmunosupresoras, por otra parte habituales en reumatología, tengan como mucho una influencia menor -y en algunas situaciones incluso favorable- sobre estos riesgos. Con cada vez más pruebas, el panorama positivo tiende a confirmarse.
En la tabla 2, con el trasfondo de la bibliografía pertinente, se intentó evaluar hasta qué punto las sustancias individuales de la terapia reumatológica podrían tener un efecto sobre el riesgo de aparición de nuevas neoplasias o recidivas de neoplasias. Aunque se trata de una simplificación considerable de un tema complejo, debería servir como orientación rápida y como punto de partida para posteriores debates e investigaciones. El juicio global sobre una sustancia debe referirse siempre tanto a la calidad de los datos como a los indicios de riesgo maligno que se desprendan de ellos. Por ello, en caso de duda, es preferible elegir el que disponga de mejores datos para sustancias alternativas con un riesgo probablemente bajo.
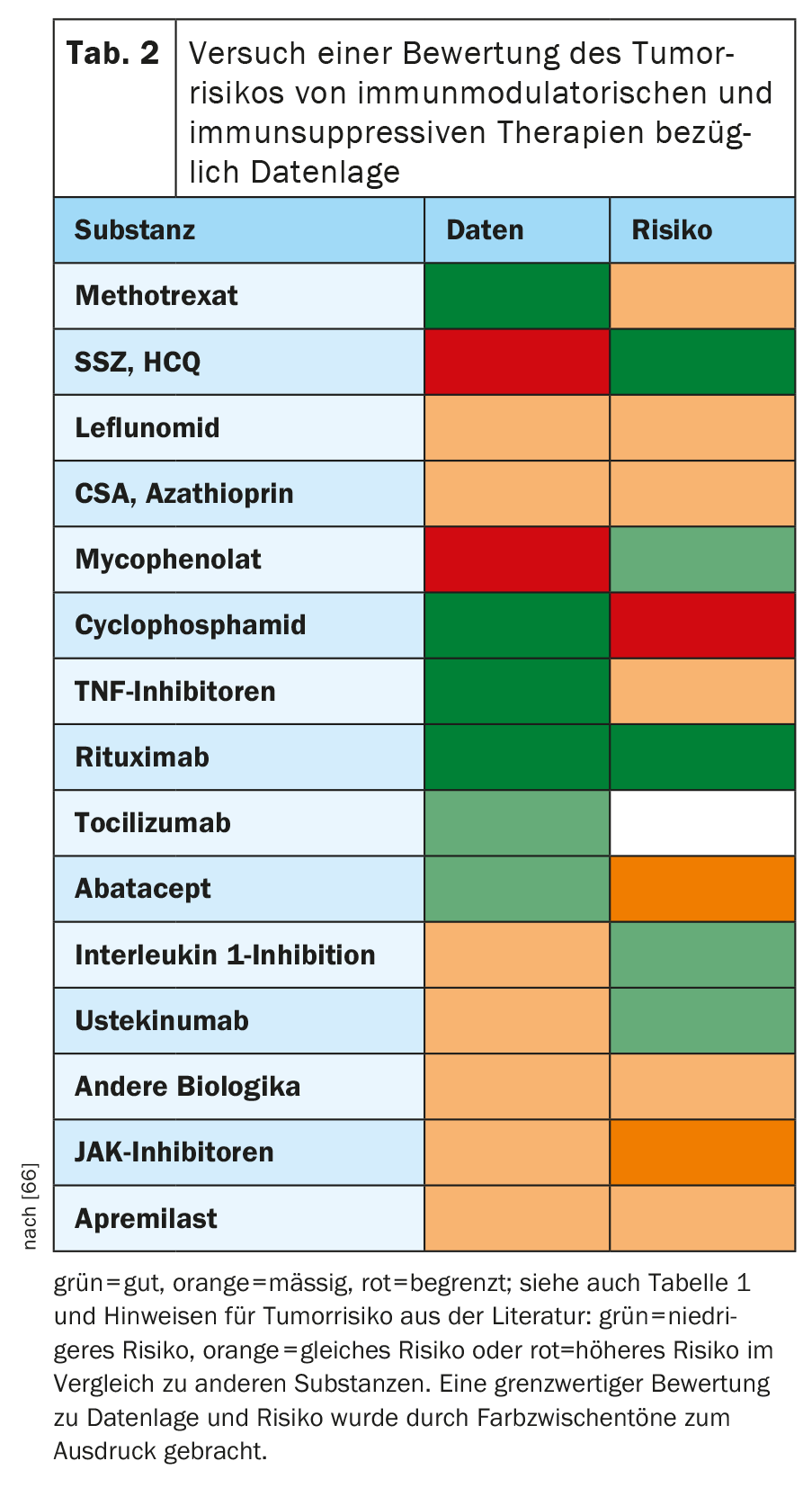
Metotrexato: Situación de los datos: buena.
El metotrexato se utiliza como terapia de mantenimiento para la leucemia linfática aguda. Debe asumirse un riesgo acumulativo ligeramente mayor en función de la dosis de cáncer de piel no melanocítico, lo que también se demostró de nuevo en el gran estudio aleatorizado sobre el uso de metotrexato en pacientes con riesgo cardiovascular [28,29]. La acumulación de enfermedades linfoproliferativas descritas principalmente por autores japoneses, que a veces remiten espontáneamente tras la interrupción del metotrexato [30], no se confirma en la sinopsis de otros datos de registro detallados [31].
Leflunomida, hidroxicloroquina, sulfasalazina: Situación de los datos: moderada para la leflunomida, deficiente para la hidroxicloroquina y la sulfasalazina.
La leflunomida tiene efectos inhibidores tumorales, al menos in vitro. La agrupación numérica del cáncer de páncreas en el registro RABBIT bajo leflunomida no se encontró en otros registros [32].
En el caso de la hidroxicloroquina, un estudio realizado en LES y con bajo número de eventos malignos sugiere un efecto protector frente a las neoplasias [33]. Un estudio reciente sobre las colagenosis sólo sugiere un efecto beneficioso sobre la incidencia de la enfermedad tumoral metastásica [34]. Se discuten las terapias oncológicas en combinación con la hidroxicloroquina debido al efecto sobre la autofagocitosis.
La sulfasalazina, al igual que la mesalazina, puede reducir el riesgo de cáncer de colon en la colitis ulcerosa [35].
Apremilast: Situación de los datos: moderada.
Los informes de efectos adversos de la FDA sugieren que el apremilast tiene un riesgo tumoral aún menor que el ustekinumab [36]. Al igual que la hidroxicloroquina y la sulfasalazina, parece poco probable un efecto desfavorable sobre el desarrollo tumoral, aunque sólo sea por el mecanismo de acción.
Azatioprina, ciclosporina A, micofenolato: Situación de los datos: moderada.
Existen indicios de que la terapia combinada de azatioprina con infliximab podría provocar un aumento de la incidencia de los muy raros linfomas hepatoesplénicos de células T en hombres con enfermedad inflamatoria intestinal [37]. La agrupación de neoplasias mieloides por azatioprina en diferentes enfermedades autoinmunes postulada en un estudio publicado recientemente no se encontró en otros estudios y probablemente se deba a que se compararon poblaciones muy heterogéneas [38]. Tanto para la azatioprina como para la ciclosporina A, el riesgo de CPNM parece aumentar [39], para la CSA especialmente en asociación con la fototerapia para la psoriasis [40]. Los datos sobre la azatioprina procedentes de diferentes registros sobre la incidencia del cáncer general, el carcinoma urotelial y el linfoma son contradictorios, aunque no emerge ninguna señal fuerte. En el caso del MMF, existen principalmente estudios procedentes del campo del trasplante de órganos. En este caso, el riesgo de cáncer parece ser algo menor en general para los tumores cutáneos y para los trastornos linfoproliferativos postrasplante en comparación con otros regímenes inmunosupresores postrasplante [41].
Ciclofosfamida: Situación de los datos: buena.
Dependiendo de la dosis acumulada de ciclofosfamida, aumenta el riesgo de nuevas neoplasias o recidivas tumorales. La mayoría de los estudios señalan valores entre 20 y 30 g como el límite a partir del cual este riesgo se calcula como significativamente aumentado [42]. Un estudio de pacientes con LES en Corea del Sur llegó a constatar un mayor riesgo de incidencia de neoplasias con una dosis acumulada de >6 g [43]. Sin embargo, ni siquiera este valor se alcanza con los protocolos modernos de ciclofosfamida, como el protocolo Euro-Lupus.
Biológicos
Inhibidores del TNF: Situación de los datos: muy buena.
Cabe sospechar un ligero aumento del riesgo de CPNM [44]. La cuestión de si existe un mayor riesgo de melanoma maligno con el TNFI fue objeto de debate controvertido durante mucho tiempo sin que surgieran señales claras. Un análisis de 11 registros europeos de AR [45] y el análisis más reciente del registro australiano ARAD [46] para pacientes con AR no encontraron pruebas de un aumento del riesgo. Varios estudios no encontraron un aumento significativo del riesgo de progresión de una dispalsia intraepitelial cervical conocida a un carcinoma cervical con TNFI [47]. Un análisis reciente de datos de seguros estadounidenses sugiere un mayor riesgo de linfoma [48], que no se encontró en estudios de varios registros nacionales [49]. Los datos importantes y tranquilizadores sobre los estudios del riesgo de recidiva tumoral bajo TNFI se han presentado anteriormente. En este contexto, resultan interesantes los datos procedentes del campo de las terapias inmuno-oncológicas con los llamados inhibidores de los puntos de control (ICPI): Los modelos de ratón [50,51] y una primera serie de casos [52] sugieren que la combinación de ICPI con TNFI no sólo podría conducir a una menor tasa de efectos secundarios inmunomediados, sino también a un mejor control tumoral.
Rituximab: Situación de los datos: muy buena.
Aunque el rituximab se ha utilizado durante mucho tiempo en Alemania de acuerdo con las antiguas recomendaciones de la ACR relativamente poco después de la terapia tumoral curativa, no existen pruebas en la literatura sobre enfermedades reumatológicas (especialmente la AR) de un mayor riesgo de recidiva tumoral o de nuevas neoplasias. Los datos favorables del registro sobre el riesgo de recidiva tumoral se presentaron anteriormente.
Tocilizumab, Sarilumab: Situación de los datos: buena para el tocilizumab, limitada para el sarilumab.
El tocilizumab se utiliza terapéuticamente en diferentes situaciones terapéuticas en oncología: Tratamiento de la enfermedad de Castleman (aprobación en Japón), tratamiento de la tormenta de citocinas tras la terapia con células T CAR (aprobación), tratamiento de los efectos secundarios inmunomediados de los inhibidores de los puntos de control (series de casos, opinión de expertos) [53]. Las consideraciones sobre el mecanismo de acción que arrojan una luz favorable sobre el tocilizumab en el contexto de las enfermedades malignas no deben sobreinterpretarse. Un amplio análisis de las bases de datos de seguros de EE.UU. no encontró al menos un mayor riesgo de eventos malignos en la AR con tocilizumab en comparación con TNFI o abatacept, con NMSC excluido del análisis [54].
Abatacept: Situación de los datos: buena.
Una vez más, no deben sobreinterpretarse las consideraciones sobre el mecanismo de acción, que es exactamente opuesto al del inhibidor del punto de control ipilimumab. Sin embargo, un gran estudio de registro [55] y un análisis de datos de seguros de EE.UU. [56] sugieren un mayor riesgo de CPNM incluso en comparación con otros biológicos. En cuanto a la incidencia global del cáncer y del melanoma, los datos son contradictorios [57].
Secukinumab, ixekizumab: Situación de los datos: moderada para secukinumab, limitada para ixekizumab.
Las vías de señalización de la IL17 pueden ser teóricamente tanto promotoras como inhibidoras de tumores. La argumentación de la directriz alemana S3 para el tratamiento de la psoriasis, que da preferencia a secukinumab y ustekinumab sobre los TNFI en caso de enfermedad previa maligna, no parece concluyente con respecto a secukinumab [58]. Los datos sobre el supuesto aumento del riesgo de tumores con los TNFI se sobreinterpretan aquí y se contrastan con los datos sobre secukinumab, que no muestran ninguna prueba de aumento de la incidencia de cáncer, pero que tampoco son adecuados para investigar esta cuestión debido al bajo número de casos y al breve seguimiento.
Ustekinumab: Situación de los datos: buena.
En una evaluación del registro PSOLAR sobre el tratamiento de la psoriasis, el ustekinumab y el metotrexato mostraron un menor riesgo global de cáncer en comparación con los TNFi [59]. Esto apoyaría la recomendación antes mencionada de la directriz alemana sobre psoriasis, pero idealmente debería confirmarse en otros estudios y situaciones terapéuticas, sobre todo porque los datos ya mencionados y difíciles de interpretar de los informes de efectos secundarios de la FDA hablan de un riesgo mayor en comparación con el apremilast.
Anakinra, canakinumab: Situación de los datos: de moderada a buena.
La anakinra se utiliza para la terapia del síndrome de Schnitzler. En esta enfermedad, existe una asociación de vasculitis urticarial con gammapatía monoclonal de significado incierto, que es una afección precancerosa. En el estudio CANTOS, los pacientes con PCR elevada tras un infarto de miocardio recibieron canakinumab o placebo [60]. Aunque se cumplió el criterio de valoración primario, este estudio no condujo a la aprobación para esta indicación, pero se observó una menor incidencia de carcinoma bronquial en el brazo del estudio. De hecho, la interleucina-1 puede tener efectos promotores de tumores. Esta observación está siendo objeto de seguimiento en un programa de estudios oncológicos.
Belimumab: Situación de los datos: moderada.
No se dispone de resultados separados sobre el riesgo de enfermedades malignas.
Inhibidores JAK: Situación de los datos: buena para el tofacitinib, moderada para el baricitinib, limitada para el upadacitinib.
La consideración del riesgo tumoral de los inhibidores JAK debe estar especialmente fundamentada ahora y en el futuro, ya que se trata de fármacos inmunosupresores muy potentes y ya se pueden observar ciertas señales, pero éstas aún no ofrecen una imagen clara. Los pacientes con neoplasias mieloproliferativas (NMP) presentan poblaciones de células B monoclonales agrupadas en la médula ósea y, por tanto, un mayor riesgo de neoplasias de células B. Un grupo de investigación en hematooncología de Viena evaluó una cohorte de pacientes con NMP, algunos de los cuales fueron tratados con diferentes inhibidores de JAK aprobados y experimentales [61]. Esta cohorte mostró un riesgo significativamente mayor de neoplasia agresiva de células B con los inhibidores de JAK. Esta observación fue respaldada por un modelo de ratón del grupo de investigación, pero no confirmada por un estudio análogo de una cohorte más amplia de NMP del MD Anderson [62]. En el programa de ensayos aleatorizados de AR sobre el upadacitinib, se encontró un riesgo significativamente mayor de NMSC en la dosis no aprobada de 30 mg que en la de 15 mg [63]. También con baricitinib, se produjeron relativamente más NMSC numéricamente en la dosis más alta 4 mg en AR que en 2 mg [64]. Sólo existen ya datos de registro significativos para el tofacitinib. En el registro CORRONA de EE.UU., las tasas de NMSC y de cáncer sin NMSC con tofacitinib fueron comparables a las de los biológicos y no difirieron significativamente [65]. Sin embargo, hay que señalar de nuevo la posibilidad de sesgo en los registros. Además, este estudio aún no se ha publicado en su totalidad.
Estrategias terapéuticas en función de la situación
Sobre el trasfondo de estas consideraciones, a continuación se intentará formular propuestas para la terapia reumatológica de pacientes con antecedentes de neoplasia. Estas sugerencias son una síntesis de las recomendaciones existentes en las directrices y de las pruebas descritas y revisadas. No se sometieron a un proceso de consenso y reflejan simplemente la opinión individual del autor:
- Las decisiones terapéuticas en este contexto tienen una gran carga emocional y deben discutirse en detalle con la paciente y el colega oncólogo tratante.
- En una situación de terapia paliativa, hay que distinguir si el pronóstico y las opciones de terapia oncológica son muy limitados o si existe la posibilidad de controlar la enfermedad a largo plazo mediante conceptos (modernos) de terapia oncológica. En particular, la evaluación de las terapias con DMARD después de las terapias inmuno-oncológicas es difícil, pero puede apoyarse en la experiencia oncológica sobre la terapia inmunosupresora de los efectos secundarios inmunomediados de estos tratamientos. Si el objetivo terapéutico principal es el alivio de los síntomas, la terapia reumatológica puede seguirse normalmente sin restricciones. El objetivo del control del tumor a largo plazo debe ser similar a los conceptos de la terapia curativa.
- Si el objetivo de la terapia es curativo, la terapia reumatológica puede llevarse a cabo probablemente sin restricciones 5 años después de finalizar la terapia oncológica. Varios años de terapias oncológicas de mantenimiento no deberían retrasar aún más este intervalo. Incluso más allá de un intervalo de 5 años, el abatacept, los inhibidores de la JAK y quizás los inhibidores del TNF deberían evitarse más bien en el melanoma maligno debido a la situación poco clara de los datos, especialmente si existen opciones terapéuticas alternativas.
- En los linfomas tratados de forma curativa, se debe ser bastante cauto con los inhibidores JAK y quizá también con los inhibidores TNF. Por el contrario, el rituximab y quizá también el tocilizumab tienen un efecto favorable en casos de neoplasia previa de células B o discrasias de células plasmáticas.
- En caso de objetivo terapéutico curativo, se recomienda un intervalo de 5 años:
- Pausa de la terapia básica y puente con glucocorticosteroides (o antiinflamatorios no esteroideos) durante la quimioterapia
- Consideración de las interacciones en las terapias de mantenimiento oncológico a largo plazo
- Por lo demás, una terapia de base coherente en el sentido de un concepto graduado que se oriente en función del riesgo individual de recidiva tumoral y de los datos disponibles sobre los DMARD en cuestión. La situación de los datos debe evaluarse tanto en función del número de estudios disponibles y de su calidad, como en función de si se han demostrado indicaciones de menor o mayor riesgo tumoral en comparación con otras sustancias.
- Sin embargo, debe evitarse a toda costa una inflamación incontrolada a largo plazo o un tratamiento prolongado con altas dosis de glucocorticoides debido a una restricción excesiva antes de la terapia básica.
- Debido a la gran complejidad de las interacciones del sistema inmunitario y el tumor en relación con las terapias inmuno-oncológicas (inhibidores de los puntos de control), se recomienda que las decisiones terapéuticas reumatológicas sean tomadas por un centro especializado.
Mensajes para llevarse a casa
- La decisión sobre terapias inmunomoduladoras o inmunosupresoras en pacientes con antecedentes de neoplasia maligna debe tomarse normalmente de forma interdisciplinar y siempre en estrecha consulta con el paciente.
- Cada vez hay más datos que ayudan a evaluar las sustancias únicas de los DMARD. La situación de los datos es compleja de evaluar debido a las diferentes limitaciones de los formatos de estudio, pero con muy pocas excepciones, el panorama es bastante positivo.
- Existen estudios sobre unas pocas sustancias (inhibidores del TNF, rituximab) que han investigado principalmente el riesgo de recidiva tumoral tras la aparición de la enfermedad maligna. En el caso de otras sustancias, la información puede obtenerse a partir de los datos sobre el riesgo de tumores incidentes y, de forma limitada, examinando modelos preclínicos.
- Sólo la ciclofosfamida en dosis acumuladas elevadas tiene una señal fuerte de un mayor riesgo tumoral. Con las alternativas disponibles, probablemente habría que evitar el abatacept, los inhibidores de la JAK y quizá los inhibidores del TNF en algunas situaciones. En el caso de los inhibidores del TNF, la situación de los datos es especialmente concluyente en determinadas situaciones (por ejemplo, el estado tras un carcinoma de mama) y parece bastante favorable en ellas.
- Varias sustancias aumentan el riesgo de cáncer de piel no melanocítico. Este riesgo puede contrarrestarse bien iniciando un cribado sistemático de los tumores cutáneos.
Literatura:
- Baecklund E, Iliadou A, Askling J, et al: Asociación de la inflamación crónica, no de su tratamiento, con un mayor riesgo de linfoma en la artritis reumatoide. Arthritis Rheum 2006; 54(3): 692-701.
- Zhang Y, Sun Y, Zhang Q: Valor pronóstico del índice de inmuninflamación sistémica en pacientes con cáncer de mama: un metaanálisis. Cancer Cell Int 2020; 20: 224.
- Hirano T, Hirayama D, Wagatsuma K, et al: Mecanismos inmunológicos en la carcinogénesis de colon asociada a la inflamación. Int J Mol Sci 2020; 21(9): 3062.
- Moik F, Zöchbauer-Müller S, Posch F, et al.: La inflamación sistémica y la activación de la hemostasia predicen un mal pronóstico y la respuesta a la quimioterapia en pacientes con cáncer de pulmón avanzado. Cánceres (Basilea) 2020; 12(6): E1619.
- Kampan NC, Madondo MT, McNally OM, et al: La interleucina 6 presente en la ascitis inflamatoria de pacientes con cáncer de ovario epitelial avanzado promueve las células T reguladoras que expresan el receptor 2 del factor de necrosis tumoral. Front Immunol 2017; 8: 1482.
- Krathen MS, Gottlieb AB, Mease PJ: Inmunomodulación farmacológica y malignidad cutánea en la artritis reumatoide, la psoriasis y la artritis psoriásica. J Rheumatol 2010; 37(11): 2205-2215.
- Mercer LK, Davies R, Galloway JB, et al: Riesgo de cáncer en pacientes que reciben tratamiento no biológico modificador de la enfermedad para la artritis reumatoide en comparación con la población general del Reino Unido. Reumatología 2013; 52: 9198.
- Nocturne G, Mariette X: Linfomas asociados al síndrome de Sjögren: actualización de la patogenia y el tratamiento. Br J Haematol 2015; 168(3): 317-327.
- Feldman CH, Liu J, Feldman S, et al: Riesgo de displasia cervical de alto grado y cáncer de cuello uterino en mujeres con lupus eritematoso sistémico que reciben fármacos inmunosupresores. Lupus 2017 Jun; 26(7): 682-689.
- López-Olivo MA, Colmegna I, Karpes Matusevich AR, et al: Revisión sistemática de las recomendaciones sobre el uso de fármacos antirreumáticos modificadores de la enfermedad en pacientes con artritis reumatoide y cáncer. Arthritis Care Res (Hoboken) 2020; 72(3): 309-318.
- Singh JA, Furst DE, Bharat A, et al: Actualización de 2012 de las recomendaciones del Colegio Americano de Reumatología de 2008 para el uso de fármacos antirreumáticos modificadores de la enfermedad y agentes biológicos en el tratamiento de la artritis reumatoide. Arthritis Care Res (Hoboken) 2012; 64(5): 625-639.
- Singh JA, Saag KG, Bridges SL Jr, et al: 2015 American College of Rheumatology Guideline for the Treatment of Rheumatoid Arthritis. Arthritis Care Res (Hoboken) 2016 Jan; 68(1): 1-25.
- Penn I: Evaluación de candidatos a trasplante con neoplasias malignas preexistentes. Ann Transplant 1997; 2(4): 14-17.
- Tarella C, Passera R, Magni M, et al: Factores de riesgo para el desarrollo de malignidad secundaria tras quimioterapia de dosis alta y autoinjerto, con o sin rituximab: un estudio de seguimiento retrospectivo de 20 años en pacientes con linfoma. J Clin Oncol 2011 mar 1; 29(7): 814-824.
- Strangfeld A, Hierse F, Rau R, et al: Riesgo de neoplasias malignas incidentes o recurrentes entre pacientes con artritis reumatoide expuestos a terapia biológica en el registro alemán de biológicos RABBIT. Arthritis Res Ther 2010; 12: R5.
- Dixon WG, Watson KD, Lunt M, et al: Influencia del tratamiento con factor de necrosis antitumoral en la incidencia del cáncer en pacientes con artritis reumatoide que han padecido una neoplasia previa: resultados del Registro de Biológicos de la Sociedad Británica de Reumatología. Arthritis Care Res 2010; 62: 755-763.
- Pappas DA, Rebello S, Liu M, et al: Terapia con agentes biológicos tras el diagnóstico de neoplasias malignas sólidas: resultados del registro Corrona. J Rheumatol 2019; 46(11): 1438-1444.
- Dreyer L, Cordtz RL, Hansen IMJ, et al: Riesgo de segunda neoplasia maligna y mortalidad en pacientes con artritis reumatoide tratados con DMARD biológicos: un estudio de cohortes danés basado en la población. Ann Rheum Dis 2018; 77(4): 510-514.
- Raaschou P, Söderling J, Turesson C, et al: Inhibidores del factor de necrosis tumoral y recurrencia del cáncer en pacientes suecos con artritis reumatoide: un estudio de cohortes poblacional a escala nacional. Ann Intern Med 2018; 169: 291-299.
- Xie W, Xiao S, Huang Y, et al: Un metaanálisis de las terapias biológicas sobre el riesgo de cáncer nuevo o recurrente en pacientes con artritis reumatoide y una neoplasia previa. Reumatología (Oxford) 2019 Oct 17; [Epub ahead of print].
- Shelton E, Laharie D, Scott FI, et al: Recurrencia del cáncer tras terapias inmunosupresoras en pacientes con enfermedades inmunomediadas: revisión sistemática y metaanálisis. Gastroenterología 2016; 151(1): 97-109.e4.
- Mamtani R, Clark AS, Scott FI, et al: Asociación entre la recurrencia del cáncer de mama y la inmunosupresión en la artritis reumatoide y la enfermedad inflamatoria intestinal: un estudio de cohortes. Arthritis Rheumatol 2016; 68: 2403-2411.
- Mercer LK, Lunt M, Low AL, et al: Riesgo de cáncer sólido en pacientes expuestos al tratamiento con factor de necrosis antitumoral: resultados del Registro de Biológicos para la Artritis Reumatoide de la Sociedad Británica de Reumatología. Ann Rheum Dis 2015; 74(6): 1087-1093.
- Schmalzing M, Strangfeld A, Tony HP: Tratamiento farmacológico de la artritis reumatoide con antecedentes de neoplasia. Datos epidemiológicos [Tratamiento farmacológico de la artritis reumatoide con antecedentes de neoplasia maligna. Datos epidemiológicos]. Z Rheumatol 2016; 75(1): 22-31.
- Regierer AC, Strangfeld A: Tratamiento de la artritis reumatoide en pacientes con antecedentes de cáncer. Curr Opin Rheumatol 2018; 30(3): 288-294.
- Shelton E, Laharie D, Scott FI, et al: Recurrencia del cáncer tras terapias inmunosupresoras en pacientes con enfermedades inmunomediadas: revisión sistemática y metaanálisis. Gastroenterología 2016; 151(1): 97-109.e4.
- De Cock D, Hyrich K: Malignidad y artritis reumatoide: epidemiología, factores de riesgo y tratamiento. Best Pract Res Clin Rheumatol 2018; 32(6): 869-886.
- Lange E, Blizzard L, Venn A, et al: Fármacos antirreumáticos modificadores de la enfermedad y cáncer de piel no melanoma en pacientes con artritis inflamatoria: un estudio de cohortes retrospectivo. Reumatología (Oxford) 2016; 55(9): 1594-1600.
- Solomon DH, Glynn RJ, Karlson EW, et al: Efectos adversos del metotrexato en dosis bajas: un ensayo aleatorizado. Ann Intern Med 2020 Feb 18; [Epub ahead of print].
- Rizzi R, Curci P, Delia M, et al.: Remisión espontánea de los “trastornos linfoproliferativos asociados al metotrexato” tras la interrupción del tratamiento inmunosupresor para la enfermedad autoinmune. Revisión de la literatura. Med Oncol 2009; 26(1): 1-9.
- Hellgren K, Baecklund E, Backlin C, et al: Artritis reumatoide y riesgo de linfoma maligno: ¿sigue aumentando el riesgo? Arthritis Rheumatol 2017; 69(4): 700-708.
- Behrens F, Koehm M, Burkhardt H: Actualización 2011: leflunomida en la artritis reumatoide: puntos fuertes y débiles. Curr Opin Rheumatol 2011; 23(3): 282-287.
- Ruiz-Irastorza G, Ugarte A, Egurbide MV,et al: Los antipalúdicos pueden influir en el riesgo de malignidad en el lupus eritematoso sistémico. Ann Rheum Dis 2007; 66(6): 815-817.
- Fardet L, Nazareth I, Petersen I: Efectos de la exposición crónica a la hidroxicloroquina/cloroquina en el riesgo de cáncer, metástasis y muerte: un estudio de cohortes basado en la población de pacientes con enfermedades del tejido conectivo. Clin Epidemiol 2017; 9: 545-554.
- López A, Pouillon L, Beaugerie L, et al: Prevención del cáncer colorrectal en pacientes con colitis ulcerosa. Best Pract Res Clin Gastroenterol 2018; 32-33: 103-109.
- Moore TJ: Safety perspectives: cancer risks of biological products for psoriasis, www.ismp.org/quarterwatch/safety-perspectives (consultado: 29 de marzo de 2018).
- Thai A, Prindiville T: Linfoma hepatoesplénico de células T y enfermedad inflamatoria intestinal. J Crohns Colitis 2010; 4: 511-522.
- Ertz-Archambault N, Kosiorek H, Taylor GE, et al: Association of Therapy for Autoimmune Disease With Myelodysplastic Syndromes and Acute Myeloid Leukemia. JAMA Oncol 2017; 3(7): 936-943.
- Scott FI, Mamtani R, Brensinger CM, et al: Riesgo de cáncer de piel no melanoma asociado al uso de inmunosupresores y agentes biológicos en pacientes con antecedentes de enfermedad autoinmune y cáncer de piel no melanoma. JAMA Dermatol 2016; 152(2): 164-172.
- Muellenhoff MW, Koo JY: Ciclosporina y cáncer de piel: una perspectiva dermatológica internacional a lo largo de 25 años de experiencia. Una revisión exhaustiva y la búsqueda para definir el uso seguro de la ciclosporina en dermatología. J Dermatolog Treat 2012; 23(4): 290-304.
- Vos M, Plasmeijer EI, van Bemmel BC, et al: Transición de azatioprina a micofenolato mofetilo y riesgo de carcinoma de células escamosas tras el trasplante de pulmón. J Heart Lung Transplant 2018; 37(7): 853-859.
- Hellbacher E, Hjorton K, Backlin C, et al: Linfoma maligno en la granulomatosis con poliangitis: subtipos, características clínicas y pronóstico. Acta Oncol 2019; 58(11): 1655-1659.
- Kang KY, Kim HO, Yoon HS, et al: Incidencia del cáncer entre las pacientes con lupus eritematoso sistémico en Corea. Clin Rheumatol 2010; 29(4): 381-388.
- Raaschou P, Simard JF, Asker Hagelberg C, et al: Artritis reumatoide, tratamiento con factor de necrosis antitumoral y riesgo de cáncer de piel de células escamosas y células basales: estudio de cohortes basado en datos nacionales registrados prospectivamente en Suecia. BMJ 2016; 352: i262.
- Mercer LK, Askling J, Raaschou P, et al: Riesgo de melanoma invasivo en pacientes con artritis reumatoide tratados con productos biológicos: resultados de un proyecto de colaboración de 11 registros biológicos europeos. Ann Rheum Dis 2017; 76(2): 386-391.
- Staples MP, March L, Hill C, Lassere M, Buchbinder R: Riesgo de malignidad en pacientes australianos con artritis reumatoide tratados con terapia antifactor de necrosis tumoral: actualización del estudio de cohortes prospectivo de la base de datos de la Asociación Australiana de Reumatología (ARAD). BMC Rheumatol 2019; 3: 1.
- Cordtz R, Mellemkjær L, Glintborg B, et al: Progresión maligna de las lesiones precancerosas del cuello uterino tras el tratamiento biológico con DMARD en pacientes con artritis. Ann Rheum Dis 2015; 74(7): 1479-1480.
- Calip GS, Patel PR, Adimadhyam S, et al: Inhibidores del factor de necrosis tumoral alfa y riesgo de linfoma no Hodgkin en una cohorte de adultos con afecciones reumatológicas. Int J Cancer 2018; 143(5): 1062-1071.
- Mercer LK, Galloway JB, Lunt M, et al: Riesgo de linfoma en pacientes expuestos a la terapia con factor de necrosis antitumoral: resultados del Registro de Biológicos para la Artritis Reumatoide de la Sociedad Británica de Reumatología. Ann Rheum Dis 2017; 76(3): 497-503.
- Perez-Ruiz E, Minute L, Otano I, et al: El bloqueo profiláctico del TNF desacopla eficacia y toxicidad en la inmunoterapia dual con CTLA-4 y PD-1. Nature 2019; 569(7756): 428-432.
- Bertrand F, Montfort A, Marcheteau E, et al: El bloqueo del TNFα supera la resistencia al anti-PD-1 en el melanoma experimental. Nat Commun 2017; 8(1): 2256.
- Badran YR, Cohen JV, Brastianos PK,et al: Terapia concurrente con inhibidores de puntos de control inmunitarios y bloqueo del TNFα en pacientes con acontecimientos adversos gastrointestinales relacionados con el sistema inmunitario. J Immunother Cancer 2019; 7(1): 226.
- Kim ST, Tayar J, Trinh VA, et al: Tratamiento satisfactorio de la artritis inducida por inhibidores de puntos de control con tocilizumab: una serie de casos. Ann Rheum Dis 2017; 76(12): 2061-2064.
- Kim SC, Pawar A, Desai RJ, et al: Riesgo de malignidad asociado al uso de tocilizumab frente a otros productos biológicos en pacientes con artritis reumatoide: Un estudio de cohortes con múltiples bases de datos. Semin Arthritis Rheum 2019; 49(2): 222-228.
- Wadström H, Frisell T, Askling J; Anti-Rheumatic Therapy in Sweden (ARTIS)Study Group: Malignant Neoplasms in Patients With Rheumatoid Arthritis Treated With Tumour Necrosis Factor Inhibitors, Tocilizumab, Abatacept, or Rituximab in Clinical Practice: A Nationwide Cohort Study From Sweden. JAMA Intern Med 2017; 177(11): 1605-1612.
- Montastruc F, Renoux C, Dell’Aniello S, et al: Iniciación del abatacept en la artritis reumatoide y riesgo de cáncer: un estudio de cohortes comparativo basado en la población. Reumatología (Oxford) 2019; 58(4): 683-691.
- de Germay S, Bagheri H, Despas F, et al: Abatacept en la artritis reumatoide y el riesgo de cáncer: un estudio observacional mundial posterior a la comercialización. Reumatología (Oxford) 2019 Dic 27; [Epub ahead of print].
- Nast A, Amelunxen L, Augustin M, et al: S3-Leitlinie zur Therapie der Psoriasis vulgaris Update 2017. AWMF-Register Nr. 013/001.
- Fiorentino D, Ho V, Lebwohl MG, et al: Riesgo de neoplasia maligna con el tratamiento sistémico de la psoriasis en el Psoriasis Longitudinal Assessment Registry. J Am Acad Dermatol 2017; 77(5): 845-854.e5.
- Ridker PM, MacFadyen JG, Thuren T, et al: Efecto de la inhibición de la interleucina-1β con canakinumab sobre el cáncer de pulmón incidente en pacientes con aterosclerosis: resultados exploratorios de un ensayo aleatorizado, doble ciego y controlado con placebo. Lancet 2017; 390(10105): 1833-1842.
- Porpaczy E, Tripolt S, Hoelbl-Kovacic A, et al: Linfomas agresivos de células B en pacientes con mielofibrosis que reciben tratamiento con inhibidores de JAK1/2. Sangre 2018; 132(7): 694-706.
- Pemmaraju N, Kantarjian H, Nastoupil L, et al: Características de los pacientes con neoplasias mieloproliferativas con linfoma, con o sin tratamiento con inhibidores de JAK. Sangre 2019; 133(21): 2348-2351.
- Resumen de seguridad integrado, datos de Abbvie en archivo.
- Smolen JS, Genovese MC, Takeuchi T, et al: Safety Profile of Baricitinib in Patients with Active Rheumatoid Arthritis with over 2 Years Median Time in Treatment. J Rheumatol 2019; 46(1): 7-18.
- Kremer J, Bingham C, Cappelli L, et al: Comparison of Malignancy and Mortality Rates Between Tofacitinib and Biologic DMARDs in Clinical Practice: Five-Year Results from a US-Based Rheumatoid Arthritis Registry [abstract]. Artritis Reumatol 2019; 71 (suppl 10).
- Schmalzing M.: Rheumatologische medikamentöse Therapie bei Malignomanamnese. Aktuelle Rheumatologie 2020; Georg Thieme Verlag KG Stuttgart; doi: 10.1055/a-1247-4252.
InFo DOLOR Y GERIATURA 2020; 2(2): 6-11











