La terapia de la LMA y la LLA está en marcha. En el futuro, será mucho más diferenciado. Algunas nuevas opciones ya han sido aprobadas, otras están en fase de desarrollo o camino de su uso clínico. Para la gestión de la terapia, la enfermedad residual mínima está cobrando cada vez más protagonismo.
El panorama terapéutico de la LMA y la LLA está cambiando y se diferenciará mucho más en el futuro. El siguiente resumen se centra en los nuevos desarrollos que ya han sido aprobados por Swissmedic o por otras autoridades como la FDA o la EMA, o que podrían estar pronto a disposición de los pacientes en Suiza como parte de ensayos clínicos o programas de “acceso temprano”.
En la LMA, éstos incluyen fármacos bien conocidos que mejoran las opciones terapéuticas mediante nuevas formulaciones, así como opciones inmunoterapéuticas mediante antígenos monoclonales contra dianas moleculares patogénicamente relevantes (FLT-3, IDH, BCL-2).
En la leucemia linfoblástica aguda se han identificado nuevos marcadores pronósticos, dianas y subtipos gracias a la secuenciación de nueva generación. Desde el punto de vista terapéutico, se están desarrollando anticuerpos monoclonales, construcciones de anticuerpos biespecíficos y terapias con células T receptoras de antígenos quiméricos (células CAR-T) y algunas ya están en camino de su uso clínico.
Para la gestión de la terapia de la leucemia aguda, la evaluación y el tratamiento de la enfermedad residual mínima están cobrando cada vez más protagonismo.
Anticuerpos monoclonales – Gemtuzumab ozogamicina (Mylotarg®) en la LMA
El gemtuzumab ozogamicina (GO) es un anticuerpo monoclonal contra CD33 unido covalentemente a una citotoxina muy potente (calicheamicina) que ejerce su efecto citotóxico tras su internalización. Después de que el GO fuera aprobado por la FDA hace varios años para el tratamiento de la LMA en pacientes de edad avanzada basándose en parámetros sustitutos, más tarde surgieron dudas sobre su eficacia a partir de datos de estudios posteriores, al tiempo que se observaron toxicidades inesperadas (hepáticas), lo que llevó a la retirada del fármaco por parte del fabricante. Posteriormente, se demostró un beneficio significativo en la supervivencia global en un metaanálisis basado en datos de pacientes individuales de cinco ensayos aleatorios controlados (OR 0,90; p=0,01). Los beneficios en la supervivencia global fueron más pronunciados para las pacientes clasificadas en el grupo de “buen” pronóstico en función de las aberraciones citogenéticas, con una mejora absoluta en la supervivencia global a los seis años del 20,7% (OR 0,47; p=0,0006). Para los pacientes con riesgo intermedio, el beneficio absoluto fue del 5,7% (OR 0,84; p=0,005), mientras que para los pacientes en la categoría de peor riesgo no hubo beneficio.
beneficio relevante fue demostrado por GO [1].
En varios estudios iniciados por el mundo académico, la dosis y la secuencia de administración podrían desarrollarse más, lo que daría lugar a mejoras en la toxicidad con la misma eficacia. Desde 2017, el GO ha sido aprobado de nuevo por la FDA y, desde hace unos meses, también por la EMA como terapia de combinación con daunorrubicina y citarabina (AraC) para el tratamiento de primera línea de la LMA.
Nueva formulación del fármaco: CPX-351
El CPX-351(nombre comercial: Vyxeos®) es un preparado liposomal combinado de citarabina y daunorrubicina. Esta preparación se comparó con la terapia de inducción convencional “7+3” en un ensayo aleatorizado de fase III en el que participaron 309 pacientes de 60 a 75 años con LMA de alto riesgo. El CPX-351 mostró tasas de remisión significativamente superiores (CR/CRi 47,7% frente a 33,3%) y una mejora de la supervivencia global (HR 0,69; p=0,003, mediana 9,6 frente a 6 meses) en comparación con la terapia de inducción convencional. Las tasas de supervivencia a dos años fueron del 31% y del 12% [2]. El CPX-351 fue aprobado por la FDA para la terapia de la LMA en junio de 2017 y también ha recibido recientemente una evaluación positiva del comité responsable de la EMA, por lo que también cabe esperar su aprobación aquí en breve. El CPX-351 puede mejorar la terapia en pacientes ancianos con LMA de alto riesgo.
Nuevos fármacos orales para la LMA
Inhibidores de la tirosina cinasa (TKI) – Inhibición de FLT3: Puede detectarse una mutación en la tirosina cinasa FLT3 en aproximadamente el 25% de los pacientes con LMA. Mediante la administración adicional del inhibidor oral de FLT3 midostaurina a la quimioterapia convencional, se pueden mejorar de forma relevante los resultados terapéuticos de la quimioterapia estándar. En el estudio internacional de fase III, aleatorizado y controlado con placebo “RATIFY”, la midostaurina mejoró significativamente la mediana de supervivencia global en comparación con el brazo placebo (74,7 meses frente a 25,6; p=0,009) y la supervivencia a 4 años (51,4% frente a 44,3%; HR 0,78; p=0,009). Este beneficio se demostró de forma consistente en los diferentes subgrupos de mutaciones de FLT3 (alelación ITD de FLT3 alta o baja, mutaciones TKD de FLT3), así como con y sin censura para el trasplante alogénico de células madre hematopoyéticas [3].
Se ha demostrado una prometedora actividad clínica del inhibidor de FLT3 más selectivo, el gilteritinib, en las recaídas de LMA con mutación de FLT3 [4]. El grupo de estudio HOVON/SAKK prepara ahora un estudio para su aplicación en Suiza en el que se compararán estos dos inhibidores de FLT3 como complemento de la quimioterapia estándar en la terapia de primera línea.
Inhibición de IDH2: En aproximadamente el 12% de los pacientes con LMA, pueden detectarse mutaciones recurrentes de la isocitrato deshidrogenasa 2 (IDH2) como estructura diana patogenéticamente relevante. El enasidenib es un inhibidor oral de la IDH2 mutante. En un estudio prospectivo de un solo brazo, los pacientes con LMA en recaída o refractaria (LMA ref./reciente) y mutaciones IDH2 mostraron una eficacia notable para la monoterapia con enasidenib, con una tasa de respuesta global del 39% y una tasa de RC del 20% [5].
Basándose en estos datos, el enasidenib ha sido aprobado por la FDA desde 2017. Actualmente, un ensayo internacional de fase III está reclutando pacientes con LMA pretratada con mutaciones en IDH2 para comparar la terapia con enasidenib frente al tratamiento estándar. Además, se está preparando un ensayo de fase III de HOVON/SAKK para probar la inhibición de IDH en la terapia de primera línea, además de la terapia de inducción.
Terapias combinadas con venetoclax, inhibidor de BCL-2, en pacientes ancianos: Para los pacientes de edad avanzada que no reúnen los requisitos para una terapia de inducción intensiva, se dispone de dosis bajas de citarabina o de los agentes hipometilantes azacitidina y decitabina, además de la terapia de apoyo pura, con tasas de respuesta global -dependiendo del estudio- en torno al 50% (tasas de RC/RC del 7-47%) y tiempos medios de supervivencia de entre 5 y 24 meses. Varios estudios prospectivos de un solo brazo probaron la combinación del inhibidor de BCL-2 venetoclax con dosis bajas de citarabina o agentes hipometilantes. Esto mostró tasas de remisión prometedoras de hasta el 60% para las diferentes combinaciones y, en comparación histórica, tiempos de respuesta más largos con una tolerancia satisfactoria [6–8].
Importancia creciente de la enfermedad mínima residual (EMR)
En un análisis retrospectivo de varios estudios HOVON/SAKK publicado de forma destacada, se demostró que la ausencia de detección de ERM (citometría de flujo o genética molecular) tras la terapia de inducción se asociaba a una mejora en la ausencia de recidiva. La mayor supervivencia libre de recaída se observó en aquellos pacientes en los que la enfermedad mínima residual no era detectable ni por citometría de flujo ni por PCR [9]. De ello se deriva ahora el concepto de que la indicación de un trasplante alogénico de células madre sanguíneas debe hacerse además de la clasificación convencional del riesgo genético, teniendo en cuenta también el estado de la ERM. Esto se está investigando en un estudio HOVON/SAKK cuyo reclutamiento de pacientes ha finalizado.
Nuevos marcadores pronósticos y dianas en la LLA
En un buen 80% de los pacientes con un pos Filadelfia. B-ALL (LLA Ph+), también se encuentra una mutación/deleción del factor de transcripción IKZF1, que se asocia a la resistencia a la terapia y a un aumento de las recaídas. Las mutaciones de IKZF2 son un sello distintivo de la LLA-B profundamente hipodiploide y las alteraciones de IKZF3 se encuentran en la mayoría de las LLA casi haploides.
La LLA “Ph-like” o “BCR-ABL1 like” muestra un perfil de expresión génica comparable al de la LLA Ph+, pero no presenta una mutación BCR-ABL clásica. El 20-30% de todos los pacientes con LLA-B pueden asignarse a este grupo. Tienen una SLP y una SG significativamente inferiores, del 20-25% frente a alrededor del 50-55% [10]. Aproximadamente la mitad de los pacientes con LLA “tipo Ph” presentan un reordenamiento del “factor 2 similar al receptor de citoquinas” (CRLF2). Además, se encuentra una mutación con activación de la quinasa Janus [11] en aproximadamente el 50% de los pacientes con alteración de CRLF2. En los pacientes sin reordenamiento CRLF2, se detectaron fusiones con tirosina quinasas.
Además de la LLA “tipo Ph”, la LLA de “precursores T tempranos” (ETP-ALL) se incluyó recientemente como entidad independiente en la clasificación de la OMS de 2016, basándose en su propio perfil de inmunofenotipo y expresión génica. Aproximadamente el 35% de todas las LLA-T pueden asignarse a esta entidad, lo que posiblemente se asocie a un pronóstico algo menos favorable.
Las mutaciones de activación de la vía NOTCH1 pueden encontrarse en más del 50% de los pacientes con T-ALL y se asocian a un mejor pronóstico, mientras que las deleciones de PTEN y las mutaciones de NRAS se asocian a un peor pronóstico.
En la LLA hipodiploide, se identificaron dos subtipos: un grupo con un conjunto cromosómico casi haploide (24-31 cromosomas) con mutaciones en las vías de la tirosina quinasa y RAS en cerca del 71% o mutaciones en IKZF3 en cerca del 13%, y un grupo con LLA hipodiploide baja (32-39 cromosomas) con alteraciones en TP53 (91%), IKZF2 (53%) y RB1 (41%).
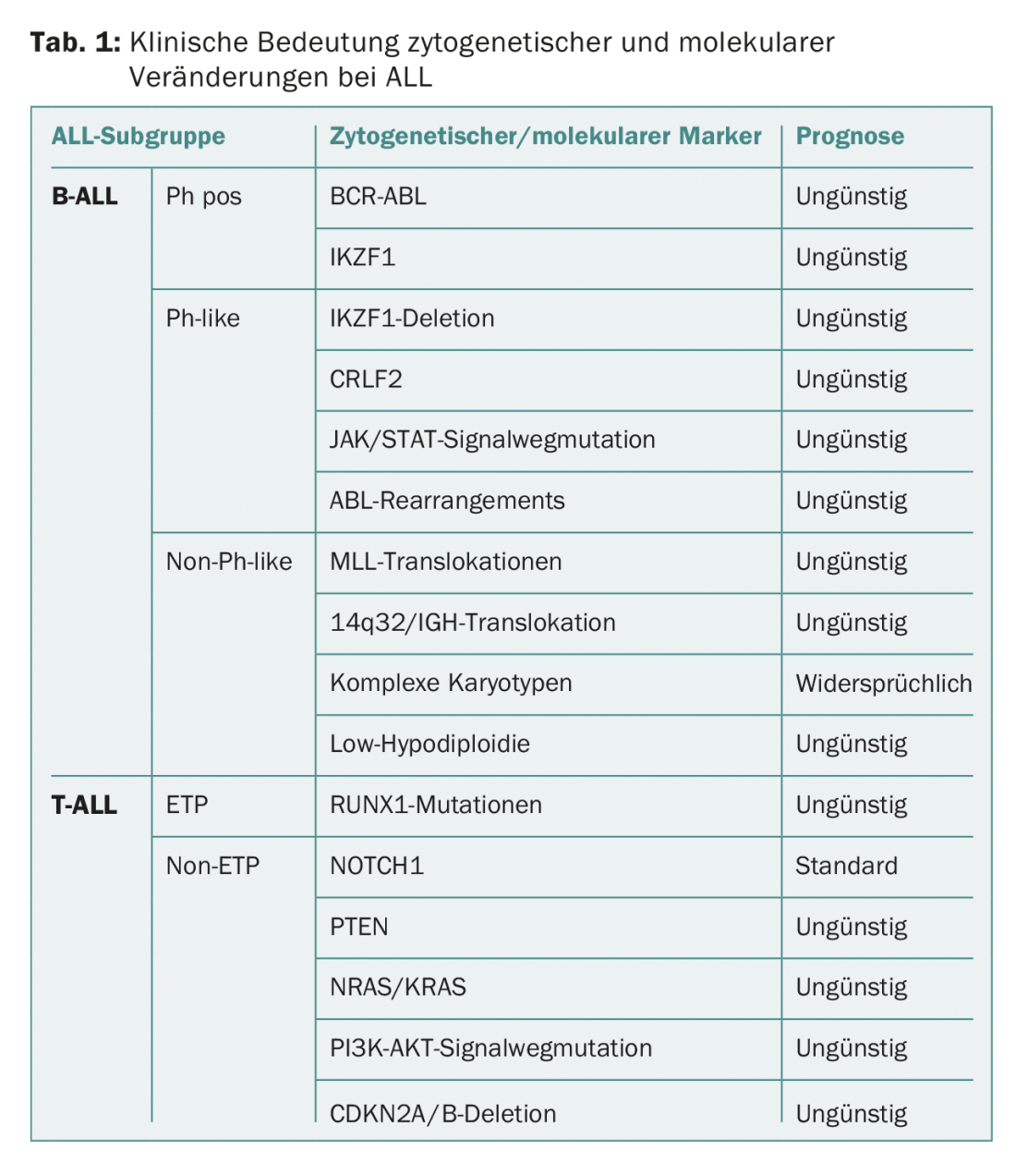
La tabla 1 ofrece una visión general de la importancia clínica de los cambios citogenéticos y moleculares en la LLA.
Enfermedad residual mínima
La detección precoz de la falta de respuesta a la quimioterapia o de la recidiva es posible con la determinación de la ERM. En pacientes con LLA, esto se realiza mediante métodos de PCR y detección de genes reordenados clonalmente que codifican receptores de inmunoglobulina o de células T, o detección de un fenotipo específico de leucemia mediante citometría de flujo multiparamétrica. Un evento positivo con una frecuencia de <10-4 se reconoce como negatividad de MRD, y un nivel de MRD de >10-3 se reconoce como positivo de MRD. Lograr la negatividad de MRD tras la terapia de inducción y consolidación es un factor pronóstico importante que probablemente complemente o sustituya a los factores clínicos y citogenéticos tradicionales en el futuro.
Anticuerpo
CD20: el 30-40% de los casos de LLA-B muestran expresión de CD20. La adición de rituximab a la quimioterapia estándar conduce a una negatividad de la ERM mayor y más rápida tras la terapia de inducción y consolidación. Resulta alentador que esto pueda conducir a una mejora de la supervivencia global y libre de enfermedad [12,13].
CD22: Dado que prácticamente todas las LLA-B expresan CD22, se trata de una diana ideal. El inotuzumab ozogamicina (IO) es un conjugado de un anticuerpo CD22 con calicheamicina, que se internaliza tras unirse al antígeno y provoca roturas en el ADN. Los ensayos clínicos han demostrado una ventaja de supervivencia con esta sustancia en comparación con las terapias basadas en la quimioterapia en la situación de recaída [14]. Actualmente, se está investigando la IO en la terapia de primera línea. También se están probando otros anticuerpos CD22 en ensayos clínicos.
Blinatumomab: Se trata de un constructo de anticuerpo biespecífico que se une simultáneamente a las células T CD3+ normales y a las células B-ALL CD19+, lo que provoca una respuesta citotóxica mediada por células T contra la célula B. Los ensayos iniciales con blinatumomab en adultos se realizaron con el objetivo de eliminar la enfermedad mínima residual. En un seguimiento a largo plazo, doce de 20 pacientes permanecieron en RC, y nueve pacientes de este estudio recibieron un TCMH alogénico de consolidación. Cabe destacar que los pacientes no trasplantados mostraron un resultado comparable. En un estudio con pacientes muy pretratados con LLA-B recidivante, se comparó blinatumomab con quimioterapia. Hubo diferencias significativas con CR/CRi del 44% frente al 25% y una mediana de supervivencia global de 7,7 frente a 4,0 meses [15].
CD38: Otra diana prometedora en la T-ALL es CD38, ya que los blastos de T-ALL muestran de forma estable una alta expresión de CD38 y las células mieloides y linfoides normales sólo muestran una baja expresión. El daratumumab es un anticuerpo monoclonal CD38 utilizado en el mieloma múltiple con un buen perfil de eficacia y seguridad. Los modelos de xenoinjerto, así como las observaciones de casos individuales, mostraron un efecto convincente [16].
Células CAR-T
Una nueva opción prometedora es el uso de las llamadas células CAR-T. Se trata de células T del propio paciente (autólogas) que han sido modificadas genéticamente ex vivo para contener un receptor quimérico de células T. De este modo, se unen a los antígenos tumorales (por ejemplo, CD 19 en los linfocitos B) y provocan así una eliminación selectiva de las células portadoras de este antígeno. Actualmente, sólo las células CAR-T dirigidas contra CD19 están aprobadas por las autoridades reguladoras (FDA) para el tratamiento de la LLA infantil refractaria y los linfomas de células B refractarios. Los ensayos pivotales correspondientes en la LLA mostraron una tasa de RC del 67-91% con una negatividad de la ERM del 60-81% de los pacientes en remisión completa. Deben tenerse en cuenta las toxicidades relevantes (síndrome de liberación de citoquinas, neurotoxicidad) en la terapia con células CAR-T CD19. Tras la terapia de la LLA refractaria con células CAR-T dirigidas a CD19, se producen recaídas negativas para CD19 en aproximadamente el 20% de los pacientes y son difíciles de tratar. El valor de consolidar el TCMH alogénico tras la terapia con células T CAR es controvertido.
Resumen
Tras una larga fase sin innovaciones eficaces en la terapia de las leucemias agudas, nos encontramos ahora ante el comienzo de una nueva era con varias opciones terapéuticas nuevas, especialmente las inmunoterapias, que prometen una mejora significativa del pronóstico y en parte ya se han demostrado en estudios. En la LMA, nuevas sustancias, las llamadas “pequeñas moléculas”, también se están probando en ensayos o ya se utilizan clínicamente en algunos casos. La importancia de la determinación de la ERM durante la progresión y, si aún está presente, la eliminación de la enfermedad residual como marcador pronóstico es cada vez más clara.
Mensajes para llevarse a casa
- El panorama terapéutico de la leucemia mieloide aguda (LMA) es cada vez más diferenciado. Se han demostrado los beneficios para la supervivencia de una nueva formulación liposomal de los agentes quimioterapéuticos clásicos, el renacimiento del gemtuzumab ozogamicina y las nuevas combinaciones de inhibidores de la tirosina quinasa (TKI) con la quimioterapia convencional.
- Los análisis moleculares y la monitorización de la enfermedad mínima residual (EMR) son cada vez más importantes y relevantes para las decisiones de tratamiento en la LMA.
- El uso de las determinaciones de la ERM en los algoritmos terapéuticos en todos los subtipos de leucemia linfoblástica aguda (LLA) es cada vez más rutinario y puede sustituir a la mayoría de los factores pronósticos en el futuro.
- Muchas terapias nuevas con anticuerpos se están estableciendo en la LLA recidivante y también se están investigando en ensayos clínicos en la terapia de primera línea. Como nueva opción, la terapia celular CAR-T está a punto de utilizarse de forma rutinaria.
Literatura:
- Hills RK, et al: Adición de gemtuzumab ozogamicina a la quimioterapia de inducción en pacientes adultos con leucemia mieloide aguda: un metaanálisis de datos de pacientes individuales de ensayos controlados aleatorizados. Lancet Oncol 2014; 15(9): 986-996.
- Lancet JE, et al: Liposoma CPX-351 (citarabina y daunorrubicina) para inyección frente a citarabina más daunorrubicina convencional en pacientes de edad avanzada con leucemia mieloide aguda secundaria recién diagnosticada. J Clin Oncol 2018; 38(26): 2684-2692.
- Stone RM, et al: Midostaurina más quimioterapia para la leucemia mieloide aguda con mutación FLT3. N Engl J Med 2017; 377(5): 454-464.
- Perl AE, et al: Inhibición selectiva de FLT3 por gilteritinib en leucemia mieloide aguda recidivante o refractaria: un estudio multicéntrico, primero en humanos, abierto, de fase 1-2. Lancet Oncol 2017; 18(8): 1061-1075.
- Stein EM, et al: Enasidenib en la leucemia mieloide aguda mutante IDH2 en recaída o refractaria. Sangre 2017; 130(6): 722-731.
- DiNardo C, et al: Seguridad y eficacia preliminar de venetoclax con decitabina o azacitidina en pacientes ancianos con leucemia mieloide aguda no tratada previamente: un estudio de fase 1b no aleatorizado y abierto. Lancet Oncol 2018; 19(2): 216-228.
- DiNardo C, et al: Respuesta duradera con venetoclax en combinación con decitabina o azacitidina en pacientes ancianos con leucemia mieloide aguda. Congreso de la Asociación Europea de Hematología 2018; Resumen S1563.
- Wei A, et al: Estudio de fase 1/2 de venetoclax con dosis bajas de citarabina en pacientes ancianos con leucemia mieloide aguda no aptos para quimioterapia intensiva y sin tratamiento: resultados a 1 año. ASH Annual Meeting and Exposition 2017; Resumen 890.
- Jongen-Lavrencic M, et al: Enfermedad mínima residual molecular en la leucemia mieloide aguda. N Engl J Med 2018; 378(13): 1189-1199.
- Roberts KG, et al: Alta frecuencia y malos resultados de la leucemia linfoblástica aguda similar al cromosoma Filadelfia en adultos. J ClinOncol 2017; 35(4): 394-401.
- Herold T, et al: Los adultos con leucemia linfoblástica aguda similar al cromosoma Filadelfia presentan con frecuencia mutaciones IGH-CRLF2 y JAK2, persistencia de enfermedad mínima residual y mal pronóstico. Haematologica 2017; 102(1): 130-138.
- Thomas DA, et al: La quimioinmunoterapia con un régimen modificado de hiper-CVAD y rituximab mejora el resultado en la leucemia linfoblástica aguda de linaje B precursora de cromosoma Filadelfia negativa de novo. JCO 2010; 28: 3880.
- Maury S, et al: La adición de rituximab mejora el resultado de los pacientes adultos con leucemia linfoblástica aguda de células B precursoras CD20 positivas y Ph negativas (BCP-ALL): Resultados del estudio aleatorizado Graall-R 2005. Reunión ASH 2015; 126: 1 .
- Kantarjian HM, et al: Inotuzumab ozogamicina frente a la terapia estándar para la leucemia linfoblástica aguda. N Engl J Med 2016; 375(8): 740-753.
- Kantarjian HM, et al: Blinatumomab frente a quimioterapia para la leucemia linfoblástica aguda avanzada. N Engl J Med 2017 Mar 2; 376(9): 836-847.
- Bride KL, et al: Eficacia preclínica del daratumumab en la leucemia linfoblástica aguda de células T. Sangre 2018 Mar 1; 131(9): 995-999.
InFo ONCOLOGÍA Y HEMATOLOGÍA 2018; 32-35