Hasta ahora, las pruebas moleculares en el cáncer de pulmón no microcítico (CPNM) se han reservado principalmente a los pacientes en estadio IV. Sin embargo, con la introducción de terapias dirigidas también en estadios tumorales más tempranos, esto podría cambiar pronto, una gran oportunidad que, sin embargo, también plantea muchos retos para la práctica clínica diaria.
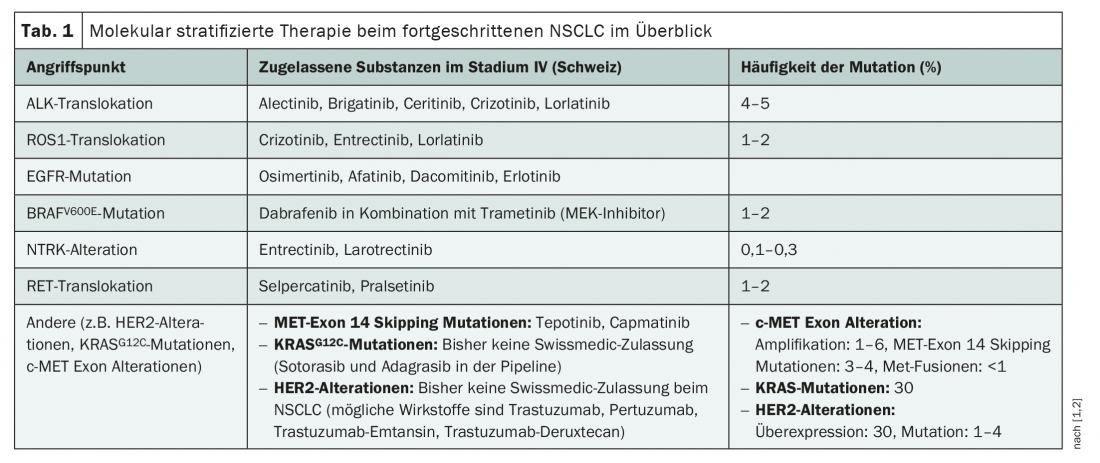
Con terapias dirigidas específicamente a ROS1, ALK, EGFR, BRAF, pero también a TRK y RET, ya existen numerosas opciones de tratamiento dirigido para el CPNM (tab. 1 ). Sin embargo, a excepción del inhibidor del EGFR osimertinib, hasta ahora sólo han sido aprobados en Suiza para el tratamiento de tumores localmente avanzados y metastásicos [1]. En consecuencia, el diagnóstico de mutaciones relevantes para la terapia sólo se recomienda en el estadio IV antes del inicio de la terapia de primera línea [2]. En cualquier caso, deben registrarse las translocaciones ALK, las mutaciones BRAFV600E, las mutaciones EGFR exón 18-21, las fusiones NTRK, las translocaciones RET y las translocaciones ROS1 [2], ya que existen conceptos terapéuticos aprobados para estos cambios. Sin embargo, la terapia dirigida en el CPNM está experimentando rápidos cambios, y con ella las pruebas moleculares. Por un lado, esto podría ampliarse en un futuro próximo con objetivos adicionales, ya que hay algunas sustancias nuevas en proyecto. Por otro lado, los fármacos oncológicos dirigidos se están probando cada vez más para su uso neoadyuvante y adyuvante en estadios tumorales más tempranos, con éxito, como demuestra la reciente aprobación del osimertinib en el ámbito adyuvante. La consecuencia lógica: la clasificación molecular de tumores podría ser ya útil para los tumores en estadio I-III.
Otros puntos de ataque a la vista
En la actualidad, otras numerosas mutaciones del conductor están en el punto de mira, además de las ya conocidas. En un futuro próximo, por ejemplo, podría producirse la aprobación de varios agentes dirigidos contra HER2 o KRAS, entre otros. Sólo en abril y junio de este año, respectivamente, se lanzaron al mercado suizo los inhibidores de MET altamente específicos capmatinib y tepotinib para el tratamiento del CPNM metastásico con una mutación de omisión del exón 14 del receptor de tirosina cinasa MET [1]. Esta alteración genética afecta hasta al 3-4% de los pacientes con CPNM y se asocia a un pronóstico desfavorable [2].
En el ensayo pivotal VISION, que incluyó a 152 pacientes en su mayoría pretratados con mutación de omisión del exón 14 de MET, el tepotinib dio lugar a una tasa de respuesta objetiva del 44,7% con una mediana de supervivencia sin progresión (SLP) de 8,9 meses [1]. En el caso del capmatinib, la tasa de respuesta objetiva en el ensayo pivotal GEOMETRY mono-1 alcanzó el 67,9%, y la mediana de la SLP fue de 9,69 meses. Aún están por ver más datos sobre la supervivencia global y la comparación de la eficacia con el tratamiento estándar de inmunoquimioterapia. Lo que ya es seguro es que las pruebas para detectar mutaciones de omisión del exón 14 de MET probablemente ampliarán el estándar de diagnóstico en el futuro.
Las mutaciones KRAS y las aberraciones HER2 también podrían incorporarse pronto al diagnóstico molecular del CPNM. Aunque todavía no se ha aprobado ninguna terapia específica para estos objetivos en Suiza, hay muchas cosas en marcha. Por ejemplo, el soterasib y el adagrasib fueron los primeros inhibidores de KRASG12C que se desarrollaron y se encuentran actualmente en ensayos clínicos. Se ha presentado una solicitud de autorización de comercialización del soterasib en la UE, que se espera para finales de este año, y la Administración de Alimentos y Medicamentos de EE.UU. (FDA) ya ha concedido una aprobación preliminar para el tratamiento de pacientes con mutación KRASG12C pretratados [3,4]. Alrededor del 13% de los pacientes con CPNM podrían beneficiarse de su lanzamiento al mercado: así de común es la mutación KRASG12C [3]. En el ensayo CodeBreak 100 de fase II, 124 pacientes pretratados con mutación KRASG12C mostraron una tasa de respuesta del 37,1% al suterasib con una mediana de SLP de 6,8 meses y una mediana de SG de 12,5 meses [5]. A diferencia del KRAS, ya existen agentes como el trastuzumab, el pertuzumab y los conjugados anticuerpo-fármaco trastuzumab emtansina y trastuzumab deruxtecan para dirigirse contra el HER2. Aunque su uso se está investigando en algunos ensayos clínicos en el CPNM, no se han realizado comparaciones directas con la inmunoquimioterapia y hasta la fecha no existe ninguna aprobación de Swissmedic para el CPNM [1,2].
Terapia adyuvante y neoadyuvante en transición
Además de ampliar la caracterización molecular del CPNM, también podría aumentar su importancia en estadios tumorales más tempranos. Osimertinib da el pistoletazo de salida. Este año, el inhibidor del EGFR fue aprobado en Suiza para el tratamiento adyuvante de pacientes con CPNM no escamoso con deleciones del exón 19 del EGFR o mutaciones de sustitución del exón 21 (L858R) tras la resección completa del tumor [1]. Esto se basó en el ensayo ADAURA, en el que la terapia adyuvante durante tres años en los estadios II y IIIA tras la resección R0 condujo a una mejora significativa de la supervivencia libre de enfermedad en comparación con el placebo (HR 0,17; p<0,001) [2]. La mayoría de las participantes en el estudio también recibieron quimioterapia adyuvante. La nueva opción del tratamiento adyuvante dirigido supone una esperanza para aquellos pacientes de CPNM con mutación del EGFR, y requiere una selección adecuada de los pacientes.
Es probable la aprobación de más agentes dirigidos en el contexto adyuvante y neoadyuvante. Así pues, se hacen necesarias estrategias justas y uniformes de pruebas moleculares. Aunque muchas directrices aún no incluyen una recomendación para el análisis molecular en los estadios tumorales I-III, las directrices de la La National Comprehensive Cancer Networks (NCCN) y el Asian Thoracic Oncology Research Group, las recomendaciones de consenso canadienses, las directrices chinas para el diagnóstico y tratamiento del cáncer de pulmón primario y el consenso de la Society for Translational Medicine recomiendan al menos la prueba del EGFR. Esto tiene sentido no sólo en vista de la nueva opción terapéutica, sino también porque las mutaciones del EGFR son las denominadas mutaciones troncales: Están presentes desde el principio, su prevalencia apenas cambia de una etapa a otra. Además de los inhibidores del EGFR, los inhibidores de ALK, como el alectinib, se están probando actualmente en la terapia neoadyuvante, adyuvante y de mantenimiento del CPNM. Probablemente, las directrices siempre irán algo por detrás de estos avances, y su aplicación en la práctica clínica diaria tardará a su vez un tiempo. Esto hace que sea aún más importante evaluar a cada paciente individualmente y, a la vista de las numerosas nuevas posibilidades, pensar más allá de las estructuras arraigadas.
Fuente: Aggarwal C, et al.: Molecular testing in stage I-III non-small cell lung cancer: Approaches and challenges. Cáncer de pulmón. 2021; 162: 42-53.
Literatura:
- Swissmedic drug information: www.swissmedicinfo.ch (última consulta: 25.11.2021).
- Griesinger F, et al: Directrices de la Onkopedia: Cáncer de pulmón de células no pequeñas (CPNM). Estado julio 2021. www.onkopedia.com/de/onkopedia/guidelines/lungenkarzinom-nicht-kleinzellig-nsclc/@@guideline/html/index.html (último acceso 25.11.2021).
- Whitlock Burton K: La FDA aprueba el sotorasib como primera terapia dirigida para el CPNM con mutaciones KRAS G12C. 03.06.2021. www.univadis.de (última consulta: 25.11.2021).
- DGHO: Solicitud de muestras NUB Sotorasib 2021/2022. www.dgho.de (última consulta: 25.11.2021).
- Skoulidis F, et al: Sotorasib para cánceres de pulmón con mutación KRAS p.G12C. New England Journal of Medicine. 2021; 384(25): 2371-2381.
InFo ONcOLOGíA y HEMATOLOGíA