El patrón oro para la evaluación del ictus agudo es la TC nativa para excluir la hemorragia, tras lo cual puede administrarse la terapia trombolítica iv en el margen de tiempo actualmente permitido de 4,5 horas y tras la exclusión de posibles contraindicaciones. El mayor reto en el tratamiento interdisciplinar del ictus es la selección del paciente optimizada en el tiempo para las terapias disponibles (terapia trombolítica iv, recanalización ia, lisis ia, ninguna terapia). Los prometedores protocolos modernos de diagnóstico por imagen ayudan a tomar decisiones en el contexto agudo y pueden evaluar la penumbra y el estado de las colaterales vasculares individuales en cuestión de minutos. Esto puede justificar las terapias endovasculares fuera del plazo de 4,5 horas si la situación de las colaterales es buena o en la zona del estroma vertebrobasilar.
El ictus agudo es la urgencia neurológica más frecuente. La causa más frecuente es la oclusión aguda de las arterias que irrigan el cerebro. Restablecer el flujo sanguíneo al cerebro lo antes posible es crucial para el éxito del tratamiento. La extensión del daño tisular depende esencialmente del tiempo de isquemia y de las colaterales disponibles. Por tanto, toda la cadena de tratamiento debe optimizar el tiempo: desde el inicio del ictus, el transporte al hospital, el diagnóstico, el tratamiento agudo, hasta la sala de ictus. Los cuidados de seguimiento y la rehabilitación son igualmente importantes, pero menos críticos en cuanto al tiempo.
El papel de la neurorradiología es el diagnóstico por imagen primario y la revascularización neurointervencionista. El primer paso consiste en distinguir entre el infarto cerebral isquémico (aproximadamente el 80%) y la hemorragia cerebral (el diagnóstico diferencial más común), que no es posible desde el punto de vista neurológico. Sólo los pacientes con ictus isquémico pueden optar a cualquier forma de terapia revascularizadora. El patrón oro para la evaluación del ictus agudo es la tomografía computarizada nativa (TC nativa) debido a su amplia disponibilidad y a su alta sensibilidad para excluir la hemorragia cerebral. Esto es suficiente para iniciar una terapia trombolítica iv oportuna si existen déficits funcionalmente relevantes y ninguna contraindicación (por ejemplo, traumatismo craneal, cirugía reciente, coagulación descarrilada). En 2010, según las nuevas conclusiones científicas basadas en los resultados correspondientes, la ventana de tiempo entre el inicio de los síntomas y el comienzo de la terapia trombolítica se amplió de 3 a 4,5 horas (ECASS III) [1].
Se sabe que la TC nativa tiene una sensibilidad baja para detectar el infarto cerebral en las primeras horas tras el inicio del infarto y que varía según el intervalo de tiempo y la experiencia radiológica. Los protocolos de examen modernos (perfusión por TC) aumentan significativamente la sensibilidad [2], proporcionan información adicional útil sobre el ictus individual y el estado de las colaterales vasculares y ayudan a tomar decisiones terapéuticas individuales. Además de la terapia trombolítica iv basada en la evidencia en un plazo de 4,5 horas, también existen enfoques de terapia endovascular de la neurorradiología intervencionista para oclusiones de vasos proximales, por ejemplo. Estos procedimientos de recanalización mecánica lograron mejores tasas de recanalización de las arterias cerebrales proximales ocluidas en comparación con la trombolisis iv [3], pero en los estudios más amplios, más discutidos y nuevos, no se observó ninguna mejora significativa en el resultado funcional de los pacientes tratados (IMS III) [4]. Quedan por ver otros estudios con un diseño optimizado, una mejor selección de los pacientes y un equipo de revascularización uniforme. a revascularización ia se utiliza actualmente hasta 6-8 horas después del inicio de los síntomas, sin límite de tiempo para las oclusiones vertebrobasilares. El verdadero reto en la evaluación neurorradiológica y el tratamiento interdisciplinar del ictus agudo reside en la decisión de la terapia individualmente mejor/eficaz. La pregunta central en el centro interdisciplinar de ictus es: ¿qué paciente se beneficia más de la trombólisis iv, la recanalización ia, la trombólisis ia o ninguna terapia y cuándo? Además de la edad, el tamaño del infarto, la gravedad de los déficits neurológicos, la localización y el tamaño de la oclusión del vaso, así como la ventana temporal, otros factores (comorbilidades, medicación, anatomía individual del vaso y posibles contraindicaciones) desempeñan un papel importante en la decisión a favor o en contra de una forma específica de terapia. Las técnicas más recientes de TC (perfusión por TC), que junto con la TC nativa y la angiografía por TC (ATC) en el contexto agudo descartan la hemorragia cerebral en pocos minutos y permiten hacer afirmaciones útiles sobre el estado de las colaterales vasculares y el tamaño aproximado del parénquima cerebral irreversiblemente dañado y aún salvable (concepto de penumbra), son útiles para la toma de decisiones.
En comparación con la IRM, un protocolo de ictus por TC aporta claras ventajas logísticas y de tiempo (adquisición de datos más rápida, mayor disponibilidad, menor esfuerzo, mejor seguimiento del paciente), en línea con el lema “el tiempo es cerebro”. En muchos centros de ictus ya se utilizan clínicamente estos protocolos de TC para ictus. Los estudios de comparación directa entre la perfusión por TC y RM proporcionaron resultados comparables [5], pero aún faltan comparaciones multicéntricas válidas debido a la insuficiente estandarización de los algoritmos/posprocesamiento de evaluación [6].
A continuación, se presentarán las posibilidades del diagnóstico neurorradiológico en el ictus agudo y se subrayarán con casos prácticos. También comentamos las posibles fuentes de error y los diagnósticos diferenciales.
Nativo T
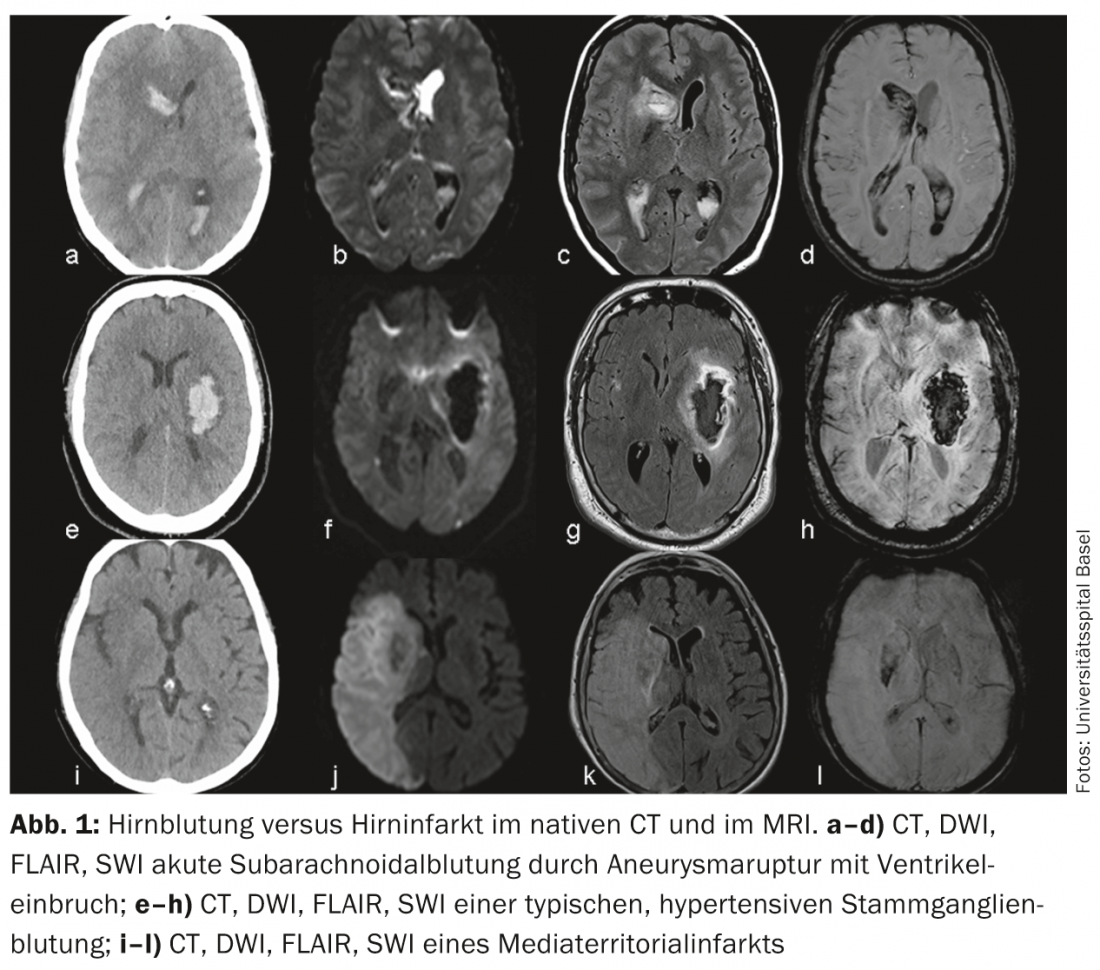
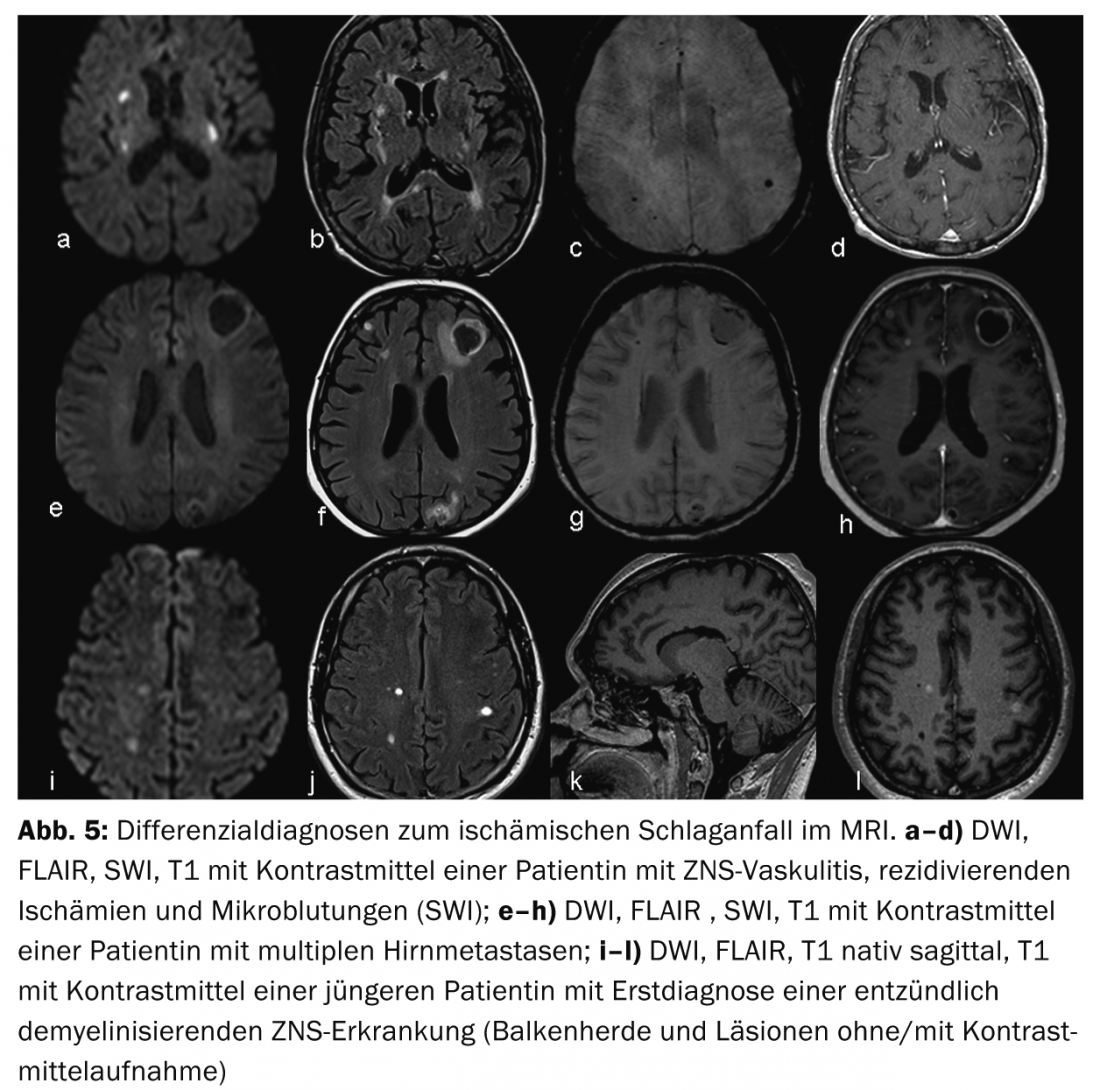
Infarto cerebral frente a hemorragia cerebral: El diagnóstico diferencial más frecuente del ictus isquémico es la hemorragia intracraneal. Puede distinguirse entre hemorragias subaracnoideas (aneurismáticas) e intraparenquimatosas (hipertensivas y no hipertensivas). La detección o exclusión de una hemorragia cerebral puede realizarse de forma rápida y fiable con TC nativa, pero puede hacerse igual de bien con secuencias modernas (SWI, DWI, FLAIR) y un poco más de esfuerzo en RM (Fig. 1).
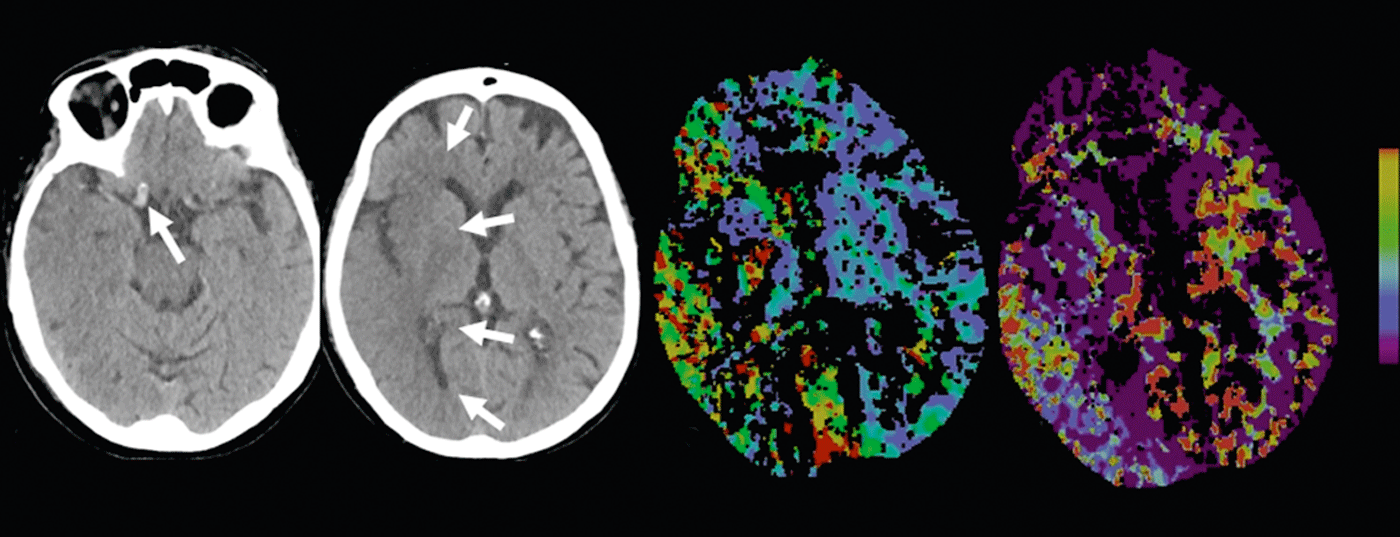
Infarto cerebral: El TAC nativo puede mostrar los llamados signos precoces de infarto. Por ejemplo, las reducciones de densidad de la sustancia gris con la desdiferenciación corticomedular causada por el edema del infarto – o el signo arterial hiperdenso, causado por el aumento de densidad con trombo intraluminal (Fig. 2 y 3).
Según la bibliografía, la sensibilidad en la detección de signos precoces de infarto varía entre el 12 y el 92% y depende principalmente de la duración de la isquemia. Las zonas de infarto demarcadas en la TC nativa son muy específicas del daño parenquimatoso irreversible y tienen importancia pronóstica [7]. Por ejemplo, si más de un tercio del territorio mediastínico muestra demarcación de infarto, el riesgo de hemorragia del paciente aumenta con la terapia trombolítica iv.
IRM
El mejor método para visualizar el daño parenquimatoso isquémico es la IRM, que puede visualizar el infarto en cuestión de minutos, debido al edema citotóxico. Esto conduce a una reducción del movimiento molecular browniano y, por tanto, al trastorno de difusión detectable en la DWI, que corresponde al núcleo del infarto irreversiblemente dañado. Los estudios de perfusión por resonancia magnética pueden revelar déficits de perfusión que también infartan en ausencia de reperfusión (“tejido en riesgo”). Este desajuste difusión-perfusión (concepto de penumbra) se ha estudiado intensamente en la última década y se considera un concepto atractivo para la selección de pacientes para las terapias de reperfusión [5]. El estado vascular intra y extracraneal del paciente también puede visualizarse mediante angiografía por RM y revelar oclusiones vasculares.
En la rutina clínica, sólo unas pocas clínicas pueden ofrecer una resonancia magnética para el diagnóstico del ictus agudo; además, el tiempo de examen es más largo, la logística más compleja y, en última instancia, sólo puede establecerse como diagnóstico agudo estándar si la infraestructura es muy buena.
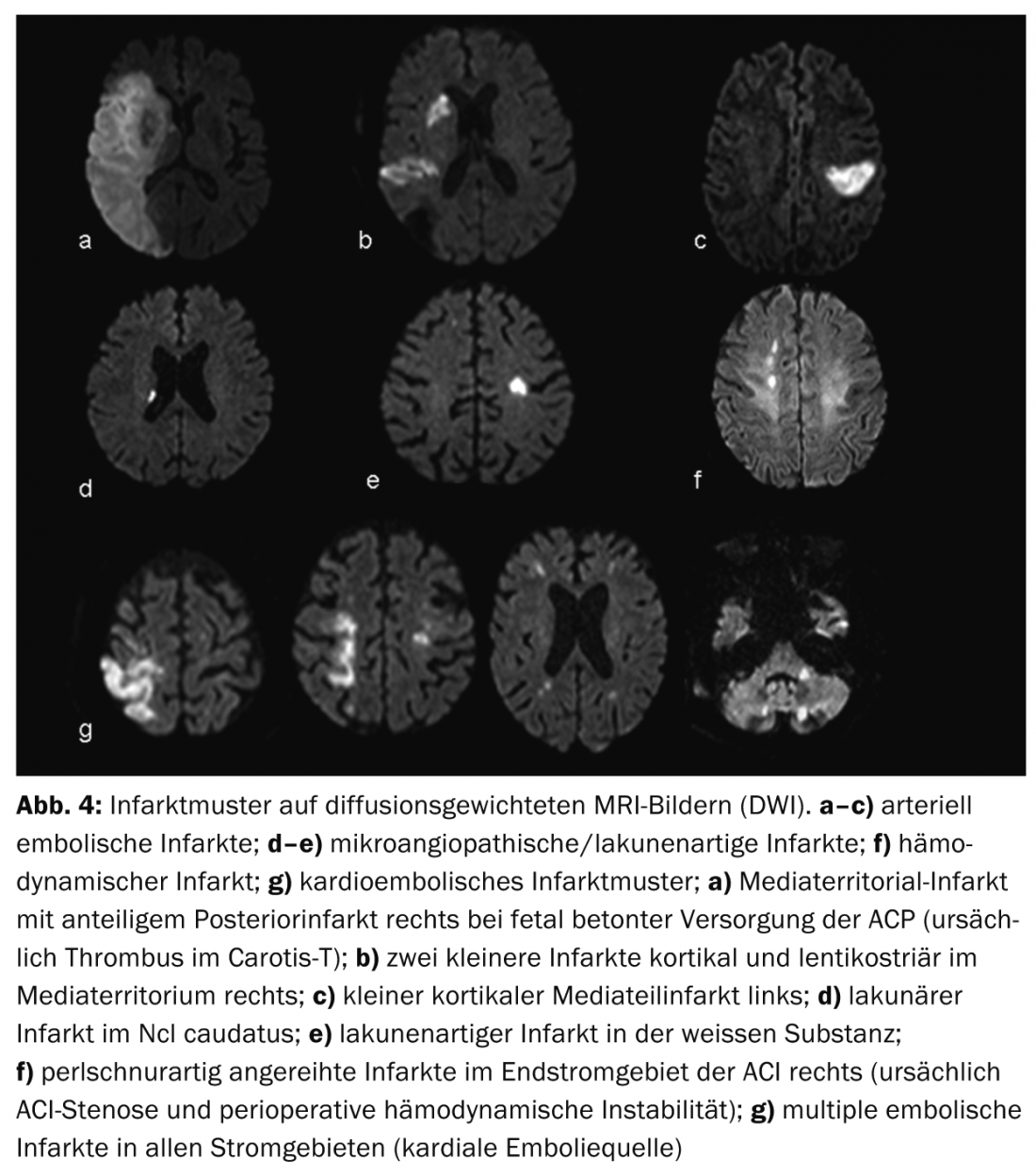
Las ventajas de la RM son una mejor visualización de los patrones del infarto y, por tanto, una mejor evaluación de la etiología del infarto (Fig.4) así como una mejor diferenciación de los diagnósticos diferenciales, los llamados imitadores del ictus, por ejemplo, vasculitis, tumores o enfermedades desmielinizantes inflamatorias del SNC. (Fig.5). El concepto de penumbra es especialmente útil para tomar decisiones terapéuticas en casos de ictus con una ventana temporal poco clara (los llamados “ictus de despertar”).
Protocolo moderno de ictus por TC
Con la tecnología moderna de TC, la sensibilidad para detectar el infarto cerebral isquémico puede aumentarse significativamente añadiendo la perfusión por TC mejorada con KM y la angiografía por TC.
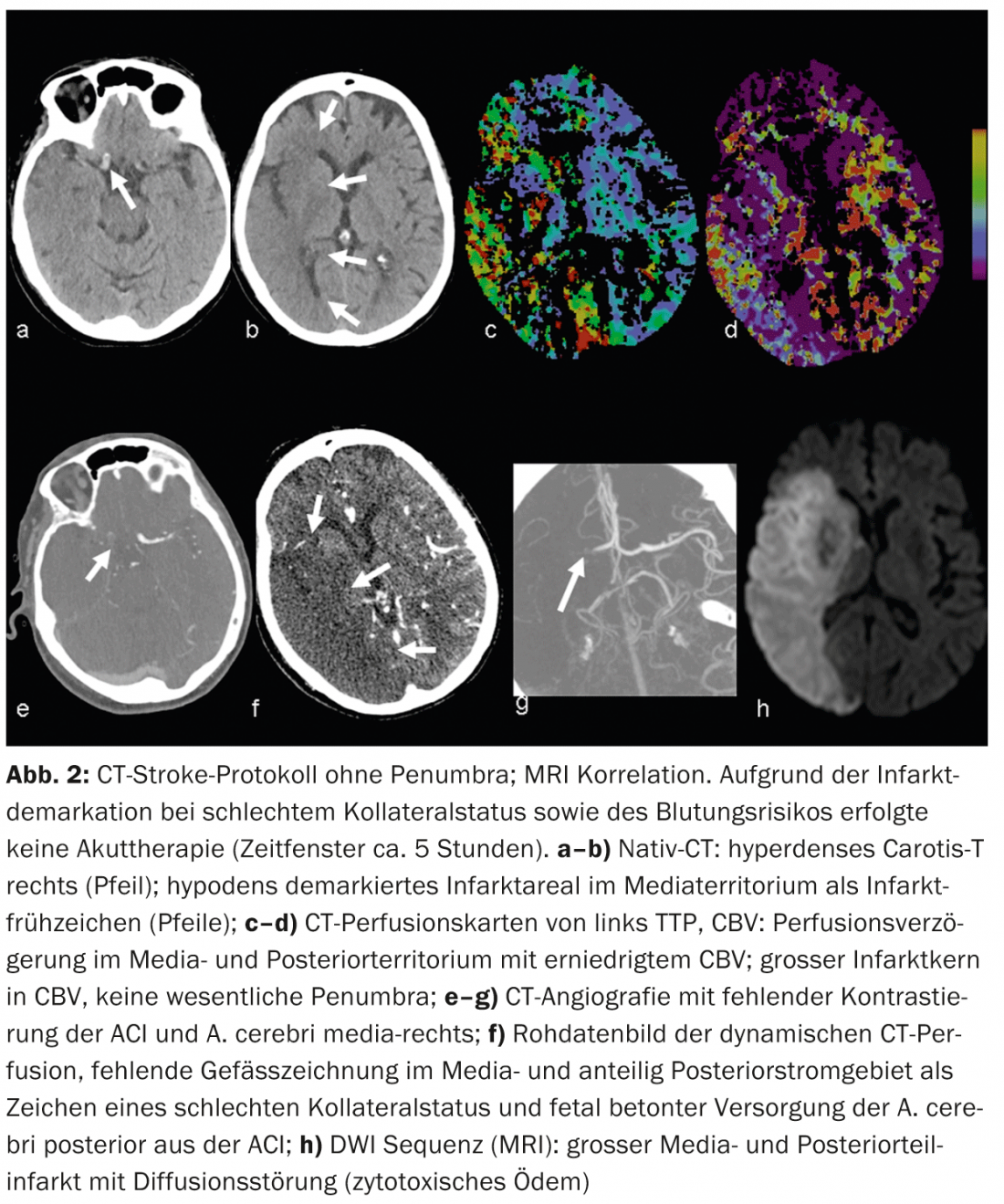
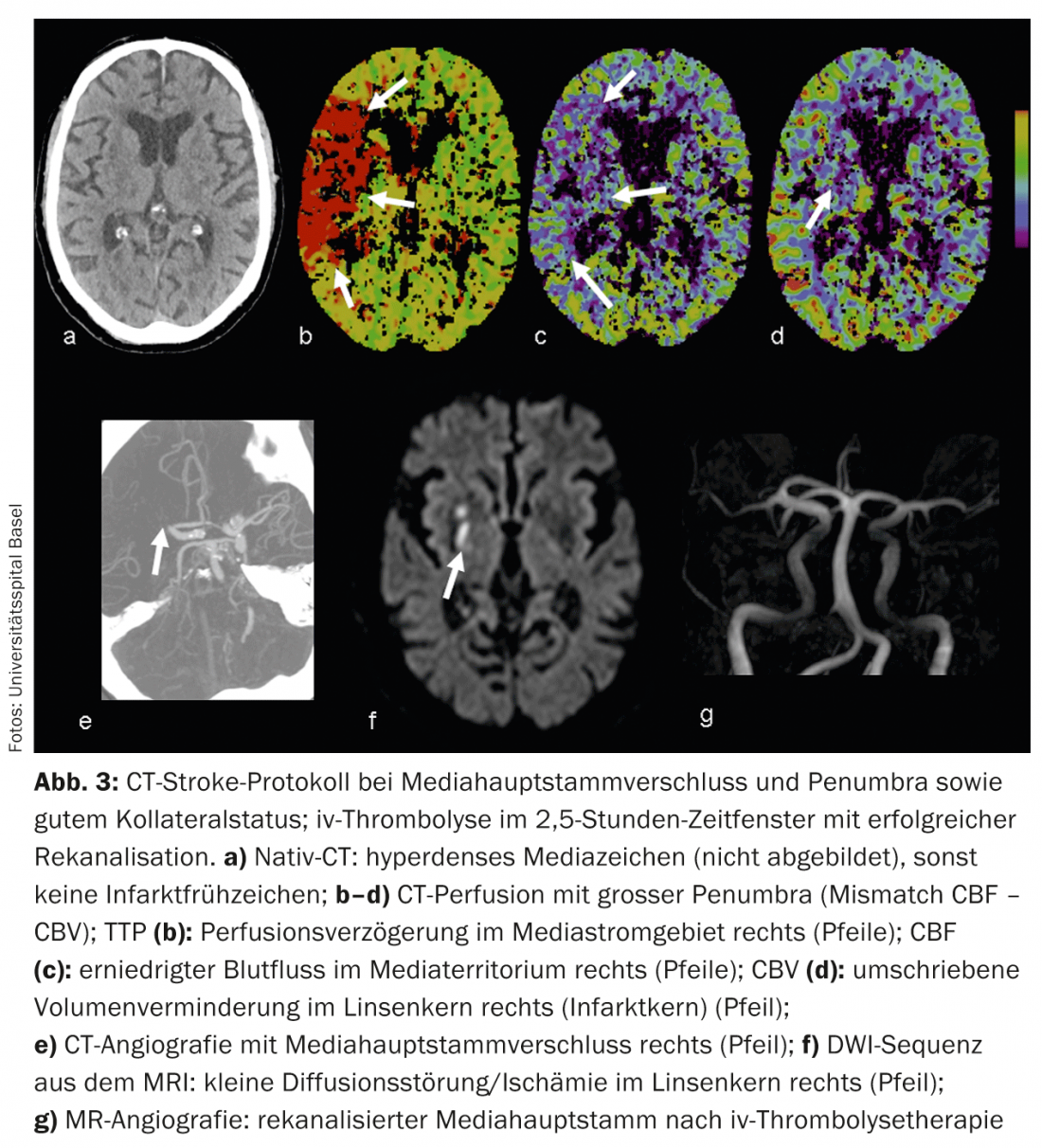
ATC: La ATC con realce de contraste representa con fiabilidad la anatomía vascular, la patología y la colateralización. El estado de las colaterales vasculares se ha convertido cada vez más en el centro del interés clínico y científico. Individualmente, el estado de las colaterales puede tener un impacto significativo en el momento de la cascada isquémica. La colateralización intacta tiene importancia pronóstica [8]; además del lema “el tiempo es cerebro”, también se habla de “la colateralización es cerebro”. El suministro colateral del parénquima cerebral tiene lugar a través del circulus arteriosus Willisi, anatómicamente variado de forma individual, como red primaria, y también a través de anastomosis leptomeníngeas entre los diversos territorios vasculares como red secundaria. La forma y el número de anastomosis, así como su capacidad compensatoria, son variables individualmente [9]. El estado colateral de un paciente puede justificar una terapia de recanalización mecánica fuera de la ventana temporal de 4,5 horas. Conociendo el estado colateral individual, se puede seleccionar mejor a los pacientes para las distintas formas de terapia (Fig. 2 y 3).
CTP: La perfusión por TC es una TC dinámica tras la administración de un bolo de contraste iv durante un periodo aproximado de 45 segundos. Los complejos algoritmos de deconvolución transfieren los datos a mapas de parámetros funcionales. CBV denota el volumen sanguíneo cerebral (fisiológicamente 4-5 ml/100 g de masa cerebral), CBF denota el flujo sanguíneo cerebral, MTT denota el tiempo medio de tránsito como el intervalo de tiempo entre la entrada arterial y la salida venosa, y TTP denota el tiempo hasta el pico como el intervalo de tiempo entre la inyección del bolo y el pico máximo de contraste. La evaluación de los datos brutos es semiautomatizada y rápida. Según el concepto de desajuste, la evaluación de los mapas funcionales permite pronunciarse sobre el tamaño de la alteración de la perfusión (“tejido en riesgo”) y el núcleo del infarto irreversiblemente dañado. De este modo, la estimación de una penumbra también es posible en TC en pocos minutos.
En la isquemia aguda, el flujo sanguíneo cerebral disminuye. Debido a la expansión reactiva del lecho capilar -con una autorregulación inicialmente intacta- el volumen sanguíneo permanece inicialmente estable. Si la autorregulación se descompensa, especialmente con un mal estado de las colaterales, el VSC disminuye [10]. Las zonas con disminución del VSC corresponden al parénquima cerebral infartado de forma irreversible y se correlacionan bien con la zona de difusión alterada en la IRM (Fig.2 y 3). Las zonas con CBV normal pero MTT o CBF alterados corresponden al “tejido en riesgo”, el tejido potencialmente salvable. (Fig.3). La sensibilidad para la detección del infarto es significativamente mayor para la perfusión por TC (68-83%) en comparación con la TC nativa sola (19-45%) o la TC nativa más ATC (hasta el 58%), dependiendo cada una del tamaño del infarto [2]. Los hallazgos de perfusión por TC falsos negativos se encuentran en infartos pequeños/lacunares o en infartos fuera de la sección del cerebro examinada, aunque los modernos escáneres multicorte pueden cubrir ahora casi todo el cerebro en un solo examen.
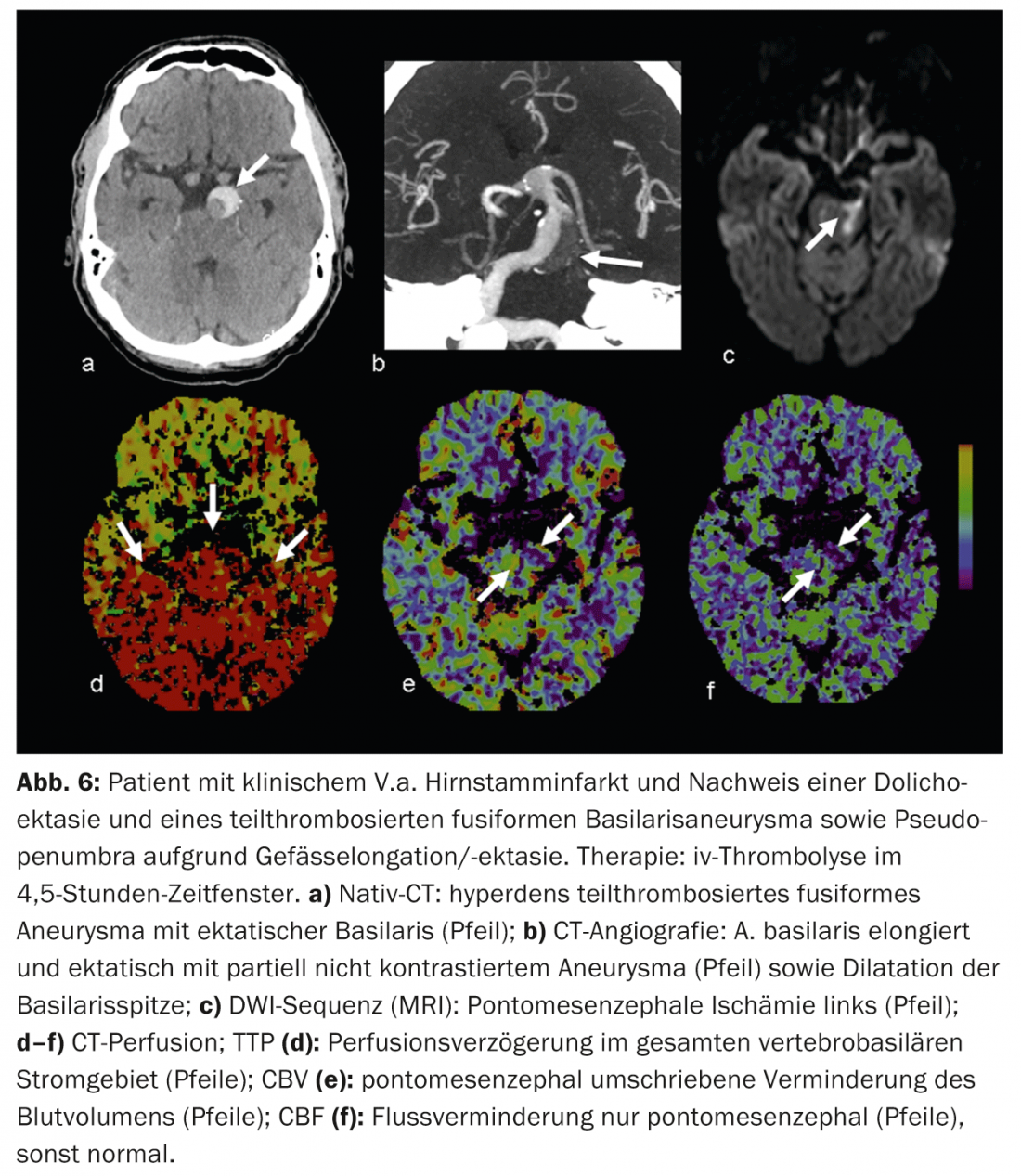
Los hallazgos falsos positivos están causados, por ejemplo, por enfermedades cardiovasculares concomitantes que pueden provocar un retraso crónico de la perfusión y no deben confundirse con una “pseudopenumbra”, por ejemplo, la reducción de la función del gasto cardiaco en la insuficiencia cardiaca, las estenosis vasculares ascendentes de mayor grado (sobre todo las estenosis ACI), las oclusiones o incluso las dolicoectasias (por ejemplo, en la circulación posterior) (Fig. 6).
Dra. Johanna M. Lieb
Literatura:
- Hacke W, et al: Trombolisis con alteplasa entre 3 y 4,5 horas después de un ictus isquémico agudo. N Engl J Med 2008; 359: 1317-1329.
- Campbell BCV, et al: La perfusión por TC mejora la precisión diagnóstica y la confianza en el ictus isquémico agudo. J Neurol Neurosurg Psychiatry 2013; 84: 613-618.
- Mokin M, et al: Tratamiento endovascular del ictus isquémico agudo: ¿el final o sólo el principio? Neurosurg Focus 2014 Ene; 36(1): 1-10.
- Broderick JP, et al: Interventional Management of Stroke (IMS) III Investigators. Terapia endovascular tras t-PA intravenoso frente a t-PA solo para el ictus. N Engl J Med 2013 Mar 7; 368(10): 893-903
- Campbell BC, et al: Comparación de la perfusión por tomografía computarizada y el desajuste perfusión-difusión por resonancia magnética en el ictus isquémico. Ictus 2012 Oct; 43(10): 2648-2653.
- Dani KA, et al: Revisión sistemática de las imágenes de perfusión con tomografía computarizada y resonancia magnética en el ictus isquémico agudo: heterogeneidad de los parámetros de adquisición y posprocesamiento: un estudio multicéntrico de imágenes de ictus agudo de la colaboración para la investigación en medicina traslacional. Ictus 2012 feb; 43(2): 563-566.
- Nabavi DG, et al: MOSAIC: Multimodal Stroke Assessment Using Computed Tomography: novel diagnostic approach for the prediction of infarction size and clinical outcome. Ictus 2002; 33: 2819-2826.
- Nambiar V, et al: ATC-Estado colateral y respuesta a la recanalización en pacientes con ictus isquémico agudo. AJNR Am J Neuroradiol 2013 Dic 26. [Epub ahead of print]
- Liebeskind DS: Circulación colateral. Ictus 2003; 34: 2279-2284.
- Ahlhelm F, et al: Diagnóstico neurorradiológico focalizado en el ictus agudo. Therapeutische Umschau 2012; 69(9): 6.1-6.6.
InFo Neurología y Psiquiatría 2014; 12(2): 8-13