Los cambios cutáneos que se producen en la hidradenitis supurativa (HS), sobre todo en las zonas intertriginosas, pueden ser muy angustiosos para los afectados. Desde hace algunos años, se ha intensificado la investigación sobre las complejas interrelaciones con la esperanza de reducir el número de casos de HS. El conocimiento de esta afección, que a menudo se asocia a comorbilidades/comorbilidades, es crucial para poder proporcionar a los afectados un tratamiento adecuado.
La hidradenitis supurativa -también conocida como acné inverso- es una enfermedad crónica y recurrente caracterizada por bultos, abscesos y fístulas dolorosos y recurrentes como resultado de la inflamación del folículo piloso. “Es un cuadro clínico bien conocido, pero sólo ha recibido suficiente atención en las dos últimas décadas”, explica a PD la Dra. Cornelia Erfurt-Berge, médico jefe de la Clínica Dermatológica del Hospital Universitario de Erlangen [1]. La fisiopatología se comprende ahora mucho mejor que hace unos años, aunque aún queden preguntas sin respuesta. “Lo que sí sabemos es que se produce una reacción inflamatoria excesiva en la zona del folículo piloso y que ciertas toxinas ambientales/factores exógenos como el tabaquismo o la obesidad desempeñan un papel”, afirmó el ponente. Se supone que la hiperqueratosis conduce en última instancia a la oclusión folicular y que la inflamación y los focos de bacterias se forman en el tejido circundante como resultado del cierre de las glándulas apocrinas y la posterior ruptura de los folículos [1,8].
Se activan las vías de señalización proinflamatorias
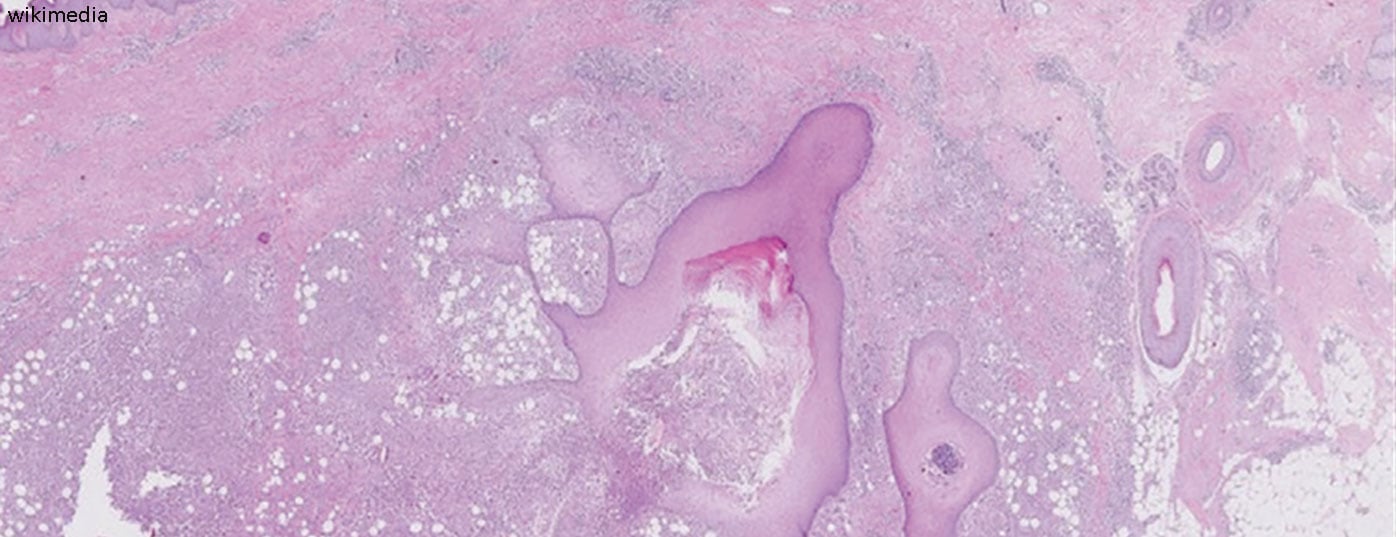
El hecho de que la oclusión folicular se produzca inicialmente debido a la hiperqueratosis puede deducirse de los exámenes histológicos [2,8]. El cierre de las glándulas apocrinas y la posterior ruptura de los folículos pilosos induce una respuesta inmunitaria inflamatoria asociada al reclutamiento de neutrófilos, macrófagos, células B y células Th1 y Th17 en la piel, lo que da lugar a nódulos inflamatorios o a la formación de abscesos [2]. Las vías de señalización proinflamatorias contribuyen significativamente al desarrollo de la HS. En relación con el desplazamiento de las células T, se produce un aumento de la producción de citocinas proinflamatorias como el TNF-alfa y la interleucina (IL)-17, que contribuyen al mantenimiento de la inflamación. También existen pruebas de que los receptores tipo Toll se regulan de forma diferente en la HS que en la piel sana y de que los péptidos antimicrobianos para la defensa bacteriana tienen un patrón de expresión alterado [1]. “Se trata de interrelaciones complejas que cada vez comprendemos mejor”, resumió la Dra. Erfurt-Berge.
Reforzar la concienciación y evitar la latencia diagnóstica
Si la HS no se diagnostica a tiempo y no se trata adecuadamente, pueden desarrollarse complicaciones o alteraciones secundarias, como la formación de tractos fistulosos y cicatrices en zonas intertriginosas (axilares, inguinales, genitales). Según el ponente [1], esto puede provocar considerables restricciones de movimiento. La calidad de vida de los pacientes con HS suele estar muy limitada. Mujeres y hombres se ven afectados en un número aproximadamente igual; en cuanto al grupo de edad, la prevalencia es mayor entre los jóvenes, con una edad media de unos 23 años [1]. Se han producido mejoras en términos de diagnóstico en los últimos años, pero la latencia del diagnóstico sigue siendo un problema, subrayó el ponente [1]. El diagnóstico de la HS se realiza principalmente de forma clínica; el criterio temporal es de al menos dos recaídas en un plazo de seis meses. La enfermedad se confunde a menudo con abscesos comunes o foliculitis en las primeras fases.
Existen varias puntuaciones para clasificar la HS, siendo las más comunes la puntuación de Sartorius y las etapas de Hurley [3–5]. Con la puntuación Sartorius se evalúa con puntos el número de nódulos inflamatorios, abscesos, fístulas y zonas afectadas. La clasificación de Hurley distingue entre los tres grados de gravedad siguientes en función de la manifestación clínica [4,6].
- Fase I: Abscesos dolorosos aislados, únicos o múltiples, sin filamentos cicatriciales;
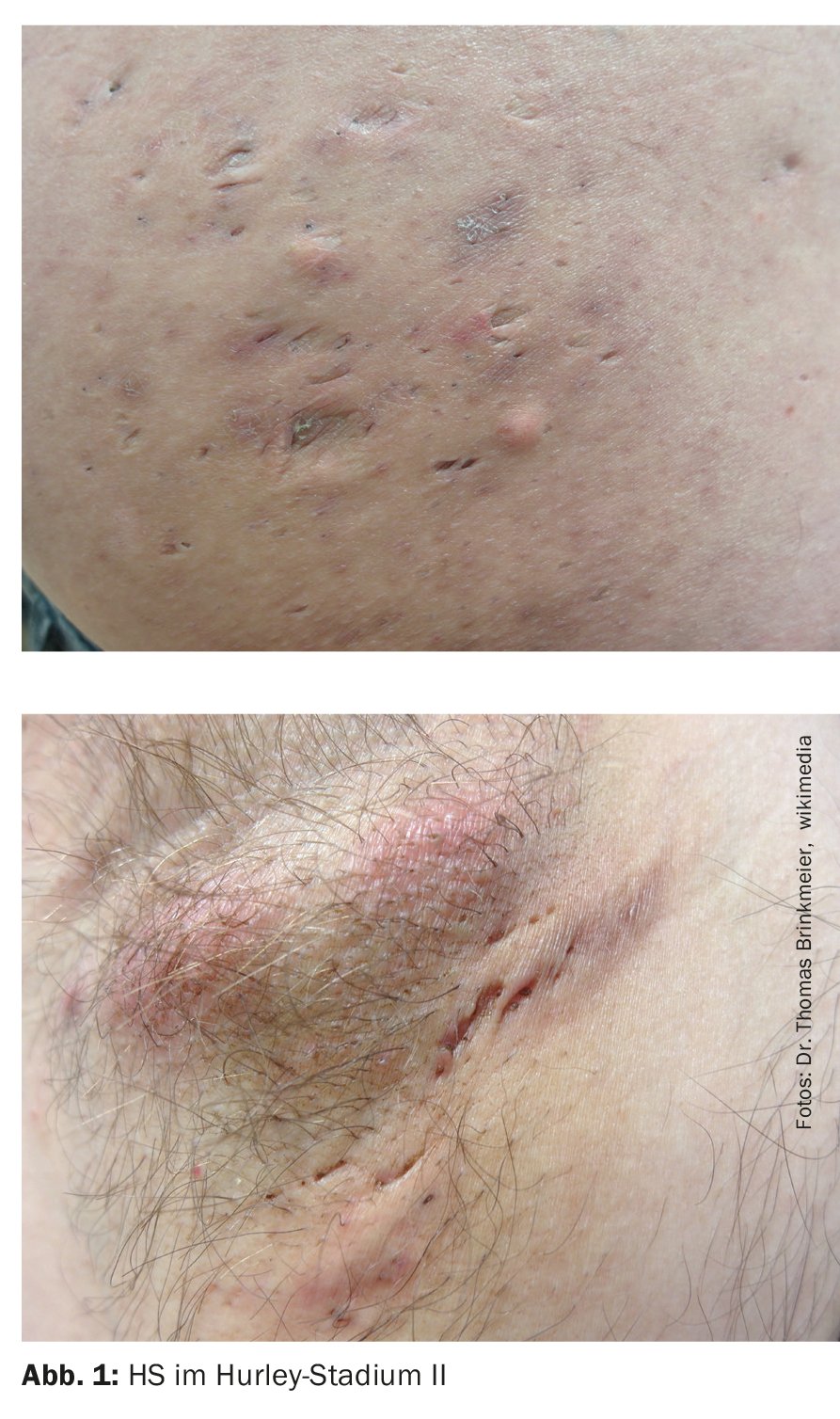
- Estadio II: abscesos dolorosos recurrentes con formación de cordones y cicatrices, únicos o múltiples, pero no extensos (Fig. 1);
- Estadio III: Infiltraciones difusas, en forma de placa, inflamatorias y dolorosas, o múltiples filamentos y abscesos interconectados. Existe un riesgo de contracturas articulares como resultado de la restricción de movimiento relacionada con el dolor.
También debe tenerse en cuenta que la HS suele asociarse a comorbilidades y enfermedades concomitantes, cuya posible presencia debe indagarse. Entre ellos se encuentran los problemas articulares, la enfermedad inflamatoria intestinal crónica (EII), el síndrome metabólico, la obesidad y la diabetes [2,7]. Estos factores pueden tener un efecto negativo en los síntomas de la HS. Los trastornos psiquiátricos también son más frecuentes. En general, la calidad de vida con la HS suele verse afectada de forma significativa.
¿De qué enfoques terapéuticos disponemos hoy en día?
Si es posible, los pacientes con HS deben recibir un tratamiento adecuado antes de que los focos de absceso se fusionen y se formen los tractos fistulosos. El tratamiento depende de la gravedad de la enfermedad. El tratamiento quirúrgico sigue considerándose la regla de oro, sobre todo para las formas graves de HS, pero el tratamiento farmacológico sistémico es cada vez más importante, afirma la Dra. Erfurt-Berge. Si es necesario, pueden combinarse la cirugía y la terapéutica sistémica. La escisión local sólo es una opción para el estadio I de Hurley. Las incisiones puras siempre dan lugar a recidivas. Otra técnica es el deroofing (electrocirugía, láser). En casos especialmente graves (Hurley II o III), se requiere una amplia resección “en bloque” para extirpar toda la zona afectada [8]. Además de la clindamicina/rifampicina como terapias sistémicas convencionales, en la actualidad se dispone de dos productos biológicos, el adalimumab y el secukinumab, para el tratamiento farmacológico y se están investigando otros en ensayos clínicos [1]. La indicación de la clindamicina de aplicación tópica se limita a los estadios I y II de Hurley. Las medidas complementarias importantes en el tratamiento de la HS son los factores relacionados con el estilo de vida, como la reducción de peso, dejar de fumar y llevar ropa holgada [1].
Congreso: Wound Congress Nuremberg
Literatura:
- “Acné inverso – nuevos conocimientos sobre un cuadro clínico bien conocido”, PD Dr med C. Erfurt-Berge, Congreso de Heridas de Núremberg, 23-24 de noviembre de 2023.
- Vossen A, van der Zee HH, Prens EP: Hidradenitis supurativa: Una revisión sistemática que integra las vías inflamatorias en un modelo patogénico cohesivo. Front Immunol 2018; 9: 2965.
- Hunger RE, et al: Recomendaciones prácticas suizas para el tratamiento de la hidradenitis supurativa/acné inverso. Dermatología 2017; 233: 2-3.
- Revuz J: Hidradenitis supurativa. JEADV 2009; 23: 985-998.
- Hunger RE, et al: Recomendaciones prácticas suizas para el tratamiento de la hidradenitis supurativa (acné inverso). Compass Dermatol 2019; 7 (1): 8-13.
- Hurley HJ: Hiperhidrosis axilar, bromhidrosis apocrina, hidradenitis supurativa y pénfigo benigno familiar: abordaje quirúrgico. En: Roenigk RK, Roenigk HH, Jr. [Eds]. Cirugía dermatológica: principios y práctica.2ª ed. Nueva York: Marcel Dekker 1996: 623-645.
- Molinelli E, et al: Nueva visión del patomecanismo molecular y los tratamientos inmunomoduladores de la hidradenitis supurativa. Int J Mol Sci 2023; 24(9): 8428.
- Zouboulis CC, et al. : Directriz europea S1 para el tratamiento de la hidradenitis supurativa/acné inverso. JEADV 2015; 29(4): 619-644.
DERMATOLOGIE PRAXIS 2024; 34(1): 38-39 (publicado el 19.2.24, antes de impresión)