Se pueden detectar trazas de gadolinio en los tejidos tras múltiples aplicaciones con métodos químicos modernos, incluso durante un periodo de tiempo más largo, pero sin relevancia clínica ni secuelas asociadas. No obstante, recientemente se han impuesto restricciones a algunos preparados de gadolinio en la UE.
Introducidos clínicamente en 1989, los compuestos de gadolinio como medios de contraste (Gd-KM) iniciaron pronto una marcha triunfal gracias al potencial de la resonancia magnética (RM) pero también a su buena tolerabilidad, sobre todo en comparación con los medios de contraste para TC. Populares al principio para acortar algo los largos tiempos de examen, los compuestos de gadolinio se utilizaron cada vez más y también en dosis crecientes en la ponderación del contraste T1 en la IRM. El gadolinio acorta y cataliza el tiempo de relajación T1 de los protones que zumban alrededor del átomo en las inmediaciones y aumenta así la llamada señal T1. Esto permite una mejor detección y caracterización de determinadas lesiones. Utilizado inicialmente sólo para cuestiones del SNC con el fin de facilitar la detección de patologías, su caracterización y el seguimiento de la respuesta a un tratamiento, el campo se amplió para incluir cuestiones clínicas prácticamente en todo el organismo [1,2]. Se creía que el KM de RM que contenía gadolinio sería excretado rápida y completamente por el organismo.
Indicaciones para el uso del Gd-KM
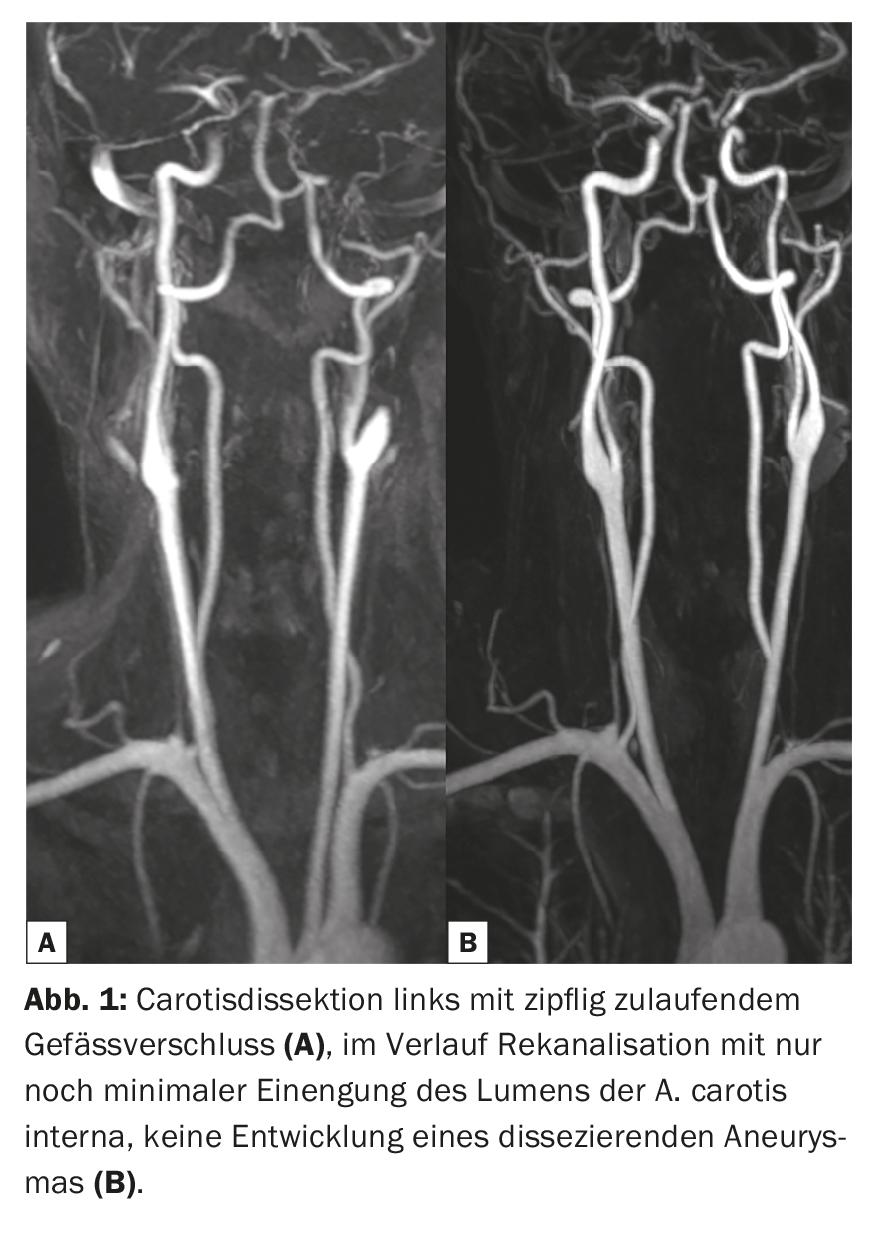
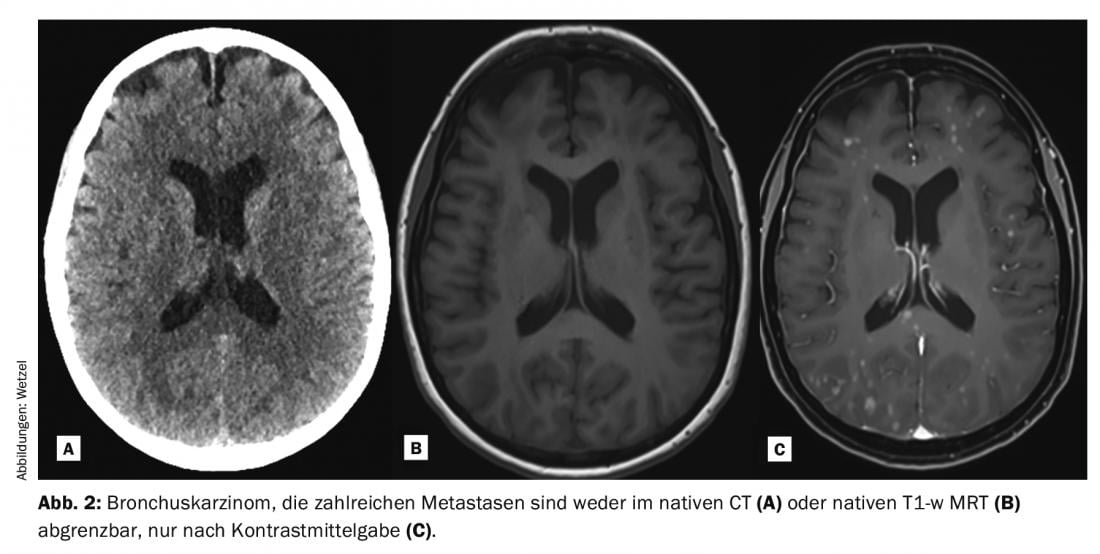
En la práctica clínica, las secuencias de impulsos amplificadas Gd-KM ponderadas en T1 suelen medirse y convertirse en imágenes después de los exámenes nativos. Esto se hace en todo el cuerpo, dependiendo del problema, aunque las patologías individuales sean más propensas a depender del uso de Gd-KM que otras. Gracias al aumento de la señal T1 de los protones (ricos en señal) en las lesiones contrastadas tras la Gd-KM, a menudo pueden detectarse y delimitarse mejor del tejido circundante. Los requisitos previos para que la señal cambie son la ponderación T1, la dosis correcta y las propiedades cinéticas específicas, especialmente en la zona del SNC con el paso a través de la barrera hematoencefálica alterada. Las indicaciones típicas por las que se administra Gd-KM para evaluar el parénquima cerebral son el diagnóstico de enfermedades tumorales, esclerosis múltiple, enfermedades inflamatorias y patologías vasculares (Fig. 1-3). A pesar de los enormes avances técnicos, existen numerosas patologías y lesiones que aún hoy sólo pueden visualizarse gracias a la administración de medios de contraste. Por ello, las Gd-KM también se utilizan a menudo simplemente para descartar una patología [3]. Otra indicación importante de la Gd-KM es la obtención clásica de imágenes de las zonas de paso del flujo vascular, principalmente la zona arterial. La obtención de imágenes sin radiación de estenosis vasculares, obstrucciones o derivaciones fue posible por primera vez con la IRM y el Gd-KM.
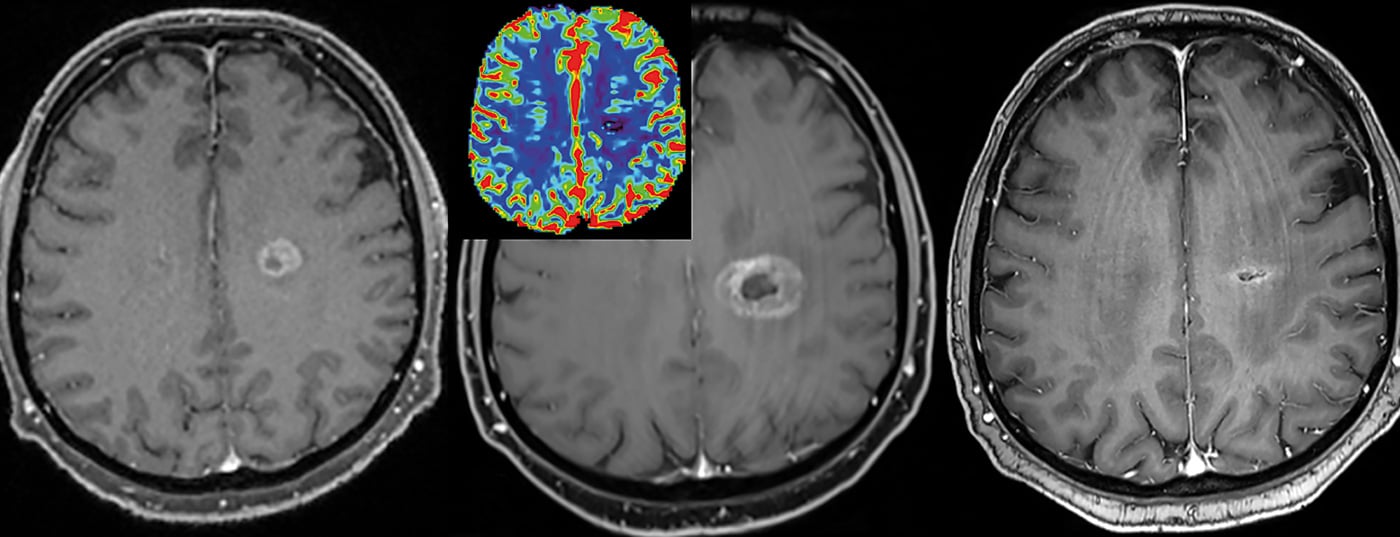
El análisis de perfusión por RM representa otra área más reciente en la aplicación de la KM. En los tumores, a menudo se produce un aumento del contraste entre el tumor y el tejido circundante debido a una mayor vascularización, denominada neoangiogénesis, y a una fuga vascular más pronunciada, denominada aumento de la “permeabilidad vascular” (fuga). La inundación del medio de contraste en focos tumorales, inflamaciones o infecciones suele producirse con curvas características de entrada y salida, y a menudo sólo permite interpretar una cuestión clínica que seguiría sin estar clara sin medio de contraste.
Hoy en día, la caracterización de la perfusión de los focos sospechosos se realiza cada vez más mediante modelos farmacocinéticos. Además de mejorar la detección, el contraste correlacionado con el flujo sanguíneo también puede caracterizar mejor la progresión de un foco tumoral y su agresividad. Los patrones típicos de perfusión pueden desglosarse de forma muy específica mediante imágenes codificadas por colores de otros puntos finales y codificarse píxel a píxel de forma específica para cada lugar.
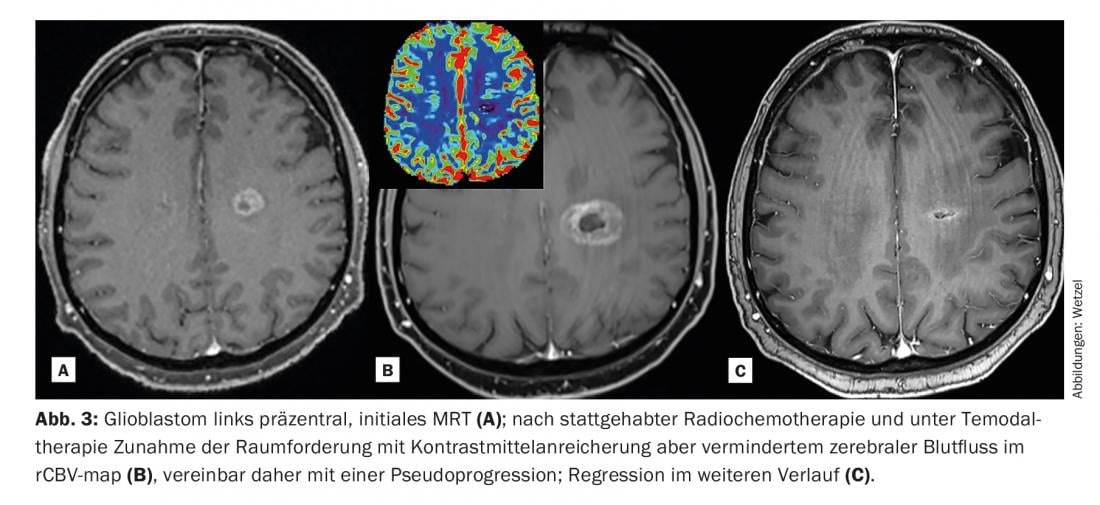
Esto permite captar y diferenciar mejor la heterogeneidad de un tumor [2]. Esto a su vez tiene consecuencias para el tratamiento posterior y para el seguimiento de la terapia (especialmente también para la radioterapia). De este modo, las lesiones pueden seguirse relativamente bien a lo largo del tiempo y, en particular, caracterizarse y controlarse mediante puntos de esquina cuantitativos.
Propiedades del Gd-KM
El gadolinio se utiliza gracias a su actividad “superúnica”: es el único elemento en solución que tiene siete espines de electrones individuales (singles) que interactúan de forma ideal con los protones del agua en los tejidos. Las soluciones de gadolinio presentan así una marcada propiedad paramagnética. El intercambio de energía entre los electrones del gadolinio en sus capas de valencia externas y los protones excitados por la señal de RM es lo que hace posible, en primer lugar, el aumento del contraste en la imagen T1. De este modo, los tiempos T1 más cortos dan lugar a más señal y también a patrones de contraste selectivos allí donde se propaga el agente de contraste. Aunque se hable de forma simplista del gadolinio como agente de contraste de RM, hay que subrayar que los complejos de gadolinio se utilizan realmente de forma clínica como agentes de contraste de RM (=Gd-KM). Están formados por el átomo central (Gd3+) y los quelantes o ligandos que los rodean. Los quelantes o ligandos se unen al gadolinio con extrema fuerza para que se forme un enlace complejo. Las sustancias activas están disponibles disueltas en forma de soluciones estandarizadas de gadolinio (Gd-KM), que normalmente pueden inyectarse i.v. o diluirse intraarticularmente. En comparación con los medios de contraste para TC, tienen una concentración más baja y, por tanto, también una exposición sistémica menor (aprox. 0,01 mol con Gd-KM frente a 0,1 mol con los medios de contraste para rayos X).
Los complejos de gadolinio son muy hidrosolubles, se distribuyen vascular e intersticialmente con una semivida de distribución de unos dos a cinco minutos y, si son nefrotrópicos, se excretan renalmente sin cambios por filtración glomerular con una semivida de eliminación de unos 90 min. Pequeñas cantidades de Gd-KM atraviesan la barrera placentaria o también pueden detectarse en la leche materna. En el MRKM hepático-específico, se produce una cinética asociada al receptor con captación selectiva por los hepatocitos y excreción en los conductos biliares junto con una eliminación renal paralela. La receptividad hepática es el resultado de los grupos laterales específicos de los receptores aniónicos que se han unido a los ligandos.
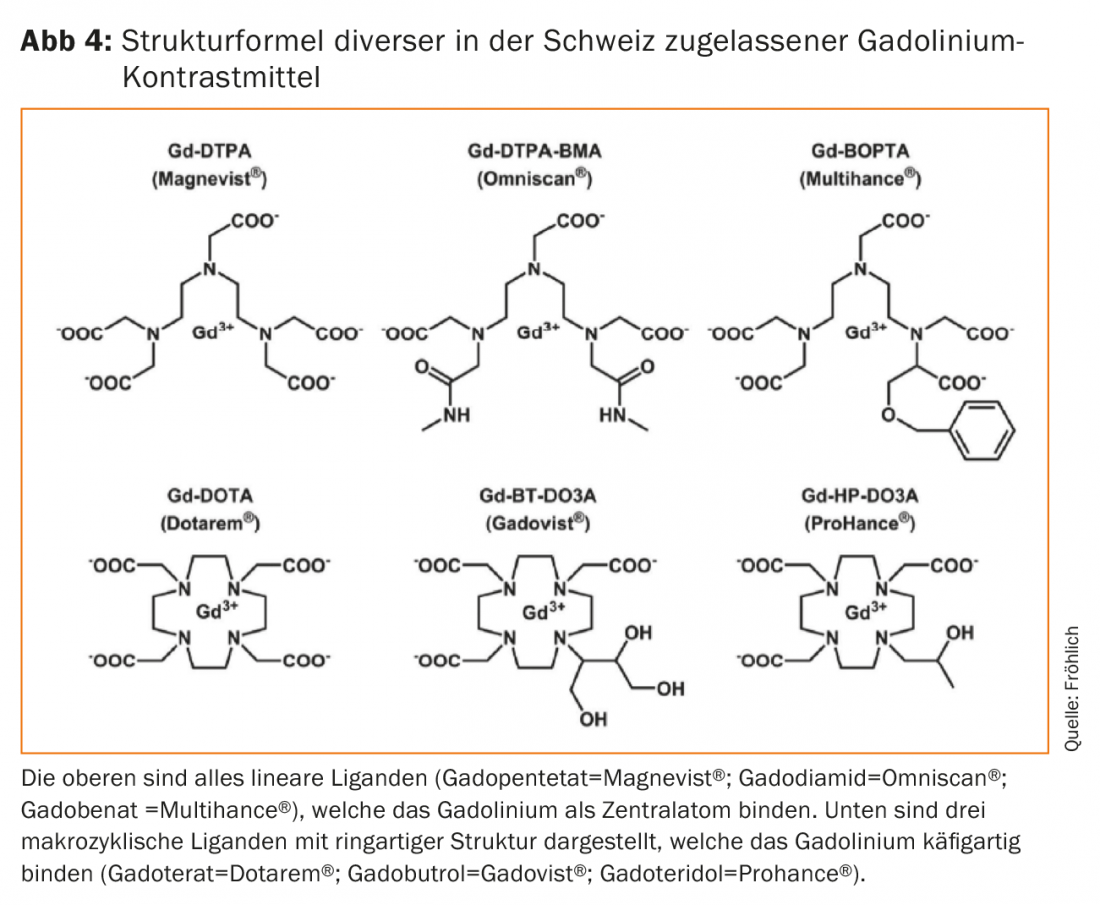
Los ligandos que se unen termodinámicamente al gadolinio están presentes en una estructura cíclica en forma de anillo como los llamados macrociclos o en forma de cadena como ligandos lineales (Fig. 4) . Los macrociclos resultan ser significativamente más estables desde el punto de vista termodinámico, aunque la importancia clínica de esta propiedad no se reconoció hasta más tarde. Si el gadolinio se disocia del enlace complejo -es decir, se libera del enlace complejo, por así decirlo- precipita en forma de hidróxido o fosfato en el plasma, se acumula en el hígado, el bazo así como en los macrófagos e interactúa como bloqueador del calcio con numerosos procesos metabólicos dependientes del calcio (coagulación sanguínea, respiración mitocondrial, recambio óseo). La evaluación de los efectos tóxicos se complica aún más por las interacciones con electrolitos endógenos como el zinc, el hierro, el cobre o incluso el calcio. Así pues, el objetivo está claro, hay que evitar por todos los medios que el gadolinio se libere del complejo de unión [5].
Fibrosis sistémica nefrogénica [6]
El gadolinio sufrió un primer revés en 2006, cuando el joven nefrólogo Thomas Grobner, de la Landesklinikum Wiener Neustadt, observó por primera vez una conexión entre la administración de gadolinio en cinco de sus pacientes en diálisis y el empeoramiento significativo de una misteriosa enfermedad cutánea inexplicable hasta entonces (dermopatía fibrótica nefrogénica) [7]. La misteriosa enfermedad apareció por primera vez en racimos en algunas ciudades estadounidenses en 1997 y no se publicó en “The Lancet” hasta el año 2000 [8]. Sólo tres años después, la enfermedad pasó a denominarse “Fibrosis Sistémica Nefrogénica (FSN)” debido a la fibrosis sistémica letal con la correspondiente cicatrización interna (activación fibrocitaria) en determinados pacientes [9]. No fue hasta 2011 cuando la enfermedad quedó claramente definida y acotada, tanto histopatológica como clínicamente [10]. Siguieron numerosas series de casos, aumentando constantemente el temor a la FSN, así como las especulaciones sobre su desencadenante. Las hipótesis iban desde un problema de diálisis (aunque no todos los afectados eran pacientes en diálisis) hasta agentes infecciosos. Ni siquiera el registro llevado a cabo por Cowper en Yale, con más de 300 casos, pudo ofrecer una explicación plausible para el FNS. Sólo Grobner y un poco más tarde el grupo de Copenhague en torno a Henrik Thomsen resolvieron parcialmente el misterio. Aparentemente, el Gd-KM circuló en las insuficiencias renales hasta que se disoció en casos individuales, especialmente con compuestos complejos más inestables, y se liberó en el tejido. En ciertos pacientes, esto provocó una intoxicación parecida a un cuerpo extraño, muy dolorosa, con una movilización y una proliferación importantes de los llamados fibrocitos tisulares, un aumento de las cantidades de procolágeno de tipo I cuando se detectaron células CD34 positivas, más a menudo asociadas a complicaciones si son postoperatorias o con una disposición inflamatoria [11]. Un poco más tarde, se produjeron contracturas y alteraciones musculares importantes periféricas, pero también ocasionalmente en el tronco del cuerpo, con complicaciones posteriores. A pesar del uso de diferentes terapias, los pacientes sólo pudieron ser tratados con éxito en unos pocos casos.
Las autoridades farmacéuticas, primero la FDA estadounidense en junio de 2006 y un poco más tarde Swissmedic, reaccionaron de forma decidida y extremadamente rápida. Pidieron que se considerara cuidadosamente la posibilidad de realizar una resonancia magnética con contraste en pacientes con insuficiencia renal grave, que se utilizara la dosis más baja posible y que se prestara atención a los síntomas clínicos de alarma. Más tarde, en febrero de 2007, la EMA europea siguió con contraindicaciones para dos agentes de contraste de gadolinio inestables lineales en insuficiencia renal preexistente (eGFR<30ml/min/1,73m2). Las precauciones definidas en 2007 y posteriormente en 2011 destacan explícitamente los beneficios del gadolinio en un examen de IRM indicado. Para evitar nuevos casos de FSN, se protegió mejor a los pacientes con una función renal limitada y, por tanto, con tiempos de circulación más largos. Los medios de contraste lineales, inestables y sin excreción hepática prácticamente ya no podían utilizarse en caso de insuficiencia renal, de lo contrario se limitaban las dosis en la medida de lo posible y, en caso necesario, sólo se utilizaban preparados de gadolinio macrocíclico tras una cuidadosa evaluación de riesgos y beneficios. Estas recomendaciones se basaban, por un lado, en datos epidemiológicos que demostraban un mayor número relativo de casos de FNS con los MRKM lineales gadodiamida, gadoversetamida y gadopentetato, pero también en numerosos estudios preclínicos que demostraban las diferencias de estabilidad y sus consecuencias. Así, los macrociclos ganaron la condición de pacientes de riesgo, especialmente en pacientes con insuficiencia renal preexistente conocida. El gadoterato, que se había utilizado de forma prospectiva en varios cientos de pacientes que requerían diálisis en Francia sin provocar FSN, se consideraba relativamente seguro.
Depósitos de gadolinio en el cerebro
Ya a partir de 2010, gracias a las medidas en varias etapas, una restricción de la dosis, una mayor moderación, así como un cambio cada vez mayor al MRKM macrocíclico, no se produjeron nuevos casos de NSF, por lo que hubo un suspiro general de alivio [12] Hasta finales de 2014, cuando investigadores japoneses dirigidos por Tomonori Kanda publicaron en la revista Radiology, esta vez en pacientes renales, que habían hallado una correlación entre el número de exámenes repetidos de IRM con complejos de gadolinio y el aumento de las intensidades de señal en la imagen T1. [13]. Esto afectó principalmente al núcleo dentado así como al globo pálido ya en las imágenes nativas, por lo que los cambios de señal visibles sólo se describieron normalmente tras cinco o seis exámenes como resultado de la administración de preparados de gadolinio lineales bastante inestables. Posteriormente, también pudieron medirse fenómenos similares en otras estructuras del SNC [14]. Dado que también se habían descrito patrones de contraste similares en diversas intoxicaciones por metales, esclerosis múltiple o incluso tras la radiación, se cuestionó la especificidad del efecto. Un poco más tarde, en 2015, McDonald pudo demostrar que el aumento de las señales en el núcleo dentado de sus pacientes eran efectivamente depósitos de gadolinio [15]. El gadolinio pudo detectarse y localizarse químicamente. A menudo se producía en la zona perivascular, pero a veces también en zonas tisulares más distales. Cabe destacar que la forma en que el gadolinio se almacenaba en el tejido era cualquier cosa menos clara. Por lo tanto, queda por saber si el gadolinio en forma libre disociada estaba, en el mejor de los casos, unido a fosfatos o hidróxidos o si seguía persistiendo en el tejido en una forma unida compleja.
Siguieron numerosas series de casos retrospectivas que, al igual que Kanda, mostraron diferencias de señal significativas entre los complejos inestables y lineales y los preparados de gadolinio macrocíclicos, más estables. Los preparados macrocíclicos de gadolinio no provocaron ningún cambio de señal medible en la mayoría de los casos (ni siquiera tras su uso repetido), mientras que los más inestables provocaron prácticamente siempre un aumento de señal claramente medible en la IRM, en función del número de dosis de Gd-KM administradas. En realidad, los estudios con animales de principios de los años noventa del siglo pasado ya habían mostrado tales diferencias en el lavado de los complejos de gadolinio de los distintos tejidos, pero siempre se había supuesto que esto tenía poca importancia práctica. Los nuevos datos con cambios de señal aparentemente también visibles a largo plazo (respectivamente residuos) eran preocupantes, aunque no se pudiera asignar ninguna enfermedad o patología visible a estos cambios de señal. Esto hace que el cambio de señal T1 detectado recientemente en el tejido del SNC sea bastante diferente de la intoxicación asociada al gadolinio conocida como FSN. Especialmente porque los efectos a largo plazo no están claros, la EMA ordenó a finales de 2017 que la distribución de todos los compuestos lineales de gadolinio que no sean específicos para el hígado debe detenerse en Europa [16]. Las excepciones son los medios de contraste para la artrografía por RM directa (gadopentetato; Magnevist® 2.0 con 0,002 mol Gd/Lit) y el gadoterato macrocíclico (Artirem® con 0,0025 mol Gd/Lit). Ambos se inyectan directamente en las distintas articulaciones en dosis y concentraciones muy bajas y se utilizan clínicamente. Asimismo, siguen en el mercado los Gd-KM lineales específicos para el hígado, como el gadobenato (Multihance®) o el gadoxetato (Primovist®). Los MR-KM macrocíclicos gadoterato (Dotarem®), gadobutrol (Gadovist®) o gadoteridol (Prohance®) pueden seguir utilizándose en diagnóstico a la dosis más baja posible gracias a su compleja estabilidad. El gadolinio, como átomo central potencialmente tóxico, puede ser atrapado mejor en entropía y también cinéticamente gracias a la estructura anular de estos ligandos.
Ante la incertidumbre sobre la relevancia clínica de los cambios de la señal T1 en diversas estructuras del SNC, más tarde también con depósitos de gadolinio demostrables en otros tejidos (huesos, riñones, reticuloendoteliales) [17,18], surgieron numerosas preguntas nuevas en torno al gadolinio. ¿Cómo atraviesa la barrera hematoencefálica para llegar a las dos zonas cerebrales mencionadas? ¿Se vuelve a excretar lentamente a partir de ahí? ¿Puede disociarse lentamente allí y liberarse? ¿Puede haber consecuencias locales similares a las de la NSF? ¿Y los depósitos en el resto del tejido corporal? ¿Cómo se comparan los macrociclos con la KM lineal? Además de las observaciones agudas, ¿existen también consecuencias a largo plazo que aún no pueden evaluarse adecuadamente?
Así pues, además del perfil de tolerabilidad aguda de los preparados de gadolinio, que como la mayoría de los medios de contraste pueden provocar reacciones de hipersensibilidad (alérgicas, de tipo alérgico) o, a dosis más elevadas, nefropatía inducida por el Gd-KM, ahora han cobrado importancia las cuestiones relativas a la tolerabilidad subcrónica y crónica del Gd-KM. En última instancia, en el caso de tiempos de retención más largos o incluso de residuos pequeños, los expertos no pueden descartar por completo un cierto riesgo de síntomas de intoxicación crónica o tardía, aunque no haya indicios de ello, y ello a pesar de varios cientos de millones de aplicaciones de Gd-KM en total.
¿Y más?
De forma no del todo inesperada, ya que la RMN afecta a prácticamente todas las patologías, se produjeron otras reacciones adversas al fármaco (RAM) parcialmente inexplicadas en relación con la administración de Gd-KM. No siempre estaba claro si el examen de RM o el medio de contraste administrado eran los responsables de los síntomas observados. En particular, los dos expertos Semelka (Durham) y Ramalho fueron los primeros en postular una denominada “enfermedad por depósito de gadolinio”, que encontraron en casos raros y sin una conexión causal clara en sus pacientes con RM incluso con una función renal completamente normal [19]. Las manifestaciones clínicas típicas incluyen toda una serie de dolores de cabeza, óseos o articulares persistentes e inespecíficos. A veces se acompaña de proliferación de tejidos blandos subcutáneos, engrosamiento, dolor periférico en brazos y piernas, que se describe como quemazón o corte. Estos efectos se produjeron en parte tras una sola aplicación de gadolinio y en diferentes periodos de tiempo (de unos días a meses) tras el examen de RM y no pudieron asignarse a ninguna otra enfermedad. A veces, el gadolinio puede analizarse en el plasma, la orina o incluso en muestras de tejido de los pacientes. Se ha hablado de una cierta disposición genética con mayor sensibilidad. Por otra parte, la posible contaminación medioambiental con trazas de gadolinio también en las aguas residuales y, por tanto, en la cadena alimentaria se convirtió cada vez más en el centro de interés con la demanda de un mejor tratamiento de las aguas residuales en torno a los hospitales o para los exámenes de RM. Aunque se han descrito numerosos mecanismos tóxicos e interacciones del gadolinio con las funciones endógenas, que podrían desempeñar un papel especialmente en el ámbito de la toxicidad inducida por citocinas y quimiocinas, los efectos de los canales de calcio, los formadores de radicales de oxígeno reactivos o en el ámbito del MMPS, así como la neurotoxicidad, falta una relación causal clara.
Las trazas de gadolinio que a veces aún pueden detectarse después de meses o años en el tejido del SNC, pero también en el resto del organismo, con cantidades más elevadas después de complejos lineales de Gd, llevan a preguntarse cómo puede explicarse esa cinética. Gracias a una intensa colaboración de investigación entre el Departamento de Medicina Forense de la Universidad de Zúrich y el Departamento de Radiología del Hospital Cantonal de Baden, fueron uno de los primeros grupos de investigación en demostrar clínicamente que el gadolinio inyectado también puede detectarse en pequeñas cantidades en el líquido cefalorraquídeo [20]. En más de 60 pacientes que habían recibido una resonancia magnética y en los que estaba clínicamente indicada una muestra de LCR, se pudo cuantificar el contenido de gadolinio mediante ICP-MS en comparación con un grupo de control. De forma bastante inesperada, todos los pacientes expuestos al gadoterato mostraron una medición positiva correspondiente, con diferencias parcialmente elevadas en función del paciente y también de la enfermedad preexistente, por lo que los dispositivos analíticos utilizados son extremadamente sensibles. En dos pacientes de control, que también dieron positivo para gadolinio en el LCR, se comprobó posteriormente un examen anterior de IRM con gadolinio. Durante unas ocho horas después de la inyección, la concentración de gadolinio en el LCR aumenta de forma lenta pero constante, seguida de una eliminación lenta y prolongada durante periodos de tiempo muy largos. El resultado es un valor pico mucho más tardío y una eliminación muy lenta en comparación con el plasma. Las mediciones en el LCR se realizaron mediante el método de espectroscopia de masas ICP, muy sensible y preciso, que, sin embargo, no permite diferenciar el tipo de enlace químico del gadolinio (si está libre o unido a un complejo sólido). Las mediciones del LCR podrían ser la clave del paso del gadolinio incluso con una barrera hematoencefálica intacta -probablemente tiene lugar a través del plexo coroideo y, en el mejor de los casos, más allá a través de la circulación glinfática-, aunque todo esto sigue siendo especulativo. Dependiendo de la estabilidad de los complejos de gadolinio, cabe esperar una tasa de disociación, transmetalación e intercambio diferente con otros electrolitos, iones metálicos y también fosfatos/hidróxidos en el LCR.
Quedan abiertos muchos interrogantes sobre la eliminación y redistribución desde estos compartimentos distales, posiblemente hacia determinadas zonas cerebrales; hay que aclarar en qué forma queda finalmente el gadolinio, si se redistribuye y si se vuelve a excretar lentamente a través de los espacios perivasculares, en su caso. En principio, hay que subrayar que ni siquiera los expertos se ponen de acuerdo sobre el significado de las observaciones anteriores. En particular, la importancia de los numerosos efectos subtóxicos de las distintas formas de gadolinio (según la forma de unión y la dosis) con consecuencias preclínicas o también clínicas, sigue abierta. Así, se ha descrito la inducción de necrosis y apoptosis en las células del túbulo renal, un aumento de la citotoxicidad u otras reacciones nefrotóxicas, hematotóxicas, neurotóxicas o inflamatorias [21]. Mientras que las autoridades europeas han prohibido categóricamente la comercialización de los preparados lineales de gadolinio, más inestables, las autoridades sanitarias estadounidenses se muestran en general más prudentes, recomendando el uso de los preparados macrocíclicos de Gd, más estables, en casos de uso repetido o también en pediatría, pero sin duda permitiendo también el uso clínico continuado de los complejos lineales, más inestables. Esto con la indicación de que hasta el momento no se conocen efectos adversos con respecto a los depósitos de gadolinio, no pueden detectarse cambios histopatológicos y aún quedan numerosas cuestiones abiertas en relación con la cinética. La Agencia Suiza del Medicamento, Swissmedic, aún no ha adoptado una posición clara.
Como ocurre tan a menudo en la medicina moderna, nos dejamos llevar un tanto acríticamente por puro entusiasmo ante la nueva técnica de imagen de baja radiación con un contraste pronunciado de los tejidos blandos y un Gd-KM excelentemente tolerado. En la actualidad, es importante utilizar los medios de contraste que contienen gadolinio de una forma clínica bien indicada y sensata. Cuando se utilizan los complejos de gadolinio macrocíclicos más estables o los insertos individuales de MRKM específicos para el hígado, actualmente no hay indicios de ninguna enfermedad secundaria asociada a pesar de las trazas y los posibles aumentos de la señal T1 en varios tejidos, incluso durante periodos de tiempo más largos. Por un lado, es importante no malinterpretar el posible aumento de señal tras la administración secuencial de varias dosis de gadolinio en las imágenes nativas y, por otro, comparar el beneficio potencial de la administración de gadolinio con el riesgo extremadamente bajo. Debe informarse a los pacientes del beneficio primordial de la administración de contraste de gadolinio cuando esté clínicamente indicado y para descartar patologías.
Mensajes para llevarse a casa
- Los Gd-KM se utilizan sobre todo i.v. a una dosis de 0,1 mmol Gd/kg de peso corporal. Las aplicaciones especiales, como los exámenes hepáticos o la angiografía vascular, requieren dosis más bajas. En la artrografía por RM directa, en la que el Gd-KM se inyecta intraarticularmente, se necesitan dosis muy bajas de Gd-KM.
- El Gd-KM debe utilizarse a la dosis más baja posible. En caso de administración repetida y los riesgos correspondientes, cada administración debe sopesarse cuidadosamente y debe utilizarse el Gd-KM macrocíclico más estable. En pacientes con insuficiencia renal con una TFGe <30 ml/min/1,73 m2 , puede administrarse un máximo de una dosis única de Gd-KM (=0,1 mmol/kg de peso vivo) a lo largo de siete días.
- Se pueden detectar trazas de gadolinio en los tejidos tras múltiples aplicaciones con métodos químicos modernos (ICP-MS), incluso durante un periodo de tiempo más largo, pero sin relevancia clínica ni secuelas asociadas.
- En la práctica clínica deben tenerse en cuenta las propiedades específicas de cada uno de los preparados de gadolinio.
Literatura:
- Czeyda-Pommersheim F, Martin DR, Costello JR, Kalb B: Agentes de contraste para la obtención de imágenes por RM. Magn Reson Imaging Clin N Am 2017; 25: 705-711.
- Yuan Jm Chow SK, Yeung DK, King AD: A five-colour-coded color mapping method for DCE-MRI analysis of head and neck tumours. Radiología clínica 2012; 67: 216-223.
- Roberts TP, Mikulis D: Neuro RM: principios. JMRI 2007; 26: 823-837.
- Durmo F, et al: Caracterización de tumores cerebrales mediante evaluación multibiométrica de la IRM. Tomoy 2018; 4: 14-25.
- Port M, et al: Eficacia, estabilidad termodinámica y cinética de los quelatos de gadolinio comercializados y sus posibles consecuencias clínicas: una revisión crítica. Biometals 2008; 21: 469-490.
- Matoori S, Gutzeit A, Fröhlich JM: Fibrosis sistémica nefrogénica en 2015. Foro Med Suiza 2015; 15: 340-344.
- Grobner T: Gadolinio: ¿un desencadenante específico del desarrollo de la dermopatía fibrosante nefrogénica y la fibrosis sistémica nefrogénica? Nephrol Dial Transplant 2006; 21: 1104-1108.
- Cowper SE, et al: Enfermedades cutáneas similares al escleromixoedema en pacientes en diálisis renal. Lancet 2000; 356: 1000-1001.
- Cowper SE: Dermopatía fibrosante nefrógena: los primeros 6 años. Curr Opin Rheumatol 2003; 15: 785-790.
- Girardi M, et al: Fibrosis sistémica nefrogénica: definición clinicopatológica y recomendaciones para los exámenes. J Am Acad Dermatol 2011; 65: 1095-1106.
- Grebe S, et al.: Inflamación crónica y aterosclerosis acelerada como cofactores importantes en la fibrosis sistémica nefrogénica tras la exposición al gadolinio intravenoso. Clin Exp Nephrol 2008; 12: 403-406.
- Bennett Cl, et al: Fibrosis sistémica nefrogénica inducida por gadolinio: auge y caída de una enfermedad iatrogénica. Clin Kidney J 2012; 5: 82-88.
- Kanda T, et al: Alta intensidad de señal en el núcleo dentado y el globo pálido en imágenes de RM ponderada en T1 sin realzar: relación con el aumento de la dosis acumulada de un material de contraste a base de gadolinio. Radiología 2014; 270(3): 834-841.
- Pozeg P, et al.: Patrón espacio-temporal del aumento de la hiperintensidad relacionada con el gadolinio en los núcleos cerebrales profundos. Congreso Suizo de Radiología, Lausana 10-12 de mayo de 2018; SS149.
- McDonald RJ, et al: Depósito intracraneal de gadolinio tras la RM con contraste. Radiología 2015; 275: 772-782.
- Agencia Europea del Medicamento EMA. El dictamen final de la EMA confirma las restricciones al uso de agentes lineales de gadolinio en las exploraciones corporales. www.ema.europa.eu/ema/index.jsp?curl=pages/medicines/human/referrals/Gadolinium-containing_contrast_agents/human_referral_prac_000056.jsp (consultado el 22.5.2018).
- Murata N, Murata K, Gonzalez-Cuyar LF, Maravilla MR: Deposición tisular de gadolinio en cerebro y hueso. Magn Reson Imaging 2016; 34: 1359-1365.
- McDonald RJ, et al: Comparación de las concentraciones de gadolinio en múltiples órganos de rata tras la administración intravenosa de quelatos de gadolinio lineales frente a macrocíclicos. Radiology 2017; 285: 536-545.
- Ramalho M, Ramalho J, Burke LM, Semelka RC: Retención y toxicidad del gadolinio – una actualización. Adv Chronic Kidney Dis 2017; 24: 138-146.
- Berger F, et al.: Distribución del gadolinio en el líquido cefalorraquídeo tras la administración de un agente de contraste de RM basado en gadolinio en humanos. Radiología 2018; https://doi.org/10.1148/radiol.2018171829.
- Rogosnitzky M, Branch S: Toxicidad de los agentes de contraste basados en Gd: una revisión de los mecanismos conocidos y propuestos. Biometals 2016; 29: 365-376.
InFo NEUROLOGÍA Y PSIQUIATRÍA 2018; 16(4): 23-29.